Метагидроксид кобальта (Bymgin;jktvn; tkQgl,mg)
Перейти к навигации
Перейти к поиску
| Метагидроксид кобальта | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
Метагидроксид кобальта |
| Традиционные названия | гидроксооксид кобальта (III) |
| Хим. формула | CoO(OH) |
| Физические свойства | |
| Состояние | чёрные кристаллы |
| Молярная масса | 91,94 г/моль |
| Плотность |
аморф. 4,29 крист. 4,72-4,90 г/см³ |
| Твёрдость | 3-5 (по шкале Мооса) |
| Термические свойства | |
| Энтальпия | |
| • образования | -435 кДж/моль |
| Классификация | |
| Рег. номер CAS | 12016-80-7 |
| PubChem | 61540 |
| Рег. номер EINECS | 234-614-7 |
| SMILES | |
| InChI | |
| ChemSpider | 55458 |
| Безопасность | |
| Предельная концентрация | 0,5 мг/кг |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Метагидроксид кобальта — неорганическое соединение, гидроксооксид металла кобальта с формулой CoO(OH), тёмно-коричневый аморфный осадок или чёрные кристаллы, не растворимые в воде.
Получение
[править | править код]- В природе встречается минерал гетерогенит — CoO(OH) с различными примесями.
- Окисление гидроксида кобальта(II):
- Окисление растворимой соли двухвалентного кобальта в щелочной среде:
- Осаждение щелочами из раствора солей трёхвалентвого кобальта:
Физические свойства
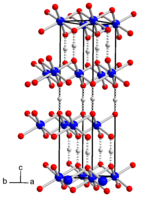
[править | править код]Метагидроксид кобальта образует чёрные кристаллы тригональной сингонии, пространственная группа R 3m, параметры ячейки a = 0,2851 нм, c = 1,3150 нм, Z = 3. При высокой температуре и давлении переходит в другую модификацию ромбической сингонии, пространственная группа P bnm, параметры ячейки a = 0,4353 нм, b = 0,9402 нм, c = 0,2840 нм, Z = 4.
Не растворяется в воде, р ПР = 42,60.
Химические свойства
[править | править код]- Разлагается при нагревании:
- С концентрированными кислотами проявляет себя как окислитель:
Примечания
[править | править код]- ↑ Третьяков Ю.Д. Неорганическая Химия. Химия элементов. Том 1. — 2-е. — МГУ; ИКЦ "Академкнига", 2007. — С. 442. — 537 с.
Литература
[править | править код]- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1990. — Т. 2. — 671 с. — ISBN 5-82270-035-5.
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1972. — Т. 2. — 871 с.
Это заготовка статьи о неорганическом веществе. Помогите Википедии, дополнив её. |






