Пирогаллол (Hnjkigllkl)
| Пирогаллол | |||
|---|---|---|---|
| |||
 | |||
| Общие | |||
| Систематическое наименование |
1,2,3-триоксибензол | ||
| Традиционные названия | пирогаллол, пирогалловая кислота, 1,2,3-тригидроксибензол | ||
| Хим. формула | C6H6O3 | ||
| Физические свойства | |||
| Молярная масса | 126,11 г/моль | ||
| Плотность | 1,453 г/см³ | ||
| Термические свойства | |||
| Температура | |||
| • плавления | 133—134 °C | ||
| • кипения | 309 °C | ||
| Химические свойства | |||
| Растворимость | |||
| • в воде | 40 г/100 мл (13 °C) | ||
| Классификация | |||
| Рег. номер CAS | 87-66-1 | ||
| PubChem | 1057 | ||
| Рег. номер EINECS | 201-762-9 | ||
| SMILES | |||
| InChI | |||
| ChEBI | 16164 | ||
| ChemSpider | 13835557 | ||
| Безопасность | |||
| Предельная концентрация | 0,1 мг/л в воде | ||
| ЛД50 | 0,57 г/кг (мыши, перорально) | ||
| Токсичность | вызывает дерматозы | ||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Пирогалло́л (пирогалловая кислота, 1,2,3-тригидроксибензол) — органическое соединение, трехатомный фенол с химической формулой C6H6O3, бесцветные кристаллы, темнеющие на воздухе. Применяется в органическом синтезе как восстановитель, также используется в промышленности как полупродукт в производстве красителей, в фотографии как проявляющее вещество.
История
[править | править код]Как проявляющее вещество пирогаллол впервые использовал Фредерик Скотт Арчер для мокроколлодионного процесса в 1850 году[1].
Физические свойства
[править | править код]Обычно представляет собой бесцветные блестящие игольчатые кристаллы, темнеющие на воздухе. Плавится при 133—134 °C. Кипит при 309 °C (при нормальном давлении) и при 171,5 °C (при давлении 12 мм рт.ст.). Имеет относительную плотность = 1,453 и молярную массу 126,11 г/моль[2][3].
Хорошо растворим в эфире, этаноле, воде (40 г/100 мл при 13 °C) и растворах щелочей. Плохо растворяется в бензоле, хлороформе и четырёххлористом углероде[2].
Реактив должен храниться в плотно закрытой тёмной стеклянной посуде[3].
Химические свойства
[править | править код]Проявляет свойства фенолов, обладает лёгкой окисляемостью. Раствор пирогаллола и щёлочи количественно и быстро поглощает кислород, что используется в аналитической химии для газового анализа. Будучи сильным восстановителем, активно восстанавливает соли серебра и золота[2].
При окислении перекисью водорода, иодатом натрия, солями трехвалентного железа и другими окислителями пирогаллол образует пурпурогаллин[англ.], если же применять 1,2-бензохинон или пирокатехин в качестве соокислителей, то образуются другие бензотрополоны[2].
Легко вступает в реакции электрофильного замещения, такие как галогенирование, сульфирование и ряд других. Например, в реакции бромирования жидким бромом в четыреххлористом углероде пирогаллол образует 4,5,6-трибромпирогаллол; если же бром будет в избытке, то реакция вместо этого приведёт к 1,2,6,6-тетрабром-1-циклогексен-3,4,5-триону[2].
Фотографические свойства
[править | править код]В процессе фотографического проявления в растворах проявителей, содержащих низкую концентрацию сохраняющих веществ, пирогаллол образует нерастворимые окрашенные продукты окисления, остающие в эмульсионном слое после обработки. Эти продукты имеют жёлто-коричневую окраску и обладают дубящими свойствами для желатины фотоэмульсии. Такие составы получили название «окрашивающих проявителей» (англ. staining developers), при использовании которых фотографическое изображение, состоящее из восстановленного металлического серебра дополняется этими продуктами окисления пирогаллола, в результате итоговая плотность изображения оказывается выше, чем это можно получить при нормальном проявлении. Кроме этого, при таком проявлении значительно улучшается и визуальная зернистость фотоматериала[1].
Растворы пирогаллола очень нестабильны на воздухе, даже если они содержат сохраняющие вещества, поэтому их обычно готовят перед применением. Если увеличивать концентрацию сохраняющих веществ, то это не слишком сильно увеличивает срок использования, но приводит к быстрой потере дубящих и окрашивающих свойства проявителя. Срок хранения обычных проявителей с пирогаллолом в виде раствора составляет не более 2—3 суток[1][3].
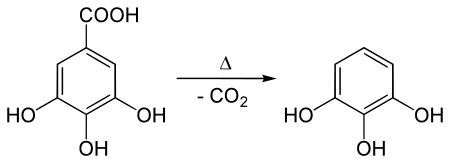
Получение
[править | править код]Промышленный синтез производится путём пиролиза (декарбоксилированием) галловой кислоты[2][4]:
Плав пирогаллола, полученный в результате пиролиза, пригоден для технических целей без дополнительной очистки. Для медицинского применения или получения чистого реактива технический пирогаллол очищают путём сублимирования или перегонкой в вакууме[4].
С этим методом синтеза связано название вещества.
Может быть выделен также из продуктов перегонки каменного угля, где присутствует вместе с другими фенолами.
Применение
[править | править код]В промышленности
[править | править код]Применяется для синтеза красителей, использующихся для окраски меха и волос[2].
Для определения ряда элементов, в газовом анализе для определения кислорода.
В фотографии
[править | править код]Используется как проявляющее вещество, позволяющее получить плотное изображение, с коричневым оттенком и нормальным контрастом[3]. В умеренно щелочных проявителях пирогаллол работает относительно медленно и даёт мягкое изображение. Для более быстрой работы можно использовать хромокалиевые квасцы или 1,4-фенилендиамин, активирующие проявление пирогаллолом[1].
Пирогаллол имеет также дубящий эффект, благодаря чему применяется в гидротипном процессе для получения желатиновых рельефных матриц на матричной киноплёнке[3].
В косметике
[править | править код]Применяется как краска для волос, средство для ухода за кожей.
Токсичность
[править | править код]Для мышей половинная летальная доза составляет 0,57 г/кг при пероральном введении. При попадании на кожу вызывает дерматозы. ПДК в воде 0.1 мг/л[2]. Значительно более ядовит, чем два других триоксибензола (флороглюцин и гидроксигидрохинон).
Рейтинг NFPA 704: опасность для здоровья: 2, огнеопасность: 1, нестабильность: 0[5].
См. также
[править | править код]- Гидроксигидрохинон (1,2,4-триоксибензол)
- Флороглюцин (1,3,5-триоксибензол)
Примечания
[править | править код]- ↑ 1 2 3 4 Haist, 1979, с. 174—175.
- ↑ 1 2 3 4 5 6 7 8 Пуца, 1992.
- ↑ 1 2 3 4 5 Иофис, 1981.
- ↑ 1 2 Швицер, 1934, с. 267—269.
- ↑ Fisher Scientific.
Литература
[править | править код]- Пуца Г. И. Пирогаллол // Химическая энциклопедия : в 5 т. / Гл. ред. И. Л. Кнунянц. — М.: Большая Российская энциклопедия, 1992. — Т. 3: Меди — Полимерные. — С. 531. — 639 с. — 48 000 экз. — ISBN 5-85270-039-8.
- Пирогаллол // Фотокинотехника: Энциклопедия / Гл. ред. Е. А. Иофис. — М.: Советская энциклопедия, 1981. — С. 237. — 447 с.
- Швицер Ю. Производство химико-фармацевтических и техно-химических препаратов. — Москва—Ленинград: ОНТИ НКТП СССР / Московская редакция химической литературы, 1934.
- Haist G. M. Modern Photographic Processing. — New York, Chichester, Brisbane, Toronto: John Whiley and sons, 1979. — Т. 1. — (Photographic science and technology and graphic arts). — ISBN 0-471-02228-4.
Ссылки
[править | править код]- Pyrogallol (англ.). Material Safety Data Sheet. Fisher Scientific. Дата обращения: 14 января 2019. Архивировано 31 июля 2010 года.