Тиосульфат аммония (Mnkvrl,sgm gbbkunx)
| Тиосульфат аммония | |
|---|---|
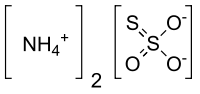 | |
| Общие | |
| Систематическое наименование |
Тиосульфат аммония |
| Традиционные названия | Тиосернокислый аммоний |
| Хим. формула | (NH4)2SO3S |
| Физические свойства | |
| Состояние | бесцветные кристаллы |
| Молярная масса | 148,21 г/моль |
| Плотность | 1,68 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | разл. 150 °C |
| Химические свойства | |
| Растворимость | |
| • в воде | 103,3100 г/100 мл |
| Классификация | |
| Рег. номер CAS | 7783-18-8 |
| PubChem | 6096946 |
| Рег. номер EINECS | 231-982-0 |
| SMILES | |
| InChI | |
| ChEBI | 147402 |
| ChemSpider | 4807475 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Тиосульфа́т аммо́ния (гипосульфит аммония, аммоний серноватистокислый) — неорганическое соединение, соль аммония и тиосерной кислоты с формулой (NH4)2SO3S, бесцветные кристаллы, растворимые в воде. Применяется в фотографии как основной компонент быстрых фиксажей.
Получение
[править | править код]- Медленная реакция суспензии серы с раствором гидрата аммония:
- Медленное окисление на воздухе гидросульфида аммония:
- Слияние горячих растворов гидросульфида аммония и гидросульфита аммония:
Физические свойства
[править | править код]Тиосульфат аммония образует бесцветные кристаллы с запахом аммиака, хорошо растворимые в воде, слабо растворимые в ацетоне, не растворяются в этаноле.
Химические свойства
[править | править код]- Разлагается при нагревании с образованием смеси продуктов:
- Медленно разлагается в разбавленных растворах:
- Разлагается концентрированными кислотами:
- и горячими разбавленными кислотами:
- Реагирует с галогенами:
Как и тиосульфат натрия, реагирует с галогенидами серебра, образуя растворимые комплексы, что позволяет осуществлять процесс фиксирования при обработке фотографических материалов. В отличие от тиосульфата натрия, который позволяет достигать концентрации 6 г. серебра на литр раствора, тиосульфат аммония позволяет почти удвоить это количество, снижая тем самым расход реактивов. Процесс фиксирования также происходит значительно быстрее (на 50 % для некоторых эмульсий), чем для фиксажей с тиосульфатом натрия[1].
Однако слишком длительная обработка в фиксажах приводит к растворению металлического серебра в областях низкой плотности и потере деталей на изображении. Эффект особенно сильно выражен на мелкозернистых эмульсиях и быстрых фиксажах на тиосульфате аммония (из-за их большей активности), что требует точного соблюдения температурно-временно́го регламента процесса обработки. Также, для уменьшения этого эффекта, быстрые фиксажи применяются в различных степенях разбавления для плёнок и для фотобумаг; при этом для фотобумаг, имеющих более мелкозернистую эмульсию, требуется применять примерно в два раза более сильное разбавление[1].
Применение
[править | править код]Используется как компонент фиксирующих растворов в фотографии вместо тиосульфата натрия для ускорения процесса фиксирования. Так как имеет плохую сохранность в кристаллической форме, то часто непосредственно перед применением для этой цели его готовят в растворе, смешивая тиосульфат натрия с хлоридом аммония[2].
Примечания
[править | править код]- ↑ 1 2 Eaton, 1965, с. 82.
- ↑ Гурлев, 1988, с. 285.
Литература
[править | править код]- Гурлев Д. С. Справочник по фотографии (обработка фотоматериалов). — К.: Тэхника, 1988.
- Лидин Р. А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
- Справочник химика / Редкол.: Никольский Б. П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Eaton G. Photographic chemistry in black-and-white and color photograpy (неопр.). — second edition. — N. Y.: Morgan & Morgan, Inc., Publishers Hastings-on-Hudson, 1965.

![{\displaystyle {\mathsf {NH_{4}HS\ {\xrightarrow[{-NH_{3}}]{O_{2}}}\ S,(NH_{4})_{2}S_{n},(NH_{4})_{2}SO_{3}S}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9205aac5a7b875cf2937cbec0146da7559fedf33)





