Энфувиртид (|usrfnjmn;)
| Энфувиртид | |
|---|---|
 | |
| Химическое соединение | |
| Брутто-формула | C204H301N51O64 |
| CAS | 159519-65-0 |
| PubChem | 16130199 |
| DrugBank | DB00109 |
| Состав | |
| Классификация | |
| АТХ | J05AX07 |
| Фармакокинетика | |
| Биодоступн. | 84.3% (SC) |
| Связывание с белками плазмы | 92% |
| Метаболизм | Liver |
| Период полувывед. | 3.8 hours |
| Экскреция | unknown |
| Другие названия | |
| Не зарегистрирован в РФ | |
Энфувиртид (МНН) — это ингибитор слияния ВИЧ, первый из класса антиретровирусных препаратов, используемых в антиретровирусной терапии для лечения инфекции ВИЧ-1[1]. Он продается под торговой маркой Fuzeon.
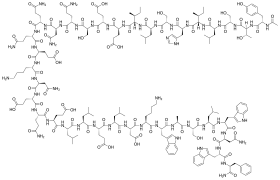
Структурная формула
[править | править код]Ac-Tyr-Thr-Ser-Leu-Ile-His-Ser-Leu-Ile-Glu-Glu-Ser-Gln-Asn-Gln-Gln-Glu-Lys-Asn-Glu-Gln-Glu-Leu-Leu-Glu-Leu-Asp-Lys-Trp-Ala-Ser-Leu-Trp-Asn-Trp-Phe-NH2
История
[править | править код]Энфувиртид был создан в Университете Дьюка, где исследователи основали фармацевтическую компанию, известную как Trimeris. Тримерис начал разработку энфувиртида в 1996 году и первоначально обозначил его как Т-20. В 1999 году Trimeris вступил в партнерство с Hoffmann-La Roche, чтобы завершить разработку препарата. Он был одобрен Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) 13 марта 2003 года[2] как первый ингибитор слияния ВИЧ, новый класс антиретровирусных препаратов. Он был одобрен на основе двух исследований, в которых сравнивалось влияние оптимизированных схем антиретровирусного лечения с добавлением энфувиртида и без него на вирусную нагрузку в сыворотке.
Фармакология
[править | править код]Механизм действия
[править | править код]Энфувиртид действует, нарушая молекулярный механизм ВИЧ-1 на заключительном этапе слияния с клеткой-мишенью, предотвращая инфицирование неинфицированных клеток. Биомиметический пептид, энфувиртид был разработан для имитации компонентов механизма слияния ВИЧ-1 и их замещения, предотвращая нормальное слияние. Лекарства, которые нарушают слияние вируса и клетки-мишени, называются ингибиторами проникновения или ингибиторами слияния. ВИЧ связывается с рецептором CD4 + клетки хозяина через вирусный белок gp120; gp41, вирусный трансмембранный белок, затем претерпевает конформационное изменение, которое способствует слиянию вирусной мембраны с мембраной клетки-хозяина. Энфувиртид связывается с gp41, предотвращая создание поры входа для капсида вируса, удерживая его вне клетки[3].
Микробиология
[править | править код]Энфувиртид считается активным только против ВИЧ-1. Низкая активность против изолятов ВИЧ-2 была продемонстрирована in vitro[4]. Различная восприимчивость к энфувиртиду наблюдалась у клинических изолятов, причем приобретенный иммунитет был результатом мутировавшего 10 аминокислотного мотива в вирусном gp41. Однако первичное сопротивление пока не наблюдается[5].
Клиническое использование
[править | править код]Показания
[править | править код]Энфувиртид показан для лечения ВИЧ-1-инфекции в сочетании с другими антиретровирусными препаратами у пациентов, у которых все другие методы лечения оказались неэффективными[6].
Лекарственные формы
[править | править код]Благодаря своей пептидной природе энфувиртид продается в форме для инъекций. Лиофилизированный порошок энфувиртида должен быть подготовлен пациентом и вводиться дважды в день путем подкожной инъекции. В связи с хроническим характером этого вида терапии, эта лекарственная форма может быть серьезной проблемой для соблюдения пациентом режима приема лекарств[7].
Побочные эффекты
[править | править код]Общие побочные реакции на препарат (≥1 % пациентов), связанные с терапией энфувиртидом, включают: реакции в месте инъекции (боль, уплотнение кожи, эритема, киста, зуд; наблюдаются почти у всех пациентов, особенно в первую неделю), периферическая невропатия, бессонница, депрессия, кашель, одышка, анорексия, артралгия, инфекции (включая бактериальную пневмонию) и / или эозинофилию. Нечасто возникают различные реакции гиперчувствительности (0,1-1 % пациентов), симптомы которых включают сыпь, лихорадку, тошноту, рвоту, озноб, гипотензию, повышение уровня печеночных трансаминаз; и, возможно, более тяжелые реакции, включая респираторный дистресс, гломерулонефрит и / или анафилаксию — повторное лечение не рекомендуется[6].
Примечания
[править | править код]- ↑ Говард Либман, Харви Дж. Макадон. ВИЧ-инфекция", пер. с англ., (2013), стр. 519.
- ↑ Drugs@FDA: FDA Approved Drug Products – Fuzeon (Click on 'Approval Date(s) and History, Letters, Labels, Reviews for NDA 021481'). accessdata.fda.gov. United States Food and Drug Administration. Дата обращения: 6 января 2019. Архивировано 28 июня 2017 года.
- ↑ Lalezari JP, Eron JJ, Carlson M, Cohen C, DeJesus E, Arduino RC, et al. (March 2003). "A phase II clinical study of the long-term safety and antiviral activity of enfuvirtide-based antiretroviral therapy". AIDS. 17 (5): 691—8. doi:10.1097/00002030-200303280-00007. PMID 12646792.
- ↑ Roche Products Pty Ltd. Fuzeon (Australian Approved Product Information). Dee Why (NSW): Roche; 2005.
- ↑ Greenberg ML, Cammack N (August 2004). "Resistance to enfuvirtide, the first HIV fusion inhibitor". The Journal of Antimicrobial Chemotherapy. 54 (2): 333—40. doi:10.1093/jac/dkh330. PMID 15231762.
- ↑ 1 2 Australian Medicines Handbook. — Adelaide : Australian Medicines Handbook Pty Ltd, 2006. — ISBN 0-9757919-2-3.
- ↑ Klein, Richard FDA approves Fuzeon. fda.gov (13 марта 2003). Дата обращения: 2 июля 2011. Архивировано 25 августа 2009 года.