Изолейцин (N[klywenu)
| Изолейцин | |||
|---|---|---|---|
  | |||
| Общие | |||
| Сокращения |
Иле, Ile, I AUU,AUC,AUA |
||
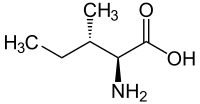
| Хим. формула | HO2CCH(NH2)CH(CH3)CH2CH3 | ||
| Рац. формула | C6H13NO2 | ||
| Физические свойства | |||
| Молярная масса | 131,17 г/моль | ||
| Химические свойства | |||
| Константа диссоциации кислоты | 9,758[1] | ||
| Классификация | |||
| Рег. номер CAS | 73-32-5 | ||
| PubChem | 6306 и 7043901 | ||
| Рег. номер EINECS | 200-798-2 | ||
| SMILES | |||
| InChI | |||
| ChEBI | 17191 и 58045 | ||
| ChemSpider | 6067 | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Изолейцин (сокращённо Ile или I; 2-амино-3-метилпентановая кислота)[2] — алифатическая α-аминокислота, имеющая химическую формулу HO2CCH(NH2)CH(CH3)CH2CH3 и входящая в состав всех природных белков. Является незаменимой аминокислотой, что означает, что изолейцин не может синтезироваться в организме человека и должен поступать в него с пищей. Участвует в энергетическом обмене. При недостаточности ферментов, катализирующих декарбоксилирование изолейцина, возникает кетоацидоз.
Кодоны изолейцина: AUU, AUC и AUA.
Вместе с валином и лейцином входит в число аминокислот с разветвлёнными боковыми цепями.
Обладая углеводородной боковой цепью, изолейцин относится к числу гидрофобных аминокислот. Характерной особенностью боковой цепи изолейцина является её хиральность (второй такой аминокислотой является треонин). Для изолейцина возможно четыре стереоизомера, включая два возможных диастереоизомера L-изолейцина. В природе, однако, изолейцин присутствует лишь в одной энантиомерной форме — (2S,3S)-2-амино-3-метилпентановая кислота.
Аминокислота была открыта немецким химиком и биохимиком Феликсом Эрлихом в 1906 году.
Биосинтез
[править | править код]Как и другие незаменимые аминокислоты, изолейцин не синтезируется в организмах животных, и должен поступать извне, обычно в составе белков. В растениях и микроорганизмах изолейцин синтезируется посредством нескольких стадий, начиная от пировиноградной кислоты и α-кетобутирата; процесс катализируется рядом ферментов[3], среди которых треониндезаминаза.
Синтез
[править | править код]Изолейцин может быть синтезирован по многостадийной схеме, начиная с 2-бромбутана и диэтилмалоната. О получении изолейцина синтетическим путём впервые было сообщено в 1905[4].
Применение
[править | править код]Изолейцин активирует синтез мышечного белка по механизму mTOR. В свете этого фактора используется в косметологии для регенерации старой кожи.
Повышенная потребность в изолейцине наблюдается у грудных детей. Также потребность увеличивается после потери крови, ожогов, растяжении и прочих процессов, сопровождаемых регенерацией тканей[5].
Изолейцин – основной строительный материал[источник не указан 823 дня] для кетоновых тел и глюкозы. Таким образом, аминокислота регулирует уровень сахара в крови.
Также изолейцин участвует в процессе синтеза гемоглобина.
Вместе с тем изолейцин защищает организм от чрезмерной выработки серотонина.[источник не указан 860 дней]
Примечания
[править | править код]- ↑ Weast R. C. CRC Handbook of Chemistry and Physics (1st student edition) (англ.) / R. C. Weast — 1 — CRC Press, 1988. — ISBN 978-0-8493-0740-9
- ↑ IUPAC-IUBMB Joint Commission on Biochemical Nomenclature. Nomenclature and Symbolism for Amino Acids and Peptides (англ.). Recommendations on Organic & Biochemical Nomenclature, Symbols & Terminology etc. Дата обращения: 17 мая 2007. Архивировано 24 ноября 2011 года.
- ↑ Nelson, D. L.; Cox, M. M. «Lehninger, Principles of Biochemistry» 3rd Ed. Worth Publishing: New York, 2000. ISBN 1-57259-153-6
- ↑ Bouveault and Locquin, Compt. rend., 141, 115 (1905).
- ↑ Х.-Д. Якубке, Х. Ешкайт. Аминокислоты. Пептиды. Белки. Chemnet. Москва "Мир" (1985). Дата обращения: 21 февраля 2021. Архивировано 31 марта 2020 года.
Это заготовка статьи по биохимии. Помогите Википедии, дополнив её. |


