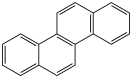
Хризен (}jn[yu)
| Хризен | |||
|---|---|---|---|
| |||
| Общие | |||
| Хим. формула | C18H12 | ||
| Физические свойства | |||
| Молярная масса | 228.28 г/моль | ||
| Плотность | 1.274 г/см3 г/см³ | ||
| Энергия ионизации | 7,59 эВ[1] | ||
| Термические свойства | |||
| Температура | |||
| • плавления | 254 °C | ||
| • кипения | 448 °C | ||
| Классификация | |||
| Рег. номер CAS | 218-01-9 | ||
| PubChem | 9171 | ||
| Рег. номер EINECS | 205-923-4 | ||
| SMILES | |||
| InChI | |||
| RTECS | GC0700000 | ||
| ChEBI | 51687 | ||
| ChemSpider | 8817 | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Хризен — полициклический ароматический углеводород с формулой C18H12, молекула которого содержит 4 конденсированных бензольных кольца. Он входит в состав каменноугольной смолы, из которой он и был выделен. Также встречается в креозоте, веществе, применяемом для обработки древесины.
Хризен в малых количествах образуется при сжигании или перегонке угля, сырой нефти и растительного материала.
В эксперименте, симулирующем нижние слои атмосферы Юпитера, проведённом Карлом Саганом, в среде коричневатых толинов был обнаружен 4-кольцовый хризен[2].
Название «хризен» происходит от греч. Χρύσoς, chrysos, что означает «золото», и связано с золотисто-жёлтой окраской кристаллов данного углеводорода, при их первом получении. Тем не менее, чистый хризен бесцветен, а желтоватый окрас хризену придаёт примесь его изомера — тетрацена, который довольно трудно отделить[3].
Свойства
[править | править код]Хризен хорошо растворяется в горячем бензоле и ксилоле, плохо растворяется в этаноле, уксусной кислоте, сероуглероде и диэтиловом эфире. Хлорируется при действии хлора до 6,12-дихлорхризена, при реакции с сульфурилхлоридом SO2Cl2 в среде нитробензола — до 6-хлорхризена. Нитруется азотной кислотой до 6,12-динитрохризена, сульфируется при взаимодействии с хлорсульфоновой кислотой в тетрахлорметане до хризен-6-сульфокислоты.
Применение
[править | править код]Хризен используется при производстве некоторых красителей.
Безопасность
[править | править код]Предполагается, что хризен, как и другие полициклические ароматические углеводороды, является канцерогеном. По крайней мере, есть данные о том, что у лабораторных животных он вызывает рак.[4]
См. также
[править | править код]Примечания
[править | править код]- ↑ David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ Sagan, C. et al. Polycyclic aromatic hydrocarbons in the atmospheres of Titan and Jupiter (англ.) // The Astrophysical Journal : рец. науч. журнал. — 1993. — Vol. 414, no. 1. — P. 399—405. — ISSN 0004-637X. — doi:10.1086/173086. — . Архивировано 21 января 2022 года..
- ↑ Молекула дня: золотой «золотой» углеводород. Дата обращения: 14 марта 2021. Архивировано 27 октября 2020 года.
- ↑ TOXICOLOGICAL PROFILE FOR POLYCYCLIC AROMATIC HYDROCARBONS. Дата обращения: 25 февраля 2011. Архивировано 16 мая 2011 года.