Гликолиз (Ilntkln[)
Глико́лиз, или путь Эмбдена — Мейергофа — Парнаса[1] (от греч. γλυκός — сладкий и греч. λύσης — расщепление) — процесс окисления глюкозы, при котором из одной молекулы глюкозы образуются две молекулы пировиноградной кислоты. Гликолиз состоит из цепи последовательных ферментативных реакций и сопровождается запасанием энергии в форме АТФ и НАДH. Гликолиз является универсальным путём катаболизма глюкозы и одним из трёх (наряду с пентозофосфатным путём и путём Энтнера — Дудорова) путей окисления глюкозы, встречающихся в живых клетках. Реакция гликолиза в суммарном виде выглядит следующим образом:
Кислород не требуется для протекания гликолиза. В аэробных условиях пировиноградная кислота далее декарбоксилируется, соединяется с коферментом А и вовлекается в цикл Кребса. В анаэробных условиях (при гипоксии) пируват восстанавливается до молочной кислоты либо претерпевает дальнейшие превращения в ходе брожения[3][4].
Общий обзор
[править | править код]
Распад шестиуглеродного сахара глюкозы на две молекулы трёхуглеродного пирувата осуществляется в 10 стадий, первые 5 которых составляют подготовительный этап с затратой АТФ, а 5 последующих — этап, сопряжённый с образованием АТФ. Все сахара и их производные, образующиеся при гликолизе, являются D-изомерами. В ходе реакций гликолиза глюкоза сначала фосфорилируется по гидроксильной группе при шестом атоме углерода (C-6), давая глюкозо-6-фосфат (стадия 1). Глюкозо-6-фосфат затем изомеризуется в фруктозо-6-фосфат (стадия 2), который вновь фосфорилируется, на этот раз по гидроксильной группе при первом атоме углерода, при этом образуется фруктозо-1,6-бисфосфат (стадия 3). В ходе обеих этих реакций фосфорилирования донором фосфорильной группы является АТФ. Далее фруктозо-1,6-бисфосфат расщепляется на две трёхуглеродные молекулы — дигидроксиацетонфосфат и глицеральдегид-3-фосфат (стадия 4), эта стадия и дала название всему пути. Дигидроксиацетонфосфат изомеризуется в глицеральдегид-3-фосфат (стадия 5), так что к концу подготовительного этапа из глюкозы образуется 2 молекулы глицеральдегид-3-фосфата, которые в дальнейшем претерпевают одинаковые превращения. Изомеризация на стадии 2 необходима для дальнейшего фосфорилирования, а также разрыва связи С—С на стадии 4, как будет подробнее показано в дальнейшем. При этом в подготовительной стадии гликолиза расходуется 2 молекулы АТФ, что увеличивает свободную энергию промежуточных соединений пути[5].
Энергетическую выгоду даёт второй этап гликолиза, сопряжёный с образованием АТФ. Каждая из двух молекул глицеральдегид-3-фосфата окисляется и фосфорилируется фосфорной кислотой (а не АТФ), образуя 1,3-бисфосфоглицериновую кислоту (стадия 6). Выделение энергии происходит при превращении двух молекул 1,3-бисфосфоглицерата в две молекулы пирувата (стадии 7—10), и большая часть этой энергии запасается при присоединении фосфатной группы к четырём молекулам АДФ с образованием четырёх молекул АТФ. Суммарный выход составляет 2 молекулы АТФ на молекулу глюкозы, поскольку 2 молекулы АТФ расходуются в подготовительном этапе. Кроме того, во втором этапе гликолиза часть энергии запасается при образовании двух молекул восстановленного НАДH на одну молекулу глюкозы[4].
Таким образом, гликолиз включает в себя химические перестройки следующего типа:
- расщепление шестиуглеродного скелета глюкозы на два трёхуглеродных пирувата;
- фосфорилирование АДФ до АТФ, осуществляемое при отрыве фосфата от соединений с высоким потенциалом переноса фосфата, образующихся при гликолизе (таким образом, АТФ при гликолизе образуется за счёт субстратного фосфорилирования, в отличие от окислительного фосфорилирования дыхательной цепи, где АТФ образуется за счёт переноса электронов и протонов по цепи переносчиков[6]);
- перенос иона Н+ к НАД+ с образованием восстановленного НАДН[4].
Итак, суммарное уравнение гликолиза:
- Глюкоза + 2НАД+ + 2АДФ + 2Pi → 2 пируват + 2НАДH + 2Н+ + 2АТФ + 2Н2O[2].
Значение фосфорилирования промежуточных соединений
[править | править код]Каждое из 9 промежуточных соединений на пути от глюкозы к пирувату содержат остатки ортофосфорной кислоты. По-видимому, фосфатные группы в этом случае выполняют следующие 3 функции:
- Поскольку в клеточной мембране, как правило, отсутствуют белки-переносчики для фосфорилированных сахаров, фосфорилированные промежуточные соединения, а также глюкозо-6-фосфат не могут покинуть клетку. После первоначального фосфорилирования для удержания внутри клетки фосфорилированных соединений больше не нужно дополнительной энергии, несмотря на большую разницу между внутри- и внеклеточной концентрацией этих соединений.
- Фосфатные группы необходимы для хранения метаболической энергии. Энергия, которая потенциально может быть высвобождена при гидролизе фосфоангидридных[англ.] связей (например, в АТФ), частично запасается при образовании эфиров фосфорной кислоты, например, глюкозо-6-фосфата. В дальнейшем высокоэнергетические соединения, содержащие фосфатную группу и образующиеся в ходе гликолиза (1,3-бисфосфоглицерат и фосфоенолпируват), выступают в качестве доноров фосфорильной группы при образовании АТФ из АДФ.
- Энергия связывания фосфатных групп с активными центрами ферментов снижает энергию активации и увеличивает специфичность ферментативных реакций. Фосфатные группы АДФ, АТФ и промежуточных продуктов гликолиза образуют комплексы с ионами Mg2+. Места связывания субстрата многих ферментов специфичны к этим комплексам. Для активности большинства ферментов гликолиза необходим Mg2+[7].
Механизм
[править | править код]Этап 1: подготовительный этап
[править | править код]На подготовительном этапе гликолиза шестиуглеродная молекула глюкозы расщепляется на два триозофосфата. При этом затрачиваются две молекулы АТФ[7]. Подготовительный этап гликолиза включает 5 реакций, которые подробно описаны ниже.
Стадия 1: фосфорилирование глюкозы
[править | править код]В первой реакции гликолиза происходит активация молекулы глюкозы путём её фосфорилирования по шестому атому углерода (С-6) с образованием глюкозо-6-фосфата, при этом донором фосфорильной группы выступает АТФ[8]:

| Фермент | Кофактор | Изменение свободной энергии (ΔG′о, кДж/моль) |
| Гексокиназа | Mg2+ | −16,7 |
Эта реакция катализируется ферментом гексокиназой (в клеточных условиях гексокиназа неспособна осуществлять обратную реакцию). Он относится к группе киназ — ферментов, катализирующих перенос терминальной фосфорильной группы с АТФ на акцептор — нуклеофил. В случае гексокиназы акцептором является гексоза, как правило, D-глюкоза, хотя в некоторых тканях гексокиназа также может катализировать фосфорилирование и других распространённых гексоз, например, D-фруктозы и D-маннозы[8] (подробнее см. ниже).

Как и многим другим киназам, гексокиназе для активности необходимо присутствие ионов Mg2+, поскольку собственно субстратом для этого фермента является не АТФ4-, а комплекс MgАТФ2-. Ион магния «закрывает собой» часть отрицательного заряда фосфатных групп АТФ, делая терминальный атом фосфора более доступным для нуклеофильной атаки гидроксильной группой глюкозы. При связывании с глюкозой гексокиназа значительно изменяет конфигурацию, два её домена при связывании с АТФ сближаются друг с другом на 8 Å. Такое сближение подводит связанный с ферментом АТФ ближе к молекуле глюкозы, также с ним связанной, а также блокирует вход в активный центр воды из раствора, которая в противном случае гидролизовала бы фосфоангидридные связи в молекуле АТФ. Как и другие 9 ферментов гликолиза, гексокиназа является растворимым цитозольным белком[8].
Человеческий геном кодирует 4 различные гексокиназы (I—IV), которые катализируют одну и ту же реакцию (два и более фермента, катализирующие одну и ту же реакцию, но кодируемые разными генами, называются изоферментами). Гексокиназа IV, также называемая глюкокиназой, присутствует в гепатоцитах и отличается от других гексокиназ некоторыми кинетическими и регуляторными свойствами и играет важную физиологическую роль[8].
Стадия 2: изомеризация глюкозо-6-фосфата
[править | править код]Фермент фосфогексозоизомераза, или фосфоглюкозоизомераза катализирует обратимую изомеризацию глюкозо-6-фосфата (альдозы) во фруктозо-6-фосфат (кетозу)[8]:

| Фермент | Кофактор | Изменение свободной энергии (ΔG′о, кДж/моль) |
| Фосфогексозоизомераза, или глюкозоизомераза |
Mg2+ | 1,7 |
Механизм этой реакции включает в себя образование промежуточного енодиольного соединения. Эта реакция одинаково хорошо идёт в обоих направлениях, как и можно было предположить из её небольшого ΔG′о. Эта изомеризация играет ключевую роль для всех последующих превращений гликолиза, поскольку перестройка карбонильной и гидроксильной групп при С-1 и С-2 необходима для следующих двух стадий. Для фосфорилирования, происходящего в следующей стадии, необходимо, чтобы при С-1 карбонильная группа была перестроена в гидроксильную, а для четвёртой стадии — разрыва связи между С-3 и С-4 — необходимо наличие карбонильной группы при С-2[8].
Стадия 3: фосфорилирование фруктозо-6-фосфата
[править | править код]В третьей реакции гликолиза, протекающей с затратой АТФ, фермент фосфофруктокиназа-1 катализирует перенос фосфорильной группы от АТФ на фруктозо-6-фосфат с образованием фруктозо-1,6-бисфосфата[8]:

| Фермент | Кофактор | Изменение свободной энергии (ΔG′о, кДж/моль) |
| Фосфофруктокиназа-1 | Mg2+ | −14,2 |
В клеточных условиях фосфофруктокиназа не может осуществлять эту реакцию в обратном направлении, и эта реакция является первой реакцией, продукт которой (фруктозо-1,6-бисфосфат) участвует только в дальнейших реакциях гликолиза, потому что глюкозо-6-фосфат и фруктозо-6-фосфат могут участвовать и в других[каких?] процессах[9].
У некоторых, как правило анаэробных, бактерий и протистов фосфофруктокиназа в качестве донора фосфорильной группы для образования фруктозо-1,6-бисфосфата использует пирофосфорную кислоту (PPi), а не АТФ:
- Фруктозо-6-фосфат + PPi → фруктозо-1,6-бисфосфат + Pi, ΔG′о = −2,9 кДж/моль, реакция идёт в присутствии Mg2+[9].
В растительных клетках имеется как АТФ-зависимая фосфофруктокиназа, так и пирофосфат-зависимая фосфофруктокиназа (реакция, катализируемая последней, обратима)[10]. Пирофосфат-зависимая фосфофруктокиназа локализована в цитозоле и активируется в условиях стресса, при дефиците АТФ (например, при аноксии) и фосфорном голодании[11].
Фосфофруктокиназа-1 регулируется аллостерически. Её активность увеличивается, когда клеточные запасы АТФ истощаются, а продукты распада АТФ (АДФ и АМФ) накапливаются. Напротив, при наличии достаточного количества АТФ и других[каких?] ресурсов её активность подавляется. У некоторых организмов фруктозо-2,6-бисфосфат является потенциальным аллостерическим регулятором фосфофруктокиназы 1. Косвенным образом активность этого фермента увеличивает также рибулозо-5-фосфат[англ.] (промежуточное соединение пентозофосфатного пути, другого пути окисления глюкозы)[9] (подробнее о регуляции ферментов гликолиза см. ниже).
Стадия 4: расщепление фруктозо-1,6-бисфосфата
[править | править код]Фермент фруктозо-1,6-бисфосфатальдолаза, или просто альдолаза, катализирует обратимую альдольную конденсацию. Фруктозо-1,6-бисфосфат расщепляется на два различных триозофосфата: глицеральдегид-3-фосфат (альдозу) и дигидроксиацетонфосфат (кетозу)[9]:

| Фермент | Кофактор | Изменение свободной энергии (ΔG′о, кДж/моль) |
| Альдолаза | 23,8 |
Существуют 2 класса альдолаз. Альдолазы класса I имеются у животных и растений, их работа сопровождается образованием промежуточного основания Шиффа. Альдолазы класса II имеются у грибов и бактерий, при их работе промежуточных оснований Шиффа не образуется. Вместо этого ион цинка в активном сайте фермента связывается с атомом кислорода карбонильной группы при С-2. Ион Zn2+ поляризует карбонильную группу и стабилизирует енольное промежуточное соединение, образующееся при разрыве связи С—С[12].
Хотя реакция, катализируемая альдолазой, имеет положительную ΔG′о в направлении расщепления фруктозо-1,6-бисфосфата, при низких концентрациях реагентов, имеющихся в клетке, реальное изменение свободной энергии мало и альдолазная реакция обратима. В обратном направлении альдолазная реакция идёт при глюконеогенезе[12].
Стадия 5: изомеризация триозофосфатов
[править | править код]Лишь один из двух продуктов альдолазной реакции — глицеральдегид-3-фосфат — может участвовать в дальнейших превращениях гликолиза. Другой продукт — дигидроксиацетонфосфат — быстро и обратимо переводится в глицеральдегид-3-фосфат ферментом триозофосфатизомеразой[англ.][12]:

| Фермент | Кофактор | Изменение свободной энергии (ΔG′о, кДж/моль) |
| Триозофосфатизомераза | 7,5 |
Механизм этой реакции схож с механизмом реакции, катализируемой фосфогексозоизомеразой на стадии 2. Таким образом, обе «половины» глюкозы превращаются в глицеральдегид-3-фосфат[13]. Эта реакция завершает подготовительный этап гликолиза. К его концу молекула глюкозы, фосфорилированная по С-1 и С-6, расщепляется на две молекулы глицеральдегид-3-фосфата[13].
Этап 2: синтез АТФ
[править | править код]Второй этап гликолиза содержит стадии, в которых часть химической энергии молекулы глюкозы запасается в виде АТФ за счёт субстратного фосфорилирования АДФ, а также образования НАДH. Две молекулы глицеральдегид-3-фосфата, образовавшиеся в ходе подготовительного этапа гликолиза, во втором этапе подвергаются одинаковым превращениям. В конечном счёте каждая из них переводится в пируват, при этом образуется 4 молекулы АТФ. Однако суммарный выход АТФ в гликолизе составляет 2 молекулы, так как 2 молекулы АТФ расходуются в подготовительном этапе[13].
Стадия 6: окисление глицеральдегид-3-фосфата
[править | править код]В первой реакции второго этапа гликолиза молекула глицеральдегид-3-фосфата окисляется и фосфорилируется в 1,3-бисфосфоглицерат, эта реакция катализируется глицеральдегид-3-фосфатдегидрогеназой[англ.][13]:

| Фермент | Кофактор | Изменение свободной энергии (ΔG′о, кДж/моль) |
| Глицеральдегид-3-фосфатдегидрогеназа | 6,3 |
Это первая из двух энергозапасающих реакций, продукты которых в дальнейшем участвуют в образовании АТФ. Альдегидная группа глицеральдегид-3-фосфата окисляется, но не до свободной карбоксильной группы, а до ангидрида карбоновой кислоты с фосфорной кислотой. Ангидрид такого типа — ацилфосфат — имеет очень высокую стандартную энергию гидролиза (ΔG′о = −49,3 кДж/моль). Большая часть свободной энергии окисления альдегидной группы глицеральдегид-3-фосфата запасается при образовании ацилфосфатной группы при С-1 1,3-бисфосфоглицерата[14].
В ходе этой реакции глицеральдегид-3-фосфат ковалентно связан с дегидрогеназой. Альдегидная группа глицеральдегид-3-фосфата взаимодействует с группой —SH остатка цистеина в активном центре фермента. Когда глицеральдегид-3-фосфат находится в связанном состоянии, NAD+, также находящийся в активном центре фермента, забирает протон от С-1, в результате чего там образуется кетогруппа. К первому же атому на место связи с атомом серы цистеина присоединяется неорганический фосфат HOPO33-, и протон с фосфата высвобождается во внешнюю среду. Таким образом, после этой реакции образуется 1,3-бисфосфоглицерат и NADH + Н+[14].
Количество NAD+ в клетке (< 10−5 М) гораздо меньше, чем количество глюкозы, расщеплямой за несколько минут. Если NADH, образующийся на этой стадии гликолиза, не будет постоянно расходоваться (то есть окисляться), то гликолиз останавливается[15].
Стадия 7: перенос фосфатной группы с 1,3-бисфосфоглицерата на АДФ
[править | править код]Фермент фосфоглицераткиназа переносит высокоэнергетическую фосфорильную группу с карбоксильной группы 1,3-бисфосфоглицерата на АДФ, в результате чего образуются АТФ и 3-фосфоглицерат[15]:

| Фермент | Кофактор | Изменение свободной энергии (ΔG′о, кДж/моль) |
| Фосфоглицераткиназа | Mg2+ | −18,5 |
Этот фермент получил своё название за обратную реакцию, при которой происходит перенос фосфатной группы с АТФ на 3-фосфоглицерат. Он катализирует оба направления реакции. Реакцию фосфорилирования 3-фосфоглицерата он катализирует при глюконеогенезе и при фотосинтетическом поглощении СО2[16].
Стадии 6 и 7 гликолиза с энергетической точки зрения рассматриваются вместе[кем?] и образуют единый процесс, при котором 1,3-бисфосфоглицерат является промежуточным продуктом. Он образуется при первой из этих реакций (которая сама по себе эндергоническая), а его фосфатная группа переносится на АДФ при второй, строго экзергонической, реакции. Суммарное уравнение процесса, объединяющего стадии 6 и 7, выглядит следующим образом:
- Глицеральдегид-3-фосфат + ADP + Pi + NAD+ ⇌ 3-фосфоглицерат + ATP + NADH + Н+, ΔG′о = −12,2 кДж/моль[16].
Поэтому стадии 6 и 7 вместе составляют экзергонический процесс. Обе эти реакции обратимы при клеточных условиях, и составляемый ими процесс обеспечивает запасание энергии, образовавшейся при окислении альдегидной группы до карбоксильной, в форме АТФ при его образовании из АДФ и фосфорной кислоты. Образование АТФ при переносе фосфорильной группы с субстрата (в данном случае — 1,3-бисфосфоглицерата) на АДФ получило название субстратного фосфорилирования, в отличие от окислительного фосфорилирования, происходящего в дыхательной цепи. При субстратном фосфорилировании участвуют растворимые ферменты и химические промежуточные соединения (в данном случае — 1,3-бисфосфоглицерат), а в окислительном фосфорилировании задействованы мембранно-связанные белки, и АТФ образуется за счёт трансмембранного протонного градиента[16].
Стадия 8: превращение 3-фосфоглицерата в 2-фосфоглицерат
[править | править код]Фермент фосфоглицератмутаза катализирует обратимый перенос фосфорильной группы с С3 на С2 глицерата, приводящий к образованию 2-фосфоглицериновой кислоты. Для этой реакции необходим Mg2+[16]:

| Фермент | Кофактор | Изменение свободной энергии (ΔG′о, кДж/моль) |
| Фосфоглицератмутаза | Mg2+ | 4,4 |
Реакция осуществляется в два этапа. Вначале фосфорильная группа, связанная с остатком гистидина в активном центре фосфоглицератмутазы, замещает собой атом водорода в гидроксильной группе при С2 углероде 3-фосфоглицерата, образуя 2,3-бисфосфоглицерат, который связывается другим гистидиновым остатком. Фосфорильная группа при С3 углероде 2,3-бисфосфоглицерата после этого перемещается на остаток гистидина, с которым был связан фосфат, перенесённый на С2, а её место замещается протоном, связанным со вторым остатком гистидина. Таким образом, к концу такого цикла образуется 2-фосфоглицерат, а фермент фосфорилируется[17].
Стадия 9: дегидратация 2-фосфоглицерата
[править | править код]Во второй реакции гликолиза, в которой образуется соединение с более высоким потенциалом для перенесения фосфата (первой была стадия 6), фермент енолаза катализирует обратимое элиминирование воды (дегидратацию) из молекулы 2-фосфоглицерата, в результате которого образуется фосфоенолпировиноградная кислота (ФЕП)[18]:
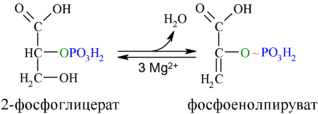
| Фермент | Кофактор | Изменение свободной энергии (ΔG′о, кДж/моль) |
| Енолаза | Mg2+ | 7,5 |
Механизм реакции, катализируемой енолазой, включает стабилизацию промежуточного продукта ионами Mg2+. В ходе этой реакции соединение с относительно низким потенциалом для транспорта фосфата (ΔG′о при гликолизе 2-фосфоглицерата составляет −17,6 кДж/моль) в соединение с высоким потенциалом для транспорта фосфата (ΔG′о при гликолизе ФЕП составляет −61,9 кДж/моль)[18].
Стадия 10: перенос фосфата с ФЕП на АДФ
[править | править код]В последней реакции гликолиза происходит перенос фосфорильной группы с фосфоенолпирувата на АДФ, катализируемый пируваткиназой, для работы которой необходимы ионы К+ и Mg2+ или Mn2+[18]:

| Фермент | Кофактор | Изменение свободной энергии (ΔG′о, кДж/моль) |
| Пируваткиназа | К+, Mg2+/Mn2+ |
−31,4 |
Таким образом, эта реакция представляет собой субстратное фосфорилирование. Её продукт — пируват — вначале образуется в енольной форме, которая затем быстро таутомеризуется в кето-форму, которая преобладает при pH = 7 (то есть в клеточных условиях)[18].
Суммарно эта реакция имеет большое отрицательное изменение свободной энергии из-за спонтанной конверсии енольной формы пирувата в кето-форму. Около половины энергии, выделившейся при гидролизе ФЕП (ΔG′о = −30,5 кДж/моль), запасается при образовании фосфоангидридной связи в АТФ (ΔG′о = −30,5 кДж/моль), а остальная энергия (-31,4 кДж/моль) составляет мощную движущую силу для направления этой реакции в сторону образования АТФ[18].
Энергетика
[править | править код]С энергетической точки зрения в гликолизе можно выделить 2 процесса:
1) Превращение глюкозы в пируват — энергетически выгодный процесс:
- Глюкоза + 2NAD+ → 2 пируват + 2NADH + 2Н+, ΔG′1 = −146 кДж/моль[7];
2) Образование ATP из ADP и 2Pi — энергетически невыгодный процесс:
- 2ADP + 2Pi → 2ATP + 2Н2O, ΔG′2 = 2(30,5 кДж/моль) = 61,0 кДж/моль[7];
Общее изменение энергии Гиббса при гликолизе ΔG′s составляет:
- ΔG′s = ΔG′1 + ΔG′2 = −146 кДж/моль + 61 кДж/моль = −85 кДж/моль[7].
Поэтому при нормальных условиях, а также клеточных условиях (отличных от нормальных) гликолиз является в значительной мере необратимым процессом благодаря значительному уменьшению свободной энергии системы[7].

Из представленной выше диаграммы видно, что только три реакции (1, 3 и 10) протекают с высоким изменением свободной энергии, причём равновесие сильно смещено в сторону образования конечных продуктов, а другие реакции легко обратимы. При глюконеогенезе они могут идти в противоположном направлении, причём их будут катализировать те же ферменты, что и при гликолизе. Для необратимых реакций 1, 3 и 10 в глюконеогенезе используются обходные пути[19].
Гликолиз других углеводов
[править | править код]Многие углеводы, отличные от глюкозы, также разрушаются по пути гликолиза, но после того, как они будут переведены в одно из промежуточных соединений гликолиза[20].
Гликоген и крахмал
[править | править код]
Полимеры глюкозы гликоген, запасаемый в тканях животных, и крахмал, запасаемый растениями, могут быть использованы клеткой для получения энергии при помощи гликогенолиза — фосфоролитической реакции, осуществляемой гликогенфосфорилазой (или крахмалфосфорилазой[англ.] у растений). Эти ферменты катализируют атаку гликозидной связи (α1→4), соединяющей два крайних остатка глюкозы на неветвящемся конце, фосфат-ионом, в результате чего образуется глюкозо-1-фосфат и полимер глюкозы, содержащий на фрагмент глюкозы меньше, чем исходный. Часть энергии гликозидной связи при этом запасается в виде эфирной связи, соединяющей фосфат с глюкозой в глюкозо-1-фосфате. Фосфорилаза продолжает отщеплять по одному остатку глюкозы до тех пор, пока не дойдёт до точки ветвления полисахарида (гликозидной связи (α1→6)), где она останавливается. Глюкозо-1-фосфат переводится в глюкозо-6-фосфат ферментом фосфоглюкомутазой, катализирующим обратимую реакцию:
- Глюкозо-1-фосфат ⇌ глюкозо-6-фосфат.
Механизм действия этого фермента такой же, как у фосфоглицератмутазы. Образующийся в ходе этой реакции глюкозо-6-фосфат может далее быть задействован в гликолизе или пентозофосфатном пути[21].
Описанная выше ситуация характерна лишь для гликогена и крахмала, запасённых внутри клетки. Фосфоролиз гликогена и крахмала, поступающих в организм с пищей, в пищеварительном тракте не имеет никаких преимуществ перед обычным гидролизом: так как клеточные мембраны непроницаемы для фосфатов сахаров, образующийся при фосфоролизе глюкозо-6-фосфат необходимо сначала превратить в обычный сахар[21]. При гидролизе, осуществляемом, например, пищеварительным ферментом α-амилазой, частицей, атакующей гликозидную связь, является вода, а не фосфат-ион[20].
Дисахариды
[править | править код]Дисахариды до их проникновения в клетку предварительно гидролизуются до соответствующих моносахаридов. В пищеварительном тракте такой гидролиз осуществляют ферменты, прикреплённые к поверхности клеток пищеварительного эпителия (в скобках указан фермент, катализирующий соответствующую реакцию):
- Декстрин (полисахарид) + nH2O → n D-глюкоза (декстриназа);
- Мальтоза + H2O → 2 D-глюкоза (мальтаза);
- Лактоза + H2O → D-галактоза + D-глюкоза (лактаза);
- Сахароза + H2O → D-фруктоза + D-глюкоза (сахараза);
- Трегалоза + H2O → 2 D-глюкоза (трегалаза)[21].
Образующиеся моносахариды активно транспортируются в эпителиальные клетки, затем попадают в кровь и разносятся к различных тканям, где фосфорилируются и вовлекаются в гликолиз[21].
Другие моносахариды
[править | править код]Фруктоза
[править | править код]У большинства организмов гексозы, отличные от глюкозы, вовлекаются в гликолиз после преобразования в фосфорилированное производное. Гликолитическое расщепление фруктозы называется фруктолиз[англ.][22]. D-Фруктоза, в свободном виде присутствующая во многих фруктах и образующаяся при гидролизе сахарозы в тонкой кишке у позвоночных, фосфорилируется гексокиназой:
- Фруктоза + ATP → фруктозо-6-фосфат + ADP (реакция идёт в присутствии Mg2+)[23].
Такой путь является основным механизмом вовлечения фруктозы в гликолиз в мышцах и почках. В печени она вовлекается в гликолиз иначе. Фермент печени фруктокиназа катализирует фосфорилирование фруктозы по С-1, а не С-6:
- Фруктоза + ATP → фруктозо-1-фосфат + ADP (реакция идёт в присутствии Mg2+).
Далее фруктозо-1-фосфат расщепляется на глицеральдегид и дигидроксиацетонфосфат ферментом фруктозо-1-фосфатальдолазой. Далее дигидроксиацетонфосфат превращается в глицеральдегид-3-фосфат гликолитическим ферментом триозофосфатизомеразой, а глицеральдегид фосфорилируется ATP и ферментом триозокиназой[англ.] до глицеральдегид-3-фосфата:
- Глицеральдегид + ATP → Глицеральдегид-3-фосфат + ADP (реакция идёт в присутствии Mg2+).
Получившиеся 2 молекулы глицеральдегид-3-фосфата вовлекаются в гликолиз[23]. Ниже представлена схема вышеописанных процессов:

Галактоза
[править | править код]D-Галактоза, продукт гидролиза лактозы, из кишечника всасывается в кровь, откуда попадает в печень, где фосфорилируется галактокиназой по С-1 с затратой АТФ:
- Галактоза + ATP → галактозо-1-фосфат + ADP (реакция идёт в присутствии Mg2+).
Галактозо-1-фосфат далее эпимеризуется по С-4 в глюкозо-1-фосфат в серии реакций, в которых уридиндифосфат[англ.] (UDP) функционирует как коферментоподобный переносчик гексоз. Эпимеризация включает сначала окисление гидроксильной группы при С-4 до кетогруппы, а затем обратное восстановление кетогруппы до гидроксильной с обращённой конфигурацией. В этих двух реакциях окисления и восстановления кофактором выступает NAD[23]. Ниже представлена схема описанного процесса:

Манноза
[править | править код]
D-Манноза, образующаяся при пищеварительном расщеплении многих полисахаридов и гликопротеинов, может быть фосфорилирована по С-6 гексокиназой:
- Манноза + ATP → маннозо-6-фосфат + ADP (реакция идёт в присутствии Mg2+).
Маннозо-6-фосфат далее изомеризуется ферментом фосфоманнозоизомеразой[англ.] до фруктозо-6-фосфата — промежуточного соединения гликолиза[23].
Регуляция
[править | править код]Регуляция гликолиза обычно осуществляется совместно с регуляцией обратного процесса — глюконеогенеза. У млекопитающих глюконеогенез протекает в основном в печени, где его функция заключается в синтезе глюкозы для перенесения к другим тканям в ситуациях, когда запасы гликогена истощены и с пищей в организм не поступает достаточного количества глюкозы. Как упоминалось выше, благодаря обратимости семи из десяти реакций гликолиза в ходе глюконеогенеза эти реакции протекают в обратном направлении и при катализе теми же ферментами, а для необратимых реакций (1, 3 и 10) используются обходные пути. Эти обходные реакции также необратимы. Так, при глюконеогенезе пируват переходит в фосфоенолпируват через промежуточную стадию образования оксалоацетата при катализе пируваткарбоксилазой[англ.], превращающей пируват в оксалоацетат, и фосфоенолпируваткарбоксиназой[англ.], переводящей оксалоацетат в фосфоенолпируват (обходной путь для десятой стадии). Обходная реакция для третьей стадии — превращение фруктозо-1,6-бисфосфата во фруктозо-6-фосфат ферментом фруктозо-1,6-бисфосфатазой, а для первой стадии — превращение глюкозо-6-фосфата в глюкозу глюкозо-6-фосфатазой[24].
Регуляция гексокиназы
[править | править код]
Гексокиназа, катализирующая фосфорилирование глюкозы на стадии 1, в организме человека представлена четырьмя изоформами (I—IV). Они кодируются разными генами[какими?], но катализируют одну и ту же реакцию. В миоцитах преобладает гексокиназа II, имеющая высокое сродство к глюкозе, — её полунасыщение наступает при 0,1 мМ глюкозы. Поскольку в миоцит глюкоза попадает из крови, где концентрация глюкозы составляет 4—5 мМ, то внутри клетки поддерживается концентрация глюкозы, достаточная для насыщения гексокиназы II, и этот фермент работает в полную силу. Мышечные гексокиназы I и II аллостерически ингибируются их продуктом, глюкозо-6-фосфатом, так что при повышении внутриклеточной концентрации глюкозо-6-фосфата выше нормального уровня происходит временное обратимое подавление активности этих ферментов. Таким образом скорость образования глюкозо-6-фосфата находится в балансе со скоростью его расщепления[25].
Изоформы гексокиназы играют различные роли в углеводном метаболизме печени и мышц: в мышцах глюкоза потребляется для получения энергии, а печень поддерживает концентрацию глюкозы в крови, потребляя глюкозу или образуя её путём глюконеогенеза в зависимости от концентрации. В печени преобладает гексокиназа IV (глюкокиназа), которая отличается от мышечных гексокиназ I—III в трёх важных аспектах. Во-первых, концентрация глюкозы, при которой происходит полунасыщение гексокиназы IV, составляет около 10 мМ, что выше обычной концентрации глюкозы в крови. Быстрое выравнивание концентраций глюкозы в цитозоле гепатоцитов и крови обеспечивает наличие в мембранах гепатоцитов белков-транспортёров глюкозы — GLUT2. Когда уровень глюкозы в крови повышен, например, после потребления пищи, богатой углеводами, излишек глюкозы переносится в гепатоциты, где гексокиназа IV превращает её в глюкозо-6-фосфат. Так как гексокиназа IV не насыщена при 10 мМ глюкозы, её активность продолжает расти при повышении концентрации глюкозы до 10 мМ и более. При низкой концентрации глюкозы в крови её концентрации в гепатоцитах недостаточно для работы гексокиназы IV, и глюкоза, образовавшаяся в ходе глюконеогенеза, покидает клетку и не фосфорилируется. Во-вторых, гексокиназа IV не подавляется глюкозо-6-фосфатом и поэтому может продолжать работать даже тогда, когда накопление глюкозо-6-фосфата полностью подавляет гексокиназы I—III. Наконец, в-третьих, гексокиназа IV подавляется при обратимом связывании с ней регуляторного белка[какого?], имеющегося только в печени. Этот белок наиболее эффективно связывается с гексокиназой IV в присутствии аллостерического регулятора — фруктозо-6-фосфата. Однако за связывание фруктозо-6-фосфата с этим белком конкурирует глюкоза, которая при связывании с ним вызывает диссоциацию комплекса этого белка и фермента и ослабляет подавление его активности. Сразу после приёма насыщенной углеводами пищи, когда уровень глюкозы в крови высок, глюкоза входит в гепатоциты с помощью GLUT2 и активирует гексокиназу IV по вышеописанному механизму. При голодании, когда уровень глюкозы в крови становится ниже 5 мМ, фруктозо-6-фосфат активирует подавление гексокиназы IV с помощью этого регуляторного белка, в результате чего печень не конкурирует с другими органами за потребление глюкозы. Этот механизм ингибирования при помощи регуляторного белка интересен ещё и тем, что этот белок фиксирует гексокиназу IV внутри ядра клетки, так что она оказывается отделённой от других ферментов гликолиза, локализованных в цитозоле. При повышении концентрации глюкозы в цитозоле она выравнивается с концентрацией глюкозы в ядре путём транспорта через ядерные поры. Глюкоза вызывает диссоциацию регуляторного белка, гексокиназа IV выходит в цитозоль и начинает фосфорилировать глюкозу[26].
Гексокиназа IV и глюкозо-6-фосфатаза также регулируются на уровне транскрипции (подробнее о транскрипционной регуляции см. ниже)[27].
Регуляция фосфофруктокиназы-1
[править | править код]
Как уже отмечалось, глюкозо-6-фосфат может вовлекаться как в гликолиз, так и в другие процессы, в том числе в синтез гликогена и пентозофосфатный путь. Метаболически необратимая реакция, катализируемая фосфофруктокиназой-1 (PFK-1) является этапом, строго закрепляющим участие данной молекулы глюкозы только в гликолизе. Кроме субстрат-связывающих сайтов, этот сложно устроенный фермент имеет несколько регуляторных сайтов, с которыми связываются аллостерические активаторы или ингибиторы[27].
ATP является не только субстратом для PFK-1, но и конечным продуктом гликолиза. Когда высокий уровень ATP в клетке сигнализирует о том, что образование ATP превосходит его потребление, ATP связывается с PFK-1 в особом аллостерическом сайте и снижает сродство этого фермента к субстрату — фруктозо-6-фосфату. АДФ и АМФ, концентрация которых возрастает, когда потребление ATP опережает его образование, аллостерически связываются с PFK-1 и уменьшают ингибиторное действие связанного с этим ферментом ATP. Эти механизмы способствуют увеличению активности фермента при накоплении ADP или AMP и понижению — при накоплении ATP[28].
Цитрат, ключевое промежуточное соединение при аэробном окислении пирувата, жирных кислот и аминокислот, также является аллостерическим регулятором PFK-1. Высокая концентрация цитрата увеличивает ингибиторный эффект ATP, дополнительно уменьшая расщепление глюкозы в ходе гликолиза. В этом случае, как и в некоторых других, описанных ниже, цитрат выступает в роли внутриклеточного сигнала, свидетельствующего об удовлетворении клеткой своих энергетических потребностей при окислении жиров и белков[28].
Реакции, катализируемой PFK-1, в гликолизе соответствует реакция глюконеогенеза, при которой фруктозо-1,6-бисфосфат переводится во фруктозо-6-фосфат. Эта реакция катализируется ферментом фруктозобисфосфатазой-1 (FBPаза-1). FBPаза-1 строго подавляется аллостерическим связыванием АМФ, так что когда клеточные запасы АТФ невелики, а уровень АМФ высок, АТФ-зависимый синтез глюкозы приостанавливается[28].
Таким образом, противоположные этапы гликолиза и глюконеогенеза, катализируемые PFK-1 и FBPазой-1 соответственно, регулируются координированно и реципрокно (то есть обратно). Вообще, при достаточных концентрациях ацетил-CoA или цитрата (продукт конценсации ацетил-CoA с оксалоацетатом в цикле Кребса) или когда большая доля клеточного аденилата находится в форме ATP, предпочтительным процессом является глюконеогенез. При повышении уровня AMP стимулируется гликолиз путём стимулирования PFK-1[29].
Фруктозо-2,6-бисфосфат как регулятор
[править | править код]Особая роль печени в поддержании постоянного уровня глюкозы в крови требует дополнительных регуляторных механизмов, координирующих образование и потребление глюкозы. Когда уровень глюкозы в крови понижается, гормон глюкагон сигнализирует печени, чтобы она образовывала и выделяла в кровь больше глюкозы и приостановила использование глюкозы для собственных нужд. Одним из источников глюкозы является гликоген, запасённый в печени. Другим источником является глюконеогенез, использующий в качестве исходных реагентов пируват, лактат, глицерол и некоторые аминокислоты. Когда уровень глюкозы в крови высок, другой гормон, инсулин, сигнализирует печени, чтобы она использовала глюкозу как «топливо» и предшественник для синтеза и запасания гликогена и триацилглицерола[30].
Быстрая гормональная регуляция гликолиза и глюконеогенеза опосредована фруктозо-2,6-бисфосфатом — аллостерическим регулятором ферментов PFK-1 и FBPазы-1. Когда фруктозо-2,6-бисфосфат связывается с особым аллостерическим сайтом на PFK-1, он увеличивает сродство фермента к его субстрату — фруктозо-6-фосфату и уменьшает его сродство к аллостерическим ингибиторам — ATP и цитрату. При физиологических концентрациях субстратов PFK-1 — АТФ и фруктозо-6-фосфата, а также других положительных или отрицательных эффекторов этого фермента (ADP, AMP, цитрат) PFK-1 находится в инактивированной форме в отсутствие фруктозо-2,6-бисфосфата. На FBPазу-1 фруктозо-2,6-бисфосфат имеет противоположный эффект: он снижает его сродство к субстратам и тем самым замедляет глюконеогенез[31].

Клеточная концентрация аллостерического регулятора фруктозо-2,6-бисфосфата складывается из относительных скоростей его образования и разрушения. Он образуется при фосфорилировании фруктозо-6-фосфата ферментом фосфофруктокиназой-2 (PFK-2), а разрушается фруктозо-2,6-бисфосфатазой (FBPазой-2). PFK-2 и FBPаза-2 представляют собой две различные ферментные активности одного и того же бифункционального белка. Баланс этих активностей в печени, определяющих клеточный уровень фруктозо-2,6-бисфосфата, регулируется глюкагоном и инсулином[32].
Глюкагон стимулирует аденилатциклазу печени к синтезу 3',5'-cAMP из ATP. cAMP далее активирует cAMP-зависимую протеинкиназу, которая переносит фосфорильную группу с ATP на бифункциональный белок PFK-2/FBPазу-2. Фосфорилирование этого белка усиливает активность FBPазы-2 и подавляет активность PFK-2. Поэтому глюкагон снижает уровень фруктозо-2,6-бисфосфата в клетке, тем самым подавляя гликолиз и стимулируя глюконеогенез. Этим обусловлен эффект глюкагона на повышение уровня глюкозы в крови. Инсулин имеет противоположный эффект, так как он стимулирует активность фосфопротеинфосфатазы, катализирующей перенос фосфорильной группы с PFK-2/FBPазы-2, что активирует PFK-2, в результате чего уровень фруктозо-2,6-бисфосфата увеличивается, стимулируется гликолиз и подавляется глюконеогенез[32].
Ксилулозо-5-фосфат как регулятор
[править | править код]
Действие другого регуляторного механизма также основано на регуляции уровня фруктозо-2,6-бисфосфата. В печени млекопитающих ксилулозо-5-фосфат, продукт пентозофосфатного пути, также задействован в увеличении темпов гликолиза после потребления богатой углеводами пищи. Уровень ксилулозо-5-фосфата в клетке увеличивается, когда глюкоза, поступающая в печень, превращается в глюкозо-6-фосфат и далее участвует как в гликолизе, так и пентозофосфатном пути. Ксилулозо-5-фосфат активирует фосфопротеинфосфатазу 2А (PP2A), который дефосфорилирует бифункциональный фермент PFK-2/FBPазу-2. Дефосфорилирование активирует PFK-2 и подавляет FBPазу-2, из-за чего повышается концентрация фруктозо-2,6-бисфосфата, что стимулирует гликолиз и подавляет глюконеогенез. Увеличение темпов гликолиза запускает образование ацетил-CoA, а увеличение темпов пентозофосфатного пути приводит к образованию NADPH. Ацетил-CoA и NADPH служат стартовыми реагентами для синтеза жирных кислот, так что при потреблении богатой углеводами пищи идёт интенсивный синтез жирных кислот. Ксилулозо-5-фосфат также увеличивает образование всех ферментов, необходимых для синтеза жирных кислот[32].
Регуляция пируваткиназы
[править | править код]
У позвоночных имеется по меньшей мере 3 изозима пируваткиназы, которые различаются местонахождением в тканях и ответом на воздействия модуляторов. Высокая концентрация ATP, ацетил-CoA, длинных жирных кислот (признаки достаточной энергетической обеспеченности) аллостерически подавляют все изозимы пируваткиназы. Пируваткиназа печени (L-форма), но не мышц (M-форма), также регулируется фосфорилированием. Когда низкий уровень глюкозы в крови приводит к выбросу глюкагона, cAMP-зависимая протеинкиназа фосфорилирует L-изозим пируваткиназы, инактивируя его. Это замедляет использование глюкозы в печени как источника энергии и направляет её на экспорт в мозг и другие органы. В мышцах эффект повышения концентрации cAMP строго противоположный. В ответ на воздействие адреналина cAMP активирует распад гликогена и гликолиз[33].
Транскрипционный контроль
[править | править код]Большая часть вышеописанных регуляторных путей опосредована быстрыми, легко обратимыми процессами: аллостерическим эффектом, фосфорилированием фермента или связыванием с регуляторным белком. Однако существуют и механизмы регуляции, основанные на изменении количества молекул фермента в клетке за счёт изменений в балансе синтеза и разрушения фермента. Эти механизмы регулируются на уровне транскрипции соответствующего фермента[34].
Под влиянием инсулина находится транскрипция более чем 150 человеческих генов. В их числе гены, участвующие в гликолизе и его регуляции, а именно кодирующие гексокиназы II и IV, PFK-1, пируваткиназу, PFK-2/FBPазу-2[34].
Одним из транскрипционных факторов, важных для метаболизма углеводов, является ChREBP (англ. carbohydrate response element binding protein), экспрессируемый, главным образом, в печени, жировой ткани и почках. Он служит для координирования синтеза ферментов, необходимых для синтеза углеводов и жиров. В неактивной форме ChREBP фосфорилирован двумя фосфатами по и находится в цитозоле, будучи неспособным пройти в ядро. Когда фосфопротеинфосфатаза РР2А удаляет с него один фосфат, ChREBP проникает в ядро, где РР2А убирает с него второй фосфат. Активированный таким образом ChREBP связывается с белком-партнёром, Mlx[англ.]. Комплекс ChREBP-Mlx теперь связывается с элементом ChoRE (англ. carbohydrate response element) на ДНК в области его промотора и стимулирует его транскрипцию. РР2А аллостерически активируется ксилулозо-5-фосфатом. С помощью ChREBP регулируется синтез таких ферментов, как пируваткиназа, синтаза жирных кислот и ацетил-CoA-карбоксилаза[англ.]. Другой транскрипционный фактор, функционирующий в печени — SREBP-1c[англ.] — регулирует образование пируваткиназы, гексокиназы IV, липопротеинлипазы, ацетил-CoA-карбоксилазы и синтазы жирных кислот. Синтез SREBP-1c стимулируется инсулином и подавляется глюкагоном[35].
Модификации
[править | править код]В гликолизе может протекать дополнительная реакция, превращающая 1,3-бисфосфоглицерат в 2,3-бисфосфоглицерат; эта реакция катализируется ферментом бисфосфоглицератмутазой. 2,3-Бисфосфоглицерат может возвращаться в гликолиз под воздействием фермента 2,3-бисфосфоглицератфосфатазы, которая превращает его в 3-фосфоглицерат. В большинстве тканей количество 2,3-бисфосфоглицерата невелико, но в эритроцитах его содержание значительно, поскольку там он функционирует как аллостерический регулятор гемоглобина. Он связывается с гемоглобином и понижает его сродство к кислороду, способствуя диссоциации последнего и его переходу в ткани[36].

Некоторые модификации гликолиза обнаружены у бактерий. В частности, когда окисление глицеральдегид-3-фосфата на стадии 6 глицеральдегид-3-фосфатдегидрогеназой ограничено низким содержанием фосфата в среде, у E. coli и некоторых других бактерий дигидроксиацетонфосфат окисляется до пирувата через три реакции, составляющие метилглиоксалевый шунт. В реакции 1 лиаза отщепляет фосфат с образованием метилглиоксаля. В реакции 2 метилглиоксаль присоединяет воду, превращаясь в лактат, вод воздействием глиоксилазы[англ.]. В реакции 3 лактат окисляется мембраносвязанной флавин-содержащей D-лактатооксидазой до пирувата. Если содержание фосфата в среде высоко, то метилглиоксалевый шунт не функционирует, так как лиаза ингибируется фосфатом[37].
Наконец, у анаэробных бактерий существуют дополнительные пути разложения углеводов. В частности, бактерии, предпочитающие пентозы в качестве субстрата, превращают пентозы и гексозы в ксилулозо-5-фосфат, который далее расщепляется фосфокетолазой[англ.][37].
Кроме того, у некоторых термофильных архей имеются только 2 из гликолитических ферментов — енолаза и пируваткиназа[38].
Распространение и физиологическое значение
[править | править код]Гликолиз является универсальным, хотя и не единственным, путём катаболизма глюкозы и активно используется как про-, так и эукариотическими организмами[1]. Все десять ферментов гликолиза водорастворимы и находятся в цитозоле. Некоторые ткани и клетки животных способны катаболизировать глюкозу исключительно с помощью гликолиза (например, нейроны мозга или клетки почечных канальцев). В печени и жировой ткани физиологическая роль гликолиза несколько отличается от таковой в других тканях. Во время пищеварения в печени и жировой ткани гликолиз функционирует в основном как источник субстратов для синтеза жиров[39]. Некоторые ткани растений специальным образом модифицированы для запасания крахмала (например, в клубне картофеля), а некоторые водные растения (например, жеруха) получают большую часть энергии именно через гликолиз[40].
Как отмечалось выше, в аэробных условиях пируват после гликолиза образует ацетил-CoA и вовлекается в цикл Кребса. Две молекулы НАДH, образующиеся при гликолизе в цитозоле, в этих условиях вновь окисляются до НАД+, отдавая свои электроны в электроно-транспортную цепь (ЭТЦ), которая у эукариот находится в митохондриях. По ЭТЦ эти электроны переходят от одного переносчика к другому, пока не дойдут до конечного акцептора электронов — кислорода:
- 2НАДH + 2Н+ + O2 → 2НАД+ + 2Н2O.
Перенос электронов от НАДH к O2 в митохондриях обеспечивает энергию для синтеза АТФ путём окислительного фосфорилирования[18].
В анаэробных условиях пируват подвергается дальнейшим превращениям, обеспечивая регенерацию НАД+ и других предшественников биосинтеза (брожение). При этом образуются продукты брожения, такие, как, например, лактат или этанол. В этих условиях гликолиз является единственным способом получения энергии для синтеза ATP из ADP и Pi[19]. У некоторых анаэробов, как и у аэробов, функционирует ЭТЦ, однако конечным акцептором электронов служит не кислород, а отличное от него окисленное органическое или неорганическое вещество[41].
Также на анаэробный тип метаболизма переходят некоторые органы и ткани в условиях гипоксии (нехватки кислорода), например, скелетные мышцы при активной работе. В анаэробных условиях в них пируват преобразуется в лактат, который транспортируется в другие ткани (например, печень, сердечную мышцу) и там вновь превращается в пируват (цикл Кори)[42]. Помимо этого, анаэробный распад глюкозы имеет место в эритроцитах, так как в них отсутствуют митохондрии[42].

Особое физиологическое значение гликолиз имеет в адипоцитах, где он поставляет метаболиты для липогенеза и направляет жирные кислоты вместо ненужного окисления на синтез триглицеридов, тем самым снижая окислительный стресс. В нейронах гипоталамуса гликолиз является важным регуляторным звеном контроля пищевого поведения[англ.][43].
Медицинское значение
[править | править код]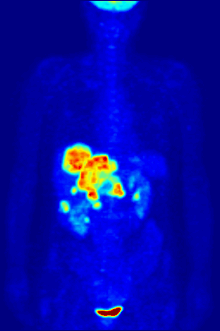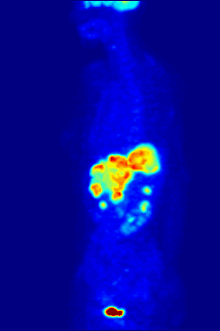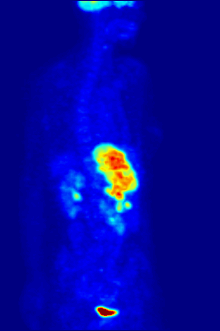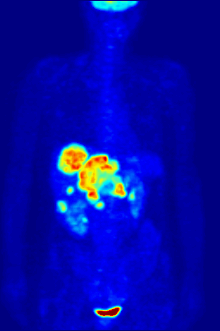
При накоплении лактата, образующегося при анаэробных условиях, в крови (например, при интенсивной и длительной работе) развивается лактатацидоз — обусловленное накоплением лактата понижение pH крови, что вызывает резкие нарушения в клеточном метаболизме. Так происходит при некоторых патологических состояниях, когда нарушается снабжение тканей кислородом: инфаркт миокарда, лёгочная эмболия, кровотечение[44]. Лактатацидоз может быть обусловлен сахарным диабетом, когда аэробный гликолиз сменяется анаэробным[45]. Поскольку инсулин ускоряет гликолиз, при диабете I типа (когда вырабатывается слишком малое количество инсулина) происходит замедление гликолиза[46]. По этой причине препараты, стимулирующие гликолитические ферменты и ферменты, осуществляющие регуляцию гликолиза, могут стать важным средством лечения диабета[43].
При комбинированной малоновой и метилмалоновой ацидурии (СМАММА), обусловленной дефицитом ACSF3, гликолиз снижен на 50 %, что вызвано уменьшением липоилирования митохондриальных ферментов, таких как пируватдегидрогеназный комплекс и α-кетоглутаратдегидрогеназный комплекс[47].
При многих типах рака у животных и человека в опухолевых клетках потребление глюкозы и гликолиз ускоряются почти в 10 раз по сравнению с нормальной клеткой. Дело в том, что большинство опухолевых клеток живут в условиях гипоксии, так как на первых порах нет капиллярной сети, которая в необходимой мере снабжала бы их кислородом. По этой причине в энергетическом плане опухолевые клетки становятся целиком зависимыми от гликолиза, который энергетически гораздо менее эффективен, чем полное окисление глюкозы до углекислого газа и воды, и опухолевой клетке приходится потреблять гораздо больше глюкозы, чем нормальной. По-видимому, на ранних этапах трансформации нормальной клетки в опухолевую происходит переход на исключительно гликолитическое энергообеспечение и развивается устойчивость к низкому рН внеклеточной среды (снижение рН обусловлено накоплением лактата)[48].
Увеличение темпов гликолиза у опухолевых клеток достигается увеличением синтеза гликолитических ферментов и инсулиннезависимых мембранных переносчиков глюкозы (GLUT1 и GLUT3). Индуцируемый гипоксией транскрипционный фактор (HIF-1) на уровне мРНК усиливает образование по крайней мере восьми ферментов гликолиза, а также переносчиков глюкозы в условиях нехватки кислорода. Он также увеличивает образование пептидного гормона VEGF (фактор роста эндотелия сосудов), который стимулирует разрастание капиллярной сети навстречу опухоли[48].
Большая, по сравнению с нормальными тканями, зависимость опухолей от гликолиза даёт возможности для разработки противораковой терапии: ингибиторы гликолиза поражали и убивали бы опухолевые клетки, снижая их обеспечение АТР. В качестве химиотерапевтических агентов в будущем могут применяться три ингибитора гексокиназы: 2-дезоксиглюкоза[англ.], лонидамин и 3-бромпируват[англ.]. Препятствуя образованию глюкозо-6-фосфата, они блокируют не только гликолиз, но и пентозофосфатный путь, который также начинается с этого соединения. Без пентозофосфатов, образующихся в этом пути, клетка не может синтезировать ДНК- и РНК-нуклеотиды, а значит, расти и делиться. Другим препаратом, уже применяющимся на практике, стал иматиниб — блокатор тирозинкиназы, который предотвращает повышение образования гексокиназы, активируемое этой киназой[49].
Высокая скорость гликолиза в опухолевых клетках также имеет значение для диагностики раковых заболеваний. Относительная скорость потребления глюкозы тканью в некоторых случаях может помочь установить нахождение опухоли. При позитронно-эмиссионной томографии пациенту вводят безвредную, меченную изотопом фтора глюкозу (фтордезоксиглюкозу), которая превращается гексокиназой в 6-фосфодезоксиглюкозу и далее не подвергается метаболическим превращениям, накапливаясь в клетках. Метка обнаруживается специальными детекторами, располагающимися по всему телу, и таким образом определяется локализация опухоли[50].
Эволюция
[править | править код]Роль гликолиза и в брожении, и в дыхании имеет эволюционные основы. Предполагается, что древние прокариоты использовали гликолиз для получения АТФ задолго до того, как кислород накопился в земной атмосфере. Древнейшие известные ископаемые остатки бактерий имеют возраст 3,5 миллиардов лет, однако значительные количества кислорода в атмосфере стали накапливаться 2,7 миллиардов лет назад. Цианобактерии образовывали О2 как побочный продукт при фотосинтезе. По этой причине, возможно, гликолиз был единственным источником ATP для древних прокариот. Тот факт, что в настоящее время гликолиз является наиболее широко распространённым метаболическим путём на Земле, подтверждает то, что он появился на очень ранних этапах истории жизни. О древности гликолиза свидетельствует и то, что все его ферменты локализованы в цитозоле и для протекания этого пути не требуются особые мембранные органеллы, которые появились приблизительно миллиард лет спустя после возникновения прокариотических клеток. Выше говорилось, что у некоторых термофильных архей из всех 10 гликолитических ферментов имеются только енолаза и пируваткиназа, поэтому может быть, что система ферментов гликолиза развилась из такой двухкомпонентной системы[38]. Таким образом, гликолиз можно рассматривать как метаболическое «наследие» от ранних клеток, который и сейчас используется при брожении и как первый этап разрушения органических соединений при дыхании[3].
История изучения
[править | править код]
Гликолиз стал первым тщательно описанным метаболическим путём, и по сей день, возможно, остаётся наиболее изученным. После открытия спиртового брожения в экстрактах клеток дрожжей в 1897 году Эдуардом Бухнером[51] и описания всего процесса гликолиза у дрожжей (Отто Варбург[52] и Ханс Эйлер-Хельпин) и в мышечной ткани (Густав Эмбден, Отто Мейергоф, Яков Парнас[53], считающиеся первооткрывателями гликолиза; в честь них гликолиз получил своё второе название) конкретный механизм реакций гликолиза находился в центре биохимических исследований. В ходе изучения гликолиза развивались методы выделения ферментов, были открыты коферменты, в частности, NAD, и была установлена их глобальная роль, была установлена важнейшая метаболическая роль ATP и других фосфорилированных соединений[40].

Понимание того, что именно фосфорилированные гексозы являются промежуточными соединениями гликолиза, пришло не сразу и по счастливой случайности. В 1906 году Артур Гарден и Уильям Янг[англ.] проверяли свою гипотезу о том, что ингибиторы протеолитических ферментов могут стабилизировать ферменты, сбраживающие глюкозу. Они добавили сыворотку крови, которая содержит ингибиторы протеолитических ферментов, в экстракт дрожжей и наблюдали ожидаемое ускорение метаболизма глюкозы. Однако в контрольном эксперименте, который должен был показать, что прокипячённая сыворотка не оказывала стимулирующего действия, выяснилось, что прокипячённая сыворотка стимулировала гликолиз. Тщательная проверка компонентов сыворотки показала, что стимулирование было обусловлено наличием в сыворотке неорганического фосфата[54]. В дальнейшем Гарден и Янг установили, что глюкоза, добавленная в экстракт дрожжей, превращалась в гексозобисфосфат («эфир Гардена — Янга», известный как фруктозо-1,6-бисфосфат). Это было началом длинной череды открытий, показавших роль органических эфиров и фосфатных ангидридов в биохимии[7].
См. также
[править | править код]Примечания
[править | править код]- ↑ 1 2 Нетрусов, Котова, 2012, с. 123.
- ↑ 1 2 Nelson, Cox, 2008, p. 528, 530.
- ↑ 1 2 Campbell, 2011, p. 179.
- ↑ 1 2 3 Nelson, Cox, 2008, p. 530.
- ↑ Nelson, Cox, 2008, p. 528—530.
- ↑ Северин, 2011, с. 264.
- ↑ 1 2 3 4 5 6 7 Nelson, Cox, 2008, p. 531.
- ↑ 1 2 3 4 5 6 7 Nelson, Cox, 2008, p. 532.
- ↑ 1 2 3 4 Nelson, Cox, 2008, p. 533.
- ↑ Plants in action / The glycolytic pathway. Дата обращения: 18 апреля 2019. Архивировано из оригинала 20 марта 2018 года.
- ↑ William C. Plaxton. Metabolic flexibility helps plants to survive stress. Дата обращения: 15 августа 2014. Архивировано 25 февраля 2015 года.
- ↑ 1 2 3 Nelson, Cox, 2008, p. 534.
- ↑ 1 2 3 4 Nelson, Cox, 2008, p. 535.
- ↑ 1 2 Nelson, Cox, 2008, p. 535—536.
- ↑ 1 2 Nelson, Cox, 2008, p. 536.
- ↑ 1 2 3 4 Nelson, Cox, 2008, p. 537.
- ↑ Nelson, Cox, 2008, p. 537—538.
- ↑ 1 2 3 4 5 6 Nelson, Cox, 2008, p. 538.
- ↑ 1 2 Кольман, Рём, 2012, с. 152.
- ↑ 1 2 Nelson, Cox, 2008, p. 543.
- ↑ 1 2 3 4 Nelson, Cox, 2008, p. 544.
- ↑ Katz N., Jungermann K. Autoregulatory shift from fructolysis to lactate gluconeogenisis in rat hepatocyte suspensions. The problem of metabolic zonation of liver parenchyma. (нем.) // Hoppe-Seyler's Zeitschrift fur physiologische Chemie. — 1976. — Vol. 357, № 3. — P. 359—375. — PMID 955564.
- ↑ 1 2 3 4 Nelson, Cox, 2008, p. 545.
- ↑ Nelson, Cox, 2008, p. 582—583.
- ↑ Nelson, Cox, 2008, p. 583—584.
- ↑ Nelson, Cox, 2008, p. 584—585.
- ↑ 1 2 Nelson, Cox, 2008, p. 585.
- ↑ 1 2 3 Nelson, Cox, 2008, p. 586.
- ↑ Nelson, Cox, 2008, p. 586—587.
- ↑ Nelson, Cox, 2008, p. 587.
- ↑ Nelson, Cox, 2008, p. 587—588.
- ↑ 1 2 3 Nelson, Cox, 2008, p. 588.
- ↑ Nelson, Cox, 2008, p. 588—589.
- ↑ 1 2 Nelson, Cox, 2008, p. 590.
- ↑ Nelson, Cox, 2008, p. 591—592.
- ↑ Северин, 2011, с. 269—270.
- ↑ 1 2 Современная микробиология / Под ред. Й. Ленгелера, Г. Древса, Г. Шлегеля. — М.: Мир, 2005. — Т. 1. — С. 267. — 654 с.
- ↑ 1 2 Simon Potter, Linda A. Fothergill-Gilmore. Molecular evolution: The origin of glycolysis (англ.) // Biochemical education. — 1993. — Vol. 21, no. 1. — P. 45—48. — doi:10.1016/0307-4412(93)90018-U. Архивировано 5 октября 2015 года.
- ↑ Северин, 2011, с. 270.
- ↑ 1 2 Nelson, Cox, 2008, p. 528.
- ↑ Нетрусов, Котова, 2012, с. 145.
- ↑ 1 2 Северин, 2011, с. 268—267.
- ↑ 1 2 Xin Guo, Honggui Li, Hang Xu, Shihlung Woo, Hui Dong, Fuer Lu, Alex J. Lange, Chaodong Wu. Glycolysis in the control of blood glucose homeostasis. // Acta Pharmaceutica Sinica B. — 2012. — Vol. 2, № 4. — P. 358—367. — doi:10.1016/j.apsb.2012.06.002. Архивировано 24 сентября 2015 года.
- ↑ Северин, 2011, с. 269.
- ↑ Pogatsa G. Metabolic energy metabolism in diabetes: therapeutic implications. (англ.) // Coronary artery disease. — 2001. — Vol. 12 Suppl 1. — P. 29—33. — PMID 11286305.
- ↑ Diabetes - Errors of Metabolism. Дата обращения: 4 сентября 2014. Архивировано 9 июля 2010 года.
- ↑ Zeinab Wehbe, Sidney Behringer, Khaled Alatibi, David Watkins, David Rosenblatt, Ute Spiekerkoetter, Sara Tucci. The emerging role of the mitochondrial fatty-acid synthase (mtFASII) in the regulation of energy metabolism // Biochimica et Biophysica Acta (BBA) - Molecular and Cell Biology of Lipids. — 2019-11-01. — Т. 1864, вып. 11. — С. 1629–1643. — ISSN 1388-1981. — doi:10.1016/j.bbalip.2019.07.012.
- ↑ 1 2 Nelson, Cox, 2008, p. 540.
- ↑ Nelson, Cox, 2008, p. 540—541.
- ↑ Nelson, Cox, 2008, p. 541.
- ↑ Eduard Buchner. Alkoholische Gärung ohne Hefezellen (Vorläufige Mitteilung) (нем.) // Berichte der Deutschen Chemischen Gesellschaft[англ.] : magazin. — 1897. — Bd. 30. — S. 117—124. — doi:10.1002/cber.18970300121. Архивировано 29 августа 2009 года.
- ↑ Otto Warburg. Über die Rolle des Eisens in der Atmung des Seeigeleis nebst Bemerkungen über einige durch Eisen beschleunigte Oxydationen. // Über die Katalytischen Wirkungen der Lebendigen Substanz. — 1928. — P. 47—66.
- ↑ Парнас Яков Оскарович — статья из Большой советской энциклопедии.
- ↑ Arthur Harden, William John Young. The Alcoholic Ferment of Yeast-Juice. Part III.-The Function of Phosphates in the Fermentation of Glucose by Yeast-Juice. // Proceedings of the Royal Society of London. Series B, Containing Papers of a Biological Character. — 1908. — Vol. 80, № 540. — P. 299—311. — doi:10.1098/rspb.1908.0029. Архивировано 27 октября 2019 года.
Литература
[править | править код]- David E. Metzler. Biochemistry: The Chemical Reactions of Living Cells.. — 2nd edition. — Academic Press, 2003. — Т. 2. — 1973 с. — ISBN 978-0-1249-2541-0.
- David L. Nelson, Michael M. Cox. Lehninger Principles of biochemistry. — Fifth edition. — New York: W. H. Freeman and company, 2008. — 1158 p. — ISBN 978-0-7167-7108-1.
- Campbell N. A., Reece J. B., Urry L. A. e. a. Biology. 9th ed. — Benjamin Cummings, 2011. — 1263 p. — ISBN 978-0-321-55823-7.
- Кольман Я., Рём К.—Г. Наглядная биохимия. — 4-е изд.. — М.: БИНОМ. Лаборатория знаний, 2012. — 469 с. — ISBN 978-5-9963-0620-6.
- Биологическая химия с упражнениями и задачами / Под ред. С. Е. Северина. — М.: Издательская группа «ГЭОТАР-Медиа», 2011. — 624 с.
- Нетрусов А. И., Котова И. Б. Микробиология. — 4-е изд., перераб. и доп.. — М.: Издательский центр «Академия», 2012. — 384 с. — ISBN 978-5-7695-7979-0.
Ссылки
[править | править код]- Гликолиз (англ.)