Селенат натрия (Vylyugm ugmjnx)
Перейти к навигации
Перейти к поиску
| Селенат натрия | |
|---|---|
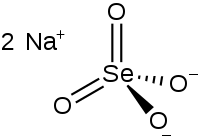 | |
| Общие | |
| Систематическое наименование |
Селенат натрия |
| Хим. формула | Na2SeO4 |
| Рац. формула | Na2SeO4 |
| Физические свойства | |
| Состояние | бесцветные кристаллы |
| Молярная масса | 188,94 г/моль |
| Плотность | 3,098; 3,21 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | под давл. 730 °C |
| Энтальпия | |
| • образования | -1067 кДж/моль |
| Химические свойства | |
| Растворимость | |
| • в воде | 13,20; 57,225; 74,875; |
| Классификация | |
| Рег. номер CAS | 13410-01-0 |
| PubChem | 25960 |
| Рег. номер EINECS | 236-501-8 |
| SMILES | |
| InChI | |
| ChEBI | 77775 |
| ChemSpider | 24185 |
| Безопасность | |
| ЛД50 | 1,6-14,2 мг/кг |
| Токсичность | Чрезвычайно ядовит |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Селена́т на́трия — неорганическое соединение, соль щелочного металла натрия и селеновой кислоты с формулой Na2SeO4, бесцветные кристаллы, растворимые в воде, образует кристаллогидрат. Весьма токсичен.
Получение
[править | править код]- Растворение селена в щелочном концентрированном растворе перекиси водорода:
- Окисление селенита натрия перекисью водорода, кислородом или электролизом:
- Реакция селеновой кислоты с гидроокисью или карбонатом натрия:
Физические свойства
[править | править код]Селенат натрия образует бесцветные кристаллы, хорошо растворимые в воде.
Образует кристаллогидрат состава Na2SeO4•10H2O.
Химические свойства
[править | править код]- При сильном нагревании разлагается:
- Безводную соль получают сушкой кристаллогидрата в вакууме:
- С селеновой кислотой образует кислую соль:
- Является сильным окислителем:
- Восстанавливается водородом:
- Вступает в обменные реакции:
- Реагирует с триоксидом серы:
Биологические свойства
[править | править код]Очень ядовит.
Применение
[править | править код]- В производстве специальных стёкол.
- В производстве инсектицидов и фунгицидов.
- Пищевая добавка в корма животным (микроэлемент).
Примечания
[править | править код]- ↑ beta-static.fishersci.com/content/dam/fishersci/en_US/documents/programs/education/regulatory-documents/sds/chemicals/chemicals-f/S25325A.pdf
Литература
[править | править код]- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1995. — Т. 4. — 639 с. — ISBN 5-82270-092-4.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
Это заготовка статьи о неорганическом веществе. Помогите Википедии, дополнив её. |













