Металлическая связь (Bymgllncyvtgx vfx[,)
Металли́ческая связь — химическая связь между атомами в металлическом кристалле, возникающая за счёт перекрытия их валентных электронов. Металлическая связь описывается многими физическими свойствами металлов, такими как прочность, пластичность, теплопроводность, удельное электрическое сопротивление и проводимость, непрозрачность и блеск[1][2][3][4].
Механизм металлической связи
[править | править код]В узлах кристаллической решётки расположены положительные ионы металла. Между ними беспорядочно, подобно молекулам газа, движутся электроны проводимости, происходящие из атомов металлов при образовании ионов. Эти электроны играют роль «цемента», удерживая вместе положительные ионы; в противном случае решётка распалась бы под действием сил отталкивания между ионами. Вместе с тем и электроны удерживаются ионами в пределах кристаллической решётки и не могут её покинуть. Когда металл принимает какую-либо форму или растягивается, он не разрушается, потому что ионы в его кристаллической структуре довольно легко смещаются относительно друг друга[5]. Силы связи не локализованы и не направлены. В металлах в большинстве случаев проявляются высокие координационные числа (например, 12 или 8).

Так, щелочные металлы кристаллизуются в кубической объёмно-центрированной решётке, и каждый положительно заряженный ион щелочного металла имеет в кристалле по восемь ближайших соседей — положительно заряженных ионов щелочного металла (рис. 1). Кулоновское отталкивание одноимённо заряженных частиц (ионов) компенсируется электростатическим притяжением к электронам связывающих звеньев, имеющих форму искажённого сплющенного октаэдра — квадратной бипирамиды, высота которой и рёбра базиса равны величине постоянной решётки aw кристалла щелочного металла (рис. 2).
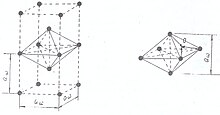
Связывающие электроны становятся общими для системы из шести положительных ионов щелочных металлов и удерживают последние от кулоновского отталкивания.
Величина постоянной трансляционной решётки aw кристалла щелочного металла значительно превышает длину ковалентной связи молекулы щелочного металла, поэтому принято считать, что электроны в металле находятся в свободном состоянии:
| Щелочной металл | Li | Na | K | Rb | Cs |
|---|---|---|---|---|---|
| Постоянная решётки aw, Å[6] | 3,502 | 4,282 | 5,247 | 5,690 | 6,084 |
| Длина ковалентной связи для Me2, Å[7] | 2,67 | 3,08 | 3,92 | 4,10 | 4,30 |
Математическое построение, связанное со свойствами свободных электронов в металле, обычно отождествляют с «поверхностью Ферми», которую следует рассматривать как геометрическое место в k-пространстве, где пребывают электроны, обеспечивая основное свойство металла — проводить электрический ток[8]. Таким образом, электрический ток в металлах — это движение сорванных с орбитального радиуса электронов в поле положительно заряженных ионов, находящихся в узлах кристаллической решётки металла. Выход и вход свободных электронов в связывающее звено кристалла осуществляется через точки «0», равноудалённые от положительных ионов атомов (рис. 2).
Свободное движение электронов в металле подтверждено в 1916 году опытом Толмена и Стюарта по резкому торможению быстро вращающейся катушки с проводом — свободные электроны продолжали двигаться по инерции, в результате чего гальванометр регистрировал импульс электрического тока. Свободное движение электронов в металле обусловливает высокую теплопроводность металла и склонность металлов к термоэлектронной эмиссии, происходящей при умеренной температуре.
Колебание ионов кристаллической решётки создаёт сопротивление движению электронов по металлу, сопровождающееся разогревом металла. В настоящее время важнейшим признаком металлов считается положительный температурный коэффициент электрической проводимости, то есть понижение проводимости с ростом температуры. С понижением температуры электросопротивление металлов уменьшается, вследствие уменьшения колебаний ионов в кристаллической решётке. В процессе исследования свойств материи при низких температурах Камерлинг-Оннес открывает явление сверхпроводимости. В 1911 году ему удаётся обнаружить уменьшение электросопротивления ртути при температуре кипения жидкого гелия (4,2 К) до нуля. В 1913 году Камерлинг-Оннесу присуждается Нобелевская премия по физике со следующей формулировкой: «За исследование свойств веществ при низких температурах, которые привели к производству жидкого гелия».
Однако теория сверхпроводимости была создана позднее. В её основе лежит концепция куперовской электронной пары — коррелированного состояния связывающих электронов с противоположными спинамии и импульсами, и, следовательно, сверхпроводимость можно рассматривать как сверхтекучесть электронного газа, состоящего из куперовских пар электронов, через ионную кристаллическую решётку. В 1972 году авторам теории БКШ — Бардину, Куперу и Шрифферу присуждена Нобелевская премия по физике «За создание теории сверхпроводимости, обычно называемой БКШ-теорией».
Характерные кристаллические решётки
[править | править код]Большинство металлов образует одну из следующих высокосимметричных решёток с плотной упаковкой атомов: кубическую объемно центрированную, кубическую гранецентрированную и гексагональную.
В кубической объемно центрированной решётке (ОЦК) атомы расположены в вершинах куба и один атом в центре объёма куба. Кубическую объемно центрированную решётку имеют металлы: K, Na, Li, β-Ti, β-Zr, Ta, W, V, α-Fe, Cr, Nb, Ba и др.
В кубической гранецентрированной решётке (ГЦК) атомы расположены в вершинах куба и в центре каждой грани. Решётку такого типа имеют металлы: α-Ca, Ce, α-Sr, Pb, Ni, Ag, Au, Pd, Pt, Rh, γ-Fe, Cu, α-Co и др.
В гексагональной решётке атомы расположены в вершинах и центре шестигранных оснований призмы, а три атома — в средней плоскости призмы. Такую упаковку атомов имеют металлы: Mg, α-Ti, Cd, Re, Os, Ru, Zn, β-Co, Be, β-Ca и др.
Другие свойства
[править | править код]Свободно движущиеся электроны обусловливают высокую электро- и теплопроводность. Многие металлы обладают высокой твёрдостью, например хром, молибден, тантал, вольфрам и др. Вещества, обладающие металлической связью, часто сочетают прочность с пластичностью, так как при смещении атомов друг относительно друга не происходит разрыв связей.
Расплавы металлов
[править | править код]Расплавы не теряют свойств кристаллических металлов. И теплопроводность и электропроводность остаётся высокой. В качестве примера можно привести ртутные контакты, в которых в полной мере используются электропроводность жидкой ртути.
Примечания
[править | править код]- ↑ Metallic bonding Архивная копия от 25 июля 2017 на Wayback Machine. chemguide.co.uk
- ↑ Metal structures Архивная копия от 24 апреля 2021 на Wayback Machine. chemguide.co.uk
- ↑ Chemical Bonds Архивная копия от 20 сентября 2015 на Wayback Machine. chemguide.co.uk
- ↑ PHYSICS 133 Lecture Notes Spring, 2004 Marion Campus. physics.ohio-state.edu
- ↑ Metallic bond (англ.). Encyclopædia Britannica. Дата обращения: 1 марта 2020.
- ↑ Справочник химика. — 2-е изд., перераб. и доп. — Л.-М.: ГНТИ Химической литературы, 1962. — Т. 1. — С. 402—513. — 1072 с.
- ↑ Лидин Р. А., Андреева Л. Л., Молочко В. А. Справочник по неорганической химии. Константы неорганических веществ.. — М.: Химия, 1987. — С. 132—136. — 320 с.
- ↑ Зиман Дж. Электроны в металлах (введение в теорию поверхностей Ферми) // Успехи физических наук. — 1962. — Т. 78, вып. 2. — С. 291. — doi:10.3367/UFNr.0078.196210c.0291. Архивировано 24 февраля 2020 года.