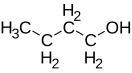
Бутанол-1 (>rmgukl-1)
| н-бутанол | |||
|---|---|---|---|
 | |||
| Общие | |||
| Систематическое наименование |
1-бутанол | ||
| Сокращения | BuOH | ||
| Традиционные названия | бутанол | ||
| Хим. формула | С4H9OH | ||
| Рац. формула | CH3(CH2)3OH | ||
| Физические свойства | |||
| Состояние | жидкость | ||
| Молярная масса | 74,12 г/моль | ||
| Плотность | 0,81 г/см³ | ||
| Динамическая вязкость | 33,79 мПа*с | ||
| Энергия ионизации | 10,04 ± 0,01 эВ[1] и 10,06 эВ[2] | ||
| Термические свойства | |||
| Температура | |||
| • плавления | -90,2 °C | ||
| • кипения | 117,4 °C | ||
| • вспышки | 34 °C | ||
| • самовоспламенения | 345 °C | ||
| Пределы взрываемости | 1,4 ± 0,1 об.%[1] | ||
| Мол. теплоёмк. | 2,359 Дж/(моль·К) | ||
| Удельная теплота испарения | 591,2 кДж/кг | ||
| Давление пара | 6 ± 1 мм рт.ст.[1] | ||
| Химические свойства | |||
| Константа диссоциации кислоты | 16 | ||
| Растворимость | |||
| • в воде | 7,9 г/100 мл | ||
| Оптические свойства | |||
| Показатель преломления | 1,399 | ||
| Структура | |||
| Дипольный момент | 5,5E−30 Кл·м[2] | ||
| Классификация | |||
| Рег. номер CAS | 71-36-3 | ||
| PubChem | 263 | ||
| Рег. номер EINECS | 200-751-6 | ||
| SMILES | |||
| InChI | |||
| RTECS | EO1400000 | ||
| ChEBI | 28885 | ||
| Номер ООН | 1120 | ||
| ChemSpider | 258 | ||
| Безопасность | |||
| ЛД50 | 2290–4360 мг/кг | ||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Бутанол-1 (н-бутанол, н-бутиловый спирт) C4H9OH — представитель одноатомных спиртов.
Физические свойства
[править | править код]Бесцветная вязковатая жидкость с характерным запахом сивушного масла. Смешивается с органическими растворителями. В отличие от метанола, этанола и пропанола только умеренно растворяется в воде — 7,6 г на 100 г воды. С ней образует азеотроп, содержащий 55,5[3] % по массе бутанола и кипящий при 92,4 °C.[источник не указан 2103 дня]
Производство
[править | править код]В промышленности бутанол получают:
- оксосинтезом из пропилена с использованием никель-кобальтовых катализаторов при 1,0-1,5 МПа(По Реппе).
- Из ацетальдегида через ацетальдоль и кротоновый альдегид, который гидрируют на медных, меднохромовых или никелевых катализаторах.
- Ацетоно-бутиловым брожением пищевого сырья.
Историческая справка
[править | править код]Нормальный первичный бутиловый спирт впервые получил в 1870 году русский химик-органик Александр Михайлович Зайцев (1841—1910).
Бутанол начал производиться в 10-х годах XX века с использованием бактерии Clostridium acetobutylicum. Сырьём для производства могут быть сахарный тростник, свекла, кукуруза, пшеница, маниока, а в будущем и целлюлоза.
В 50-х годах из-за падения цен на нефть начал производиться из нефтепродуктов.
В США ежегодно производится около 1,39 млрд литров бутанола.
Очистка и сушка
[править | править код]Существует несколько способов очистки бутанола в лаборатории:
- обычная фракционная перегонка с отделением азеотропа
- сначала кипятят 4 часа над свежепрокалённой жженой известью без доступа влаги (30 г на 1л), затем кипятят над магниевой стружкой. После спирт перегоняют и собирают фракцию 117,70±0,01 °C
- промыванием раствором бисульфита натрия, затем кипячением над 10 % водной натриевой щелочью и наконец тройным трёхчасовым кипячением над жженой известью с последующей фракционной перегонкой
Применение
[править | править код]Бутанол применяют:
- как растворитель в лакокрасочной промышленности, в производстве смол и пластификаторов
- модификаторы мочевино- и меламино-формальдегидных смол
- для получения пластификаторов: дибутилфталата, трибутилфосфата
- для получения бутилацетата и бутилакрилата и эфиров с гликолями
- в синтезе многих органических соединений.
Применение в качестве автомобильного топлива
[править | править код]Может, но не обязательно должен, смешиваться с традиционными топливами. Энергия бутанола близка к энергии бензина. Бутанол может использоваться в топливных элементах, как сырьё для производства водорода.
В 2007 году в Великобритании начались продажи биобутанола в качестве добавки к бензину.
Охрана труда и техника безопасности
[править | править код]Пары н-бутилового спирта оказывают раздражающее действие на конъюнктиву и роговицу глаз[4]. Согласно Роспотребнадзору[5] предельно-допустимая концентрация для паров этого вещества 10 мг/м3 (среднесменная, за 8 часов) и 30 мг/м3 (максимально разовая). В то же время порог восприятия запаха этого вещества у разных людей может быть очень разным. Например, по данным[6] средние значения порога восприятия запаха в группе из 26 человек составили 14—18 ppm (42—54 мг/м3), и превышая 100 ppm (~300 мг/м3) у некоторых участников этого исследования. А в других исследованиях средние значения порога восприятия запаха могли достигать 90 и даже 900[нет в источнике][7] ppm.
Токсичность бутанола относительно невелика (LD50 составляет 2290—4360 мг/кг), но вторая среди младших спиртов (после метанола). При употреблении внутрь возникает эффект, сходный с эффектом от употребления этанола. Бутанол содержится в небольших количествах в различных алкогольных напитках. Иногда бутанол, полученный из технических жидкостей, используется в качестве суррогатного алкогольного напитка.
Концентрация в 0,01 % в воздухе никак не влияет на организм, в то время как 0,02 % вызывает воспаление роговой оболочки глаза.
КПВ 1,7—12 %.
Примечания
[править | править код]- ↑ 1 2 3 http://www.cdc.gov/niosh/npg/npgd0076.html
- ↑ 1 2 David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ Двойные водные азеотропные смеси в справочнике на сайте «Органическая химия». Дата обращения: 14 марта 2019. Архивировано 30 марта 2019 года.
- ↑ А. Я. Хорлин. Бутиловые спирты // Большая медицинская энциклопедия : в 30 т. / гл. ред. Б.В. Петровский. — 3 изд. — Москва : Советская энциклопедия, 1976. — Т. 3. Беклемишев - Валидол. — С. 538—539. — 584 с. — 150 000 экз.
- ↑ (Роспотребнадзор). № 418. Бутан-1-ол (бутиловый спирт) // ГН 2.2.5.3532-18 «Предельно допустимые концентрации (ПДК) вредных веществ в воздухе рабочей зоны» / утверждены А.Ю. Поповой. — Москва, 2018. — С. 29. — 170 с. — (Санитарные правила). Архивировано 12 июня 2020 года.
- ↑ Monique Smeets & Pamela Dalton. Perceived odor and irritation of isopropanol: a comparison between naïve controls and occupationally exposed workers (англ.) // International Archives of Occupational and Environmental Health. — Springler, 2002. — November (vol. 75 (iss. 8). — P. 541–548. — ISSN 0340-0131. — doi:10.1007/s00420-002-0364-y. Архивировано 4 ноября 2015 года.
- ↑ J. Enrique Cometto-Muñiz & William S. Cain. Efficacy of Volatile Organic Compounds in Evoking Nasal Pungency and Odor (англ.) // Archives of Environmental Health: An International Journal. — Taylor & Francis, 1993. — May (vol. 48 (iss. 5). — P. 309—314. — ISSN 0003-9896. — doi:10.1080/00039896.1993.9936719.
Литература
[править | править код]- Химическая энциклопедия 1988, «Советская энциклопедия», Т1, стр. 336—337
- Вайсбергер «Органические растворители: Физические свойства и способы очистки», М., 1958, стр. 317—319
| Бутанол | ||||
| Систематическое название | Бутанол-1 | 2-Метилпропанол-1 | Бутанол-2 | 2-Метилпропанол-2 |
| Тривиальные названия | н-Бутанол | изо-Бутанол | втор-Бутанол | трет-Бутанол |
| Структурная формула |  |

| ||