Фенотиазин (Syukmng[nu)
| Фенотиазин | |
|---|---|
   | |
| Общие | |
| Систематическое наименование |
10Н-фенотиазин |
| Традиционные названия | Тиодифениламин, дибензотиазин, парадибензотиазин, 10H-дибензо-[b,e]-1,4-тиазин |
| Хим. формула | (С6Н4)2S(NH) |
| Рац. формула | С12Н9NS |
| Физические свойства | |
| Состояние | твёрдое |
| Примеси | <2%[1] |
| Молярная масса | 199,27 [1] г/моль |
| Плотность | 1,362[2] |
| Термические свойства | |
| Температура | |
| • плавления | 182—187 °C |
| • кипения | 371 °C |
| • разложения | 371 °C |
| Давление пара | 0 Па[7] |
| Химические свойства | |
| Константа диссоциации кислоты | 2,5[3] |
| Растворимость | |
| • в воде | 0,000051[2] |
| • в пропиленгликоле | <1,15[4] |
| • в этиловом спирте | 2[5] |
| • в ацетоне | 20[3] |
| Оптические свойства | |
| Показатель преломления | 1.6353[2] |
| Классификация | |
| Рег. номер CAS | 92-84-2 |
| PubChem | 7108 |
| Рег. номер EINECS | 202-196-5 |
| SMILES | |
| InChI | |
| RTECS | SN5075000 |
| ChEBI | 37931 |
| ChemSpider | 21106365 |
| Безопасность | |
| Токсичность | для высших животных нетоксичен; способен вызывать раздражение кожи[6] |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Фенотиази́н — гетероциклическое соединение, содержащее в цикле атомы серы и азота (другие названия — тиодифениламин, дибензотиазин, парадибензотиазин, 10H-дибензо-[b, e]-1,4-тиазин). Брутто-формула — С12Н9NS. Является сернистым аналогом феноксазина. Производные фенотиазина — лекарственные средства, обладающие холиноблокирующими (диэтазин), нейролептическим (аминазин[8]), антигистаминным (дипразин[9]) или антиаритмическим (этмозин[10]) действием, а также красители.
Согласно номенклатуре ИЮПАК, фенотиазины нумеруются против часовой стрелки, начиная с атома углерода, следующего за атомом азота[11]:
Получение
[править | править код]Впервые фенотиазин был синтезирован Бернтсеном в 1883 году путём нагревания дифениламина с серой[12]:
Фенотиазин может быть получен взаимодействием серы с дифениламином в присутствии катализатора — иода или хлорида алюминия. Для присоединения серы также могут использоваться дихлорид серы или тионилхлорид, но в этом случае происходит побочная реакция хлорирования. Реакция проходит при температуре 180—250°С. С помощью данной реакции можно получать также и производные фенотиазина, однако некоторые дифениламины, в особенности 2-замещённые, в неё не вступают, а 3-замещённые могут давать как 2-, так и 4-замещённые производные фенотиазина.[11]
Обобщённым методом получения фенотиазина и его производных является превращение 2'-галоген- или -нитропроизводных 2-аминодифенилсульфида в присутствии сильных оснований (КNH2, жидкого аммиака) с образованием гетероцикла[13]:
3-замещённые производные фенотиазина получаются при нагревании о-нитродифенилсульфидов с триэтилфосфитом[11]:
Физические свойства
[править | править код]Фенотиазин представляет собой жёлтые кристаллы, на воздухе зеленеющие из-за окисления, без вкуса, со слабым характерным запахом. Технический фенотиазин представляет собой серовато-зелёный порошок.[5] Температура плавления, по разным данным, от 182 до 189°С[1][13]. Кипит с разложением при 371°С; температура кипения при 40 мм рт. ст. — 290°С. Плохо растворим в воде, диэтиловом эфире и бензоле; при нагревании растворим в этаноле и уксусной кислоте. Летуч, перегоняется с водяным паром.[13] Коэффициент распределения в системе октанол/вода — 4,2[3]
Химические свойства[11][13]
[править | править код]При нагревании с медью фенотиазин отщепляет атом серы, переходя при этом в карбазол:

При обработке бутиллитием фенотиазин даёт 1,10-дилитийпроизводное, при карбоксилировании которого образуется фенотиазинкарбоновая-1 кислота:

Фенотиазин проявляет восстановительные свойства. Под воздействием перманганата калия и перекиси водорода происходит окисление по атому серы с образованием неустойчивого, легко восстанавливающегося до фенотиазина фенотиазиноксида-5 и более устойчивого фенотиазиндиоксида-5,5:

При взаимодействии с другими окислителями (серная кислота, Fe(III), Ce(IV)) происходит С-окисление в положения 3 и 7:

Будучи ароматическим соединением, фенотиазин является донором электронов и легко вступает в реакции электрофильного замещения.
Хлорирование фенотиазина в среде уксусной кислоты приводит к замещению хлором атомов водорода сначала в положениях 3 и 7, а затем 1 и 9. Конечным продуктом хлорирования является 1,3,7,9-тетрахлорфенотиазин:

При хлорировании в среде нитробензола происходит глубокое хлорирование с присоединением до 11 атомов хлора и потерей ароматичности одного из колец:

При нагревании до 180°С этот продукт ощепляет три атома хлора, при этом образуется устойчивый свободный радикал, который частично димеризуется, в результате чего образуется 10,10'-би-(октахлорфенотиазинил).

Соотношение свободного радикала и 10,10'-би-(октахлорфенотиазинил)а при температуре 180°С составляет 30:70.
При бромировании фенотиазина в уксусной кислоте последовательно образуются 3,7-, 1,3,7- и 1,3,7,9-бромпроизводные. Бромирование в среде нитробензола приводит к образованию 1,2,3,7,8,9-гексабромфенотиазина.
При окислении фенотиазина хлоридом железа (III) в присутствии п-толуолсульфоната натрия, нитрита натрия или тиомочевины образуются соответственно 3-(п-толуолсульфонил)фенотиазин и 3-нитрофенотиазин, а после гидролиза изотиурониевой соли — 3-меркаптофенотиазин. В присутствии соединений, содержащими активные метиленовые группы, образуются красители с хиноидной структурой, например, в результате взаимодействия с индандионом-1,3:
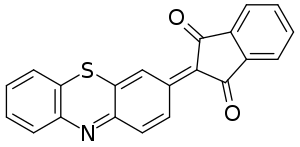
Электрофильное замещение в фенотиазине может также сопровождаться окислением. Так, конечным продуктом нитрования фенотиазина азотной кислотой является 3,7-динитрофенотиазиноксид-5:

а нитрование азотистой кислотой приводит к 3,7-динитрофенотиазину:

Ацилирование фенотиазина по Фриделю-Крафтсу приводит в основном к замещению в положения 2,10, однако выделены также продукты реакции неустановленного состава:

Фенотиазин сульфируется хлорсульфоновой кислотой. Алкилирование фенотиазина алкенами в присутствии трифторида бора приводит к 3,7 диалкилпроизводным:

При взаимодействии фенотиазина с хлорзамещёнными третичными и вторичными аминами в присутствии амида натрия образуются 10-замещённые производные фенотиазина. Например, при алкилировании фенотиазина 2-диметиламино-1-хлорпропаном или 1-диметиламино-2-хлорпропаном образуется 10-(2-диметиламинопропил)фенотиазин (прометазин):

Фенотиазин вступает в реакцию Ульмана, при нагревании с металлической медью и иодбензолом в среде нитробензола, толуола или ДМФА[14] присоединение бензольного кольца происходит в положение 10 с образованием 10-фенилфенотиазина:

При взаимодействии фенотиазина с фосгеном образуется 10-хлоркарбонилфенотиазин, при реакции с аминоспиртами образующий сложные эфиры, которые при нагревании в вакууме с медью отщепляют углекислый газ, что позволяет вводить чувствительные к щелочам группы:

Физиологическое действие
[править | править код]Фенотиазин при проглатывании может вызывать боли в животе, тошноту и рвоту[15], приводит к поражениям печени и почек, вызывает гемолитическую анемию[16]. 40 % фенотиазина, введённого перорально, выводится в неизменном виде с мочой[5]. При вдыхании паров и пыли вызывает кашель и боли в горле[15]. При местном воздействии вызывает поражение кожи на кистях рук, предлечьях, лице, шее, животе и спине в области поясницы, реже на груди, голенях, бедрах. Вначале кожа становится сухой и блестящей и уменьшается сало- и потоотделение, затем кожа начинает шелушиться, иногда появляется зуд. На ладонях возникает ороговение кожи и трещины. Волосы и ногти окрашиваются в оранжевый цвет[16].
При работе с фенотиазином следует использовать защитную одежду, перчатки, маски и защитные очки. После работы необходимо мыть руки и лицо, а также принимать душ[16].
Производные фенотиазина
[править | править код]История исследования
[править | править код]Получение
[править | править код]Химические свойства
[править | править код]Лекарственные препараты
[править | править код]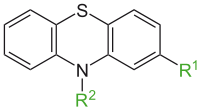
Красители
[править | править код]

Обнаружение и определение[17]
[править | править код]Фенотиазин и его 2,10-замещённые производные являются слабыми основаниями, поэтому их изолирование из субстратов производится путём экстракции органическими растворителями из щелочных растворов. При извлечении производных фенотиазина из твёрдых субстратов (лекарственные формы, органы трупов) в качестве экстрагента используют диэтиловый эфир, при извлечении из жидкостей (кровь, моча, водные растворы) — н-гептан с добавлением 3 % изопропилового спирта.
Фенотиазин может быть обнаружен с помощью цветных реакций — при добавлении раствора хлорида железа (III) содержащие фенотиазин растворы приобретают зелёную окраску, при добавлении перекиси водорода — красную.[11] В качестве реактивов на производные фенотиазина используется реактив FPN (раствор хлорида железа (III), хлорной и азотной кислот), который даёт с ними красное, розовое, голубое или красно-фиолетовое окрашивание, в зависимости от заместителей. Также для качественной идентификации 2,10-производных фенотиазина могут использоваться спектры абсорбции продуктов их окисления концентрированной серной кислотой и реактивом Манделина в ультрафиолетовой и видимой частях спектра. Также для разделения и обнаружения производных фенотиазина используется метод тонкослойной хроматографии, при этом в качестве подвижной фазы используется смесь этилацетата, ацетона и раствора аммиака в этиловом спирте, а для проявления хроматограммы — смесь серной кислоты и этанола.
Для количественного определения производных фенотиазина используются колориметрические методы (определение оптической плотности продуктов реакции производных фенотиазина с реактивом Манделина) и метод газо-жидкостной хроматографии (ГЖХ).
Примечания
[править | править код]- ↑ 1 2 3 Фенотиазин в каталоге Sigma-Aldrich. Дата обращения: 6 июля 2010. Архивировано 16 июля 2011 года.
- ↑ 1 2 3 Физические свойства фенотиазина. Дата обращения: 13 июля 2010. Архивировано 21 июня 2008 года.
- ↑ 1 2 3 Clarke's Analysis of Drugs and Poisons/Monographs/Phrnothiazine
- ↑ Таблица растворимости веществ в пропиленгликоле. Дата обращения: 13 июля 2010. Архивировано 27 мая 2010 года.
- ↑ 1 2 3 Фенотиазин на xumuk.ru. Дата обращения: 13 июля 2010. Архивировано 7 декабря 2009 года.
- ↑ Дональд Ф. Н. «Химия инсектицидов и фунгицидов». Дата обращения: 12 июля 2010. Архивировано из оригинала 6 марта 2016 года.
- ↑ http://www.cdc.gov/niosh/npg/npgd0494.html
- ↑ Аминазин в Государственном реестре лекарственных средств РФ. Дата обращения: 6 июля 2010. Архивировано 8 декабря 2015 года.
- ↑ Дипразин в Государственном реестре лекарственных средств РФ. Дата обращения: 6 июля 2010. Архивировано 8 декабря 2015 года.
- ↑ Этмозин в Государственном реестре лекарственных средств РФ. Дата обращения: 6 июля 2010. Архивировано 8 декабря 2015 года.
- ↑ 1 2 3 4 5 Derek Burton, W. David Ollis. Шестичленные гетероциклы // Общая органическая химия = Comprensuve Organic Chemistry / Под ред. Н. К. Кочеткова. — М.: Химия, 1985. — Т. 9. — С. 627—635. — 800 с.
- ↑ Robert L. Metcalf. Rewew №1 // The Mode of Action Organic Insecticides. — Washington, D. C.: National Research Council, 1948. — P. 44—46. — 86 p.
- ↑ 1 2 3 4 Фенотиазин в Химической энциклопедии. Дата обращения: 6 июля 2010. Архивировано 27 июля 2010 года.
- ↑ Реакция Ульмана в Химической энциклопедии. Дата обращения: 26 июля 2010. Архивировано 7 января 2012 года.
- ↑ 1 2 Фенотиазин на сайте Института промышленной безопасности, охраны труда и социального партнёрства
- ↑ 1 2 3 Вредные химические вещества Радиоактивные вещества // Новый справочник химика и технолога / под общей редакцией Б.П. Никольского. — СПб.: Профессионал, 2003. — Т. 6. Архивировано 8 июля 2011 года.
- ↑ Методические рекомендации по химико-токсикологическому определению психотропных соединений фенотиазинового ряда / Составитель Е. М. Саломатин. — Казань: Научно-исследовательский институт судебной медицины министерства здравоохранения СССР Бюро судебно-медицинской экспертизы министерства здравоохранения Татарской АССР, 1988. — 58 с.
Некоторые внешние ссылки в этой статье ведут на сайты, занесённые в спам-лист |



