Железо ("yly[k)
| Железо | |||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ← Марганец | Кобальт → | |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
| Внешний вид простого вещества | |||||||||||||||||||||||||||||||||||||||||
 Сверхчистое железо |
|||||||||||||||||||||||||||||||||||||||||
| Свойства атома | |||||||||||||||||||||||||||||||||||||||||
| Название, символ, номер | Железо / Ferrum (Fe), 26 | ||||||||||||||||||||||||||||||||||||||||
| Группа, период, блок |
8 (устар. 8), 4, d-элемент |
||||||||||||||||||||||||||||||||||||||||
| Атомная масса (молярная масса) |
55,845(2)[1] а. е. м. (г/моль) | ||||||||||||||||||||||||||||||||||||||||
| Электронная конфигурация |
[Ar] 3d64s2 1s22s22p63s23p63d64s2 |
||||||||||||||||||||||||||||||||||||||||
| Радиус атома | 140 [2] 126[3] пм | ||||||||||||||||||||||||||||||||||||||||
| Химические свойства | |||||||||||||||||||||||||||||||||||||||||
| Ковалентный радиус | 117 пм | ||||||||||||||||||||||||||||||||||||||||
| Радиус иона | (+3e) 63 (+2e) 77 [3] пм | ||||||||||||||||||||||||||||||||||||||||
| Электроотрицательность | 1,83 (шкала Полинга) | ||||||||||||||||||||||||||||||||||||||||
| Электродный потенциал |
Fe←Fe3+ −0,04 В Fe←Fe2+ −0,44 В |
||||||||||||||||||||||||||||||||||||||||
| Степени окисления | 0; +2, +3 (наиболее характерны в соединениях); +1, +4, +6, +8 (встречаются реже)[2]; +7 (в ионном соединении) [4]. | ||||||||||||||||||||||||||||||||||||||||
| Энергия ионизации |
1‑я: 759,1 (7,893)[2] кДж/моль (эВ)
3‑я: (30,65) кДж/моль (эВ) |
||||||||||||||||||||||||||||||||||||||||
| Термодинамические свойства простого вещества | |||||||||||||||||||||||||||||||||||||||||
| Плотность (при н. у.) | 7,874 г/см³ | ||||||||||||||||||||||||||||||||||||||||
| Температура плавления | 1812 K (1538,85 °C) | ||||||||||||||||||||||||||||||||||||||||
| Температура кипения | 3134 K (2861 °C) | ||||||||||||||||||||||||||||||||||||||||
| Мол. теплота плавления | 247,1 кДж/кг 13,8 кДж/моль | ||||||||||||||||||||||||||||||||||||||||
| Мол. теплота испарения | ~6088 кДж/кг ~340 кДж/моль | ||||||||||||||||||||||||||||||||||||||||
| Молярная теплоёмкость | 25,14[5] Дж/(K·моль) | ||||||||||||||||||||||||||||||||||||||||
| Молярный объём | 7,1 см³/моль | ||||||||||||||||||||||||||||||||||||||||
| Кристаллическая решётка простого вещества | |||||||||||||||||||||||||||||||||||||||||
| Структура решётки | Кубическая объёмноцентрированная | ||||||||||||||||||||||||||||||||||||||||
| Параметры решётки | 2,866 Å | ||||||||||||||||||||||||||||||||||||||||
| Температура Дебая | 460 K | ||||||||||||||||||||||||||||||||||||||||
| Прочие характеристики | |||||||||||||||||||||||||||||||||||||||||
| Теплопроводность | (300 K) 80,4 Вт/(м·К) | ||||||||||||||||||||||||||||||||||||||||
| Номер CAS | 7439-89-6 | ||||||||||||||||||||||||||||||||||||||||
| Эмиссионный спектр | |||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||
| Наиболее долгоживущие изотопы | |||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||
| 26 | Железо
|
| 3d64s2 | |
Желе́зо (химический символ — Fe, от лат. Ferrum) — химический элемент 8-й группы (по устаревшей классификации — побочной подгруппы восьмой группы, VIIIB) четвёртого периода периодической системы химических элементов Д. И. Менделеева с атомным номером 26.
Простое вещество железо — это ковкий переходный металл серебристо-белого цвета с высокой химической реакционной способностью: железо быстро корродирует на воздухе при высоких температурах или при высокой влажности. В чистом кислороде железо горит, а в мелкодисперсном состоянии самовозгорается на воздухе.
Один из самых распространённых в земной коре металлов: второе место после алюминия.
Собственно железом обычно называют его сплавы с малым содержанием примесей (до 0,8 %), которые сохраняют мягкость и пластичность чистого металла. На практике же чаще применяются сплавы железа с углеродом: сталь (до 2,14 вес. % углерода) и чугун (более 2,14 вес. % углерода), а также нержавеющая (легированная) сталь с добавками легирующих металлов (хром, марганец, ванадий и др.). Совокупность специфических свойств железа и его сплавов, а также доступность делают его «металлом № 1» по важности для человека.
В природе железо редко встречается в чистом виде, чаще всего — в составе железо-никелевых метеоритов. Распространённость железа в земной коре — 4,7 %[3] (4-е место после O, Si, Al[6]). Считается также, что железо составляет бо́льшую часть земного ядра, что проявляется в наличии магнитного поля Земли.
Происхождение названия
[править | править код]Праславянское *želězo (бел. жалеза, укр. залізо, ст.‑слав. желѣзо, болг. желязо, сербохорв. жељезо, пол. żelazo, чеш. železo, словен. železo) имеет ясные параллели в балтийских языках (лит. geležis, латыш. dzelzs). Слово является однокоренным словам «железа» и «желвак»; и имеет смысл «округлый камень, окатыш, блямба»[7].
Имеется несколько версий дальнейшей этимологии этого балтославянского слова.
Одна из них связывает праслав. *želězo с греческим словом χαλκός, что означало «железо» и «медь»; согласно другой версии, *želězo родственно словам *žely «черепаха» и *glazъ «скала», с общей семой «камень»[8][9]. Третья версия предполагает древнее заимствование из неизвестного языка[10].
Романские языки (итал. ferro, фр. fer, исп. hierro, порт. ferro, рум. fier) продолжают лат. ferrum. Латинское ferrum (< *ferzom), возможно, заимствовано из какого-то восточного языка, скорее всего, из финикийского. Ср. ивр. barzel, шумерск. barzal, ассирийск. parzilla[11].
Германские языки заимствовали название железа (гот. eisarn, англ. iron, нем. Eisen, нидерл. ijzer, дат. jern, швед. järn) из кельтских[12].
Пракельтское слово *isarno- (> др.-ирл. iarn, др.-брет. hoiarn), вероятно, восходит к пра-и.е. *h1esh2r-no- «кровавый» с семантическим развитием «кровавый» > «красный» > «железо». Согласно другой гипотезе, слово восходит к пра-и.е. *(H)ish2ro- «сильный, святой, обладающий сверхъестественной силой»[13].
Древнегреческое слово σίδηρος (sidеros), возможно, происходит от той же основы, что и славянские, германские и балтийские слова, обозначающие «серебро»[14].
Название природного карбоната железа (сидерита) происходит от лат. sidereus «звёздный».
История
[править | править код]Содержимое этого раздела нуждается в чистке. |
Железо как инструментальный материал известно с древнейших времён. Самые древние изделия из железа, найденные при археологических раскопках, датируются 4-м тысячелетием до н. э. и относятся к древнешумерской и древнеегипетской цивилизациям. Это изготовленные из метеоритного железа, то есть сплава железа и никеля (содержание последнего колеблется от 5 до 30 %), украшения из египетских гробниц (около 3800 года до н. э.)[15][16] и кинжал из шумерского города Ура (около 3100 года до н. э.).[17]
Первыми освоили метод выплавки железа хатты. На это указывает древнейшее (2-е тысячелетие до н. э.) упоминание железа в текстах хеттов, основавших свою империю на территории хаттов (современной Анатолии в Турции)[18].
В древности мастерами железных изделий считались халибы[19].
В самой глубокой древности железо ценилось дороже золота, и по описанию Страбона, у африканских племён за 1 фунт железа давали 10 фунтов золота, а по исследованиям историка Г. Арешяна стоимости меди, серебра, золота и железа у древних хеттов были в соотношении 1 : 160 : 1280 : 6400.[20] В те времена железо использовалось как ювелирный металл, из него делали троны и другие регалии царской власти: например, в библейской книге Второзаконие описан «одр железный» рефаимского царя Ога[21].
По описаниям Гомера, хотя во время Троянской войны (примерно 1250 год до н. э.) оружие было в основном из меди и бронзы, но железо уже было хорошо известно и пользовалось большим спросом, хотя больше как драгоценный металл[22].
В библейской книге Иисуса Навина 17,16 (ср. Судей 14,4) описывается, что филистимляне (библейские «PILISTIM», а это были протогреческие племена, родственные позднейшим эллинам, в основном пеласги) имели множество железных колесниц, то есть в это время железо уже стало широко применяться в больших количествах.
В дальнейшем филистимляне научились делать более эффективные печи (в русском языке — домна, домница) для производства стали, и применили меха для подачи воздуха в горн. Уже римляне умели доводить температуру в печи до плавления стали (около 1400 °C, а чистое железо плавится при 1535 °C). При этом образуется чугун с температурой плавления 1100—1200 °C, очень хрупкий в твёрдом состоянии (даже не поддающийся ковке) и не обладающий упругостью стали.[23][неавторитетный источник] Первоначально его считали[кто?] вредным побочным продуктом (англ. pig iron, «свинское железо, чушки»), но потом обнаружилось[кем?], что при повторной переплавке в печи с усиленным продуванием через него воздуха чугун превращается в сталь хорошего качества, так как лишний углерод выгорает. Такой двухстадийный процесс производства стали из чугуна оказался более простым и выгодным, чем кричный, и этот принцип используется без особых изменений многие века и остаётся до сегодняшнего дня основным способом производства железных материалов[24].
Изотопы
[править | править код]Природное железо состоит из четырёх стабильных изотопов: 54Fe (изотопная распространённость 5,845 %), 56Fe (91,754 %), 57Fe (2,119 %) и 58Fe (0,282 %). Также известно более 20 нестабильных изотопов железа с массовыми числами от 45 до 72, наиболее устойчивые из которых — 60Fe (период полураспада по уточнённым в 2009 году данным составляет 2,6 миллиона лет[25]), 55Fe (2,737 года), 59Fe (44,495 суток) и 52Fe (8,275 часа); остальные изотопы имеют период полураспада менее 10 минут[26].
Изотоп железа 56Fe относится к наиболее стабильным ядрам: все следующие элементы могут увеличить энергию связи на нуклон путём распада, а все предыдущие элементы, в принципе, могли бы увеличить энергию связи на нуклон за счёт синтеза. Полагают, что железом оканчивается ряд синтеза элементов в ядрах нормальных звёзд (см. Железная звезда), а все последующие элементы могут образоваться только в результате взрывов сверхновых[27].
Геохимия железа
[править | править код]
Железо — один из самых распространённых элементов во Вселенной, в Солнечной системе, особенно на планетах земной группы и, в частности, на Земле. Значительная часть железа планет земной группы находится в ядрах планет, где его содержание, по оценкам, около 90 %. Содержание железа в земной коре составляет 5 %, а в мантии около 12 %. Из металлов железо уступает по распространённости в коре только алюминию. При этом в ядре находится около 86 % всего железа, а в мантии 14 %. Содержание железа значительно повышается в изверженных породах основного состава, где оно связано с пироксеном, амфиболом, оливином и биотитом. В промышленных концентрациях железо накапливается в течение почти всех экзогенных и эндогенных процессов, происходящих в земной коре. В морской воде железо содержится в очень малых количествах 0,002—0,02 мг/л. В речной воде его концентрация значительно выше — 2 мг/л.
Возникновение в природе
[править | править код]Железо является конечной точкой в череде превращений элементов друг в друга и в синтезе всё более тяжёлых элементов в процессе термоядерного выгорания у большинства звёзд во Вселенной. Именно этим и объясняется его высокое распространение в природе. Для образования более тяжёлых элементов, включая металлы, нужны более редкие и более катастрофические по масштабам Вселенной процессы — например, взрывы сверхновых звёзд или слияния нейтронных звёзд[28][29].
Геохимические свойства железа
[править | править код]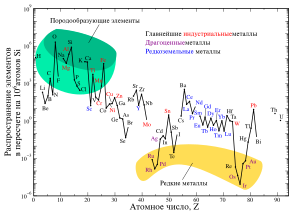
Важнейшая геохимическая особенность железа — наличие у него нескольких степеней окисления. Железо в нейтральной форме — металлическое — слагает ядро Земли, возможно, присутствует в мантии и очень редко встречается в земной коре. Закисное железо FeO — основная форма нахождения железа в мантии и земной коре. Окисное железо Fe2O3 характерно для самых верхних, наиболее окисленных, частей земной коры, в частности, осадочных пород.
По кристаллохимическим свойствам ион Fe2+ близок к ионам Mg2+ и Ca2+ — другим главным элементам, составляющим значительную часть всех земных пород. В силу кристаллохимического сходства железо замещает магний и, частично, кальций во многих силикатах. При этом содержание железа в минералах переменного состава обычно увеличивается с уменьшением температуры.
Минералы железа
[править | править код]В земной коре железо распространено достаточно широко — на его долю приходится около 4,1 % массы земной коры (4-е место среди всех элементов, 2-е среди металлов). В мантии и земной коре железо сосредоточено главным образом в силикатах, при этом его содержание значительно в основных и ультраосновных породах, и мало — в кислых и средних породах.
Известно большое число руд и минералов, содержащих железо. Наибольшее практическое значение имеют красный железняк (гематит, Fe2O3; содержит до 70 % Fe), магнитный железняк (магнетит, FeO · Fe2O3 или Fe3O4; содержит 72,4 % Fe), бурый железняк или лимонит (гётит и гидрогётит, соответственно FeOOH и FeOOH·nH2O). Гётит и гидрогётит чаще всего встречаются в корах выветривания, образуя так называемые «железные шляпы», мощность которых достигает несколько сотен метров. Также они могут иметь осадочное происхождение, выпадая из коллоидных растворов в озёрах или прибрежных зонах морей. При этом образуются оолитовые, или бобовые, железные руды. В них часто встречается вивианит Fe3(PO4)2·8H2O, образующий чёрные удлинённые кристаллы и радиально-лучистые агрегаты.
В природе также широко распространены сульфиды железа — пирит FeS2 (серный или железный колчедан) и пирротин. Они не являются железной рудой — пирит используют для получения серной кислоты, а пирротин часто содержит никель и кобальт.
По запасам железных руд Россия занимает первое место в мире[источник не указан 4264 дня].
Содержание железа в морской воде — 1⋅10−5—1⋅10−8 %.
Другие часто встречающиеся минералы железа[30]:
- Сидерит — FeCO3 — содержит примерно 35 % железа. Обладает желтовато-белым (с серым или коричневым оттенком в случае загрязнения) цветом. Плотность равна 3 г/см3 и твёрдость 3,5—4,5 по шкале Мооса.
- Марказит — FeS2 — содержит 46,6 % железа. Встречается в виде жёлтых, как латунь, бипирамидальных ромбических кристаллов с плотностью 4,6—4,9 г/см3 и твёрдостью 5—6 по шкале Мооса.
- Лёллингит — FeAs2 — содержит 27,2 % железа и встречается в виде серебристо-белых бипирамидальных ромбических кристаллов. Плотность равна 7—7,4 г/см3, твёрдость 5—5,5 по шкале Мооса.
- Миспикель — FeAsS — содержит 34,3 % железа. Встречается в виде белых моноклинных призм с плотностью 5,6—6,2 г/см3 и твёрдостью 5,5—6 по шкале Мооса.
- Мелантерит — FeSO4·7H2O — реже встречается в природе и представляет собой зелёные (или серые из-за примесей) моноклинные кристаллы, обладающие стеклянным блеском, хрупкие. Плотность равна 1,8—1,9 г/см3.
- Вивианит — Fe3(PO4)2·8H2O — встречается в виде сине-серых или зелёно-серых моноклинных кристаллов с плотностью 2,95 г/см3 и твёрдостью 1,5—2 по шкале Мооса.
Помимо вышеописанных минералов железа, существуют, например:
- ильменит — FeTiO3
- магномагнетит — (Fe,Mg)[Fe2O4]
- фиброферрит — FeSO4(OH)·4,5H2O
- ярозит — KFe3(SO4)2(OH)6
- кокимбит — Fe2(SO4)3·9H2O
- рёмерит — Fe2+Fe3+2(SO4)4·14H2O
- графтонит — (Fe,Mn)3(PO4)2
- скородит — Fe3+AsO4·2H2O
- штренгит — FePO4·2H2O
- фаялит — Fe2SiO4
- альмандин — Fe3Al2[SiO4]3
- андрадит — Ca3Fe2[SiO4]3
- гиперстен — (Fe,Mg)2[Si2O6]
- геденбергит — (Ca,Fe)[Si2O6]
- эгирин — (Na,Fe)[Si2O6]
- шамозит — Fe2+4Al[AlSi3O10](OH)6·nH2O
- нонтронит — (Fe3+,Al)2[Si4O10](OH)2·nH2O
Основные месторождения
[править | править код]По данным Геологической службы США (оценка 2011 года), мировые разведанные запасы железной руды составляют около 160 млрд тонн[31]. Основные залежи железа(в пересчёте на содержание элементарного железа) находятся в России (1 место), Бразилии, Австралии, США, Канаде, Швеции, Германии, Венесуэле, Либерии, Украине, Польше, ЮАР, Японии, Китае, Болгарии, Монголии, Франции, Индии. Эти данные не учитывают открытого недавно в Боливии крупнейшего в мире месторождения Эль-Мутун, запасы которого оцениваются в 40,2 млрд тонн руды[32] (5 % мировых запасов[33]).
В 2019 было добыто 2,896 млрд тонн железной руды, общей стоимостью приблизительно 366 млрд долларов США[34]. Цена железной руды составляет 126,35 долларов за тонну[35].
Физические свойства
[править | править код]Железо — типичный металл, в свободном состоянии — серебристо-белого цвета с сероватым оттенком. Чистый металл пластичен, различные примеси (в частности — углерод) повышают его твёрдость и хрупкость. Обладает ярко выраженными магнитными свойствами. Часто выделяют так называемую «триаду железа» — группу трёх металлов (железо Fe, кобальт Co, никель Ni), обладающих схожими физическими свойствами, атомными радиусами и значениями электроотрицательности.
Для железа характерен полиморфизм, оно имеет четыре кристаллические модификации:
- до 769 °C существует α-Fe (феррит) с объёмноцентрированной кубической решёткой и свойствами ферромагнетика (769 °C ≈ 1043 K — точка Кюри для железа);
- в температурном интервале 769—917 °C существует β-Fe, который отличается от α-Fe только параметрами объёмно-центрированной кубической решётки и магнитными свойствами парамагнетика;
- в температурном интервале 917—1394 °C существует γ-Fe (аустенит) с гранецентрированной кубической решёткой;
- выше 1394 °C устойчиво δ-Fe с объёмно-центрированной кубической решёткой.
Металловедение не выделяет β-Fe как отдельную фазу[36], и рассматривает её как разновидность α-Fe. При нагреве железа или стали выше точки Кюри (769 °C ≈ 1043 K) тепловое движение ионов расстраивает ориентацию спиновых магнитных моментов электронов, ферромагнетик становится парамагнетиком — происходит фазовый переход второго рода, но фазового перехода первого рода с изменением основных физических параметров кристаллов не происходит.
Для чистого железа при нормальном давлении, с точки зрения металловедения, существуют следующие устойчивые модификации:
- от абсолютного нуля до 910 °C устойчива α-модификация с объёмноцентрированной кубической (ОЦК) кристаллической решёткой;
- от 910 до 1400 °C устойчива γ-модификация с гранецентрированной кубической (ГЦК) кристаллической решёткой;
- от 1400 до 1539 °C устойчива δ-модификация с объёмно-центрированной кубической (ОЦК) кристаллической решёткой.
Наличие в стали углерода и легирующих элементов существенным образом изменяет температуры фазовых переходов (см. фазовую диаграмму железо—углерод). Твёрдый раствор углерода в α- и δ-железе называется ферритом. Иногда различают высокотемпературный δ-феррит и низкотемпературный α-феррит (или просто феррит), хотя их атомные структуры одинаковы. Твёрдый раствор углерода в γ-железе называется аустенитом.
- В области высоких давлений (свыше 13 ГПа, 128,3 тыс. атм.[37]) возникает модификация ε-железа с гексагональной плотноупакованной (ГПУ) решёткой.
Явление полиморфизма чрезвычайно важно для металлургии стали. Именно благодаря α—γ переходам кристаллической решётки происходит термообработка стали. Без этого явления железо как основа стали не получило бы такого широкого применения.
Железо относится к умеренно тугоплавким металлам. Температура плавления железа 1539 °C, температура кипения — 2862 °C.
Химические свойства
[править | править код]Характерные степени окисления
[править | править код]| Степень окисления | Оксид | Гидроксид | Характер | Окислительно-восстановительные свойства |
|---|---|---|---|---|
| +2 | FeO | Fe(OH)2 | Слабоосновный | Слабый восстановитель |
| +3 | Fe2O3 | Fe(OH)3 | Очень слабое основание, иногда — амфотерный | Слабый окислитель |
| +6 | Не получен | <H2FeO4>* | Кислотный | Сильный окислитель |
* Кислота в свободном виде не существует — получены только её соли.
В ряду стандартных электродных потенциалов железо стоит до водорода и легко реагирует с разбавленными кислотами. Таким образом, железо относится к металлам средней активности. Химическая активность железа зависит от степени его чистоты, дисперсности, присутствия влаги и кислорода.
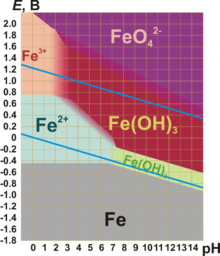
Для железа наиболее характерны степени окисления — +2 и +3.
Степени окисления +2 соответствует чёрный оксид FeO и зелёный гидроксид Fe(OH)2. Они имеют основный характер. В солях Fe(II) присутствует в виде катиона. Fe(II) — слабый восстановитель.
Степени окисления +3 соответствуют красно-коричневый оксид Fe2O3 и коричневый гидроксид Fe(OH)3. Они носят амфотерный характер, хотя и кислотные, и основные свойства у них выражены слабо. Так, ионы Fe3+ гидролизуются даже в кислой среде. Fe(OH)3 растворяется только в концентрированных щелочах. Fe2O3 реагирует со щелочами при сплавлении, давая ферриты (формальные соли не существующей в свободном виде кислоты HFeO2):
Железо(III) чаще всего проявляет слабые окислительные свойства.
Степени окисления +2 и +3 легко переходят друг в друга при изменении окислительно-восстановительных потенциалов.
Кроме того, существует оксид Fe3O4, формальная степень окисления железа в котором +8/3. Однако этот оксид следует скорее рассматривать как феррит железа(II) Fe+2(Fe+3O2)2.
Также существует степень окисления +6. Соответствующего оксида и гидроксида в свободном виде не существует, но получены соли — ферраты (например, K2FeO4). Железо(VI) находится в них в составе аниона. Ферраты являются сильными окислителями.
Известны также степени окисления: −2 (тетракарбонилферрат натрия), −1, 0 (пентакарбонил железа), +1, +4, +5.
Свойства простого вещества
[править | править код]При хранении на воздухе при температуре до 200 °C железо постепенно покрывается плотной плёнкой оксида, препятствующей дальнейшему окислению металла. Во влажном воздухе железо покрывается рыхлым слоем ржавчины, который не препятствует доступу кислорода и влаги к металлу и его разрушению. Ржавчина не имеет постоянного химического состава, приближённо её химическую формулу можно записать как Fe2O3·xH2O.
Взаимодействует с кислотами.
- С соляной кислотой, образуя хлорид железа(ΙΙ):
- С разбавленной серной кислотой, образуя сульфат железа(II):
- Концентрированные азотная и серная кислоты пассивируют железо. C концентрированной серной кислотой взаимодействует только при нагревании, образуя сульфат железа(III):
- Взаимодействие с кислородом.
- Железо[38] горит в кислороде при нагревании; также в виде мелкодисперсного порошка обладает пирофорностью; образуя оксид железа(II,III):[39][40][41]:
- Пропускание кислорода или воздуха через расплавленное железо, образуется оксид железа(II):
- Взаимодействует с порошком серы при нагревании, образуя сульфид железа(II):
- Взаимодействует с галогенами при нагревании:
- Горит в хлоре, образуя хлорид железа(III) :
- При повышенном давлении взаимодействует с парами брома, образуя бромид железа(III):
- Взаимодействует с йодом, образуя иодид железа(II,III):
- Взаимодействие с неметаллами.
- С азотом при нагревании, образуя нитрид дижелеза:
- С фосфором при нагревании, образуя фосфиды железа:
- С углеродом, образуя карбид железа:
- С кремнием при нагревании, образуя силицид железа:
- Взаимодействие раскалённого железа с водяным паром даёт оксид железа(III):
- Железо восстанавливает металлы, которые в ряду активности стоят правее него, из растворов солей:
- Железо восстанавливает соединения железа(III):
При повышенном давлении металлическое железо реагирует с оксидом углерода(II) CO, причём образуется жидкий, при обычных условиях легко летучий пентакарбонил железа Fe(CO)5. Известны также карбонилы железа составов Fe2(CO)9 и Fe3(CO)12. Карбонилы железа служат исходными веществами при синтезе железоорганических соединений, в том числе и ферроцена состава (η5-C5H5)2Fe.
Чистое металлическое железо устойчиво в воде и в разбавленных растворах щелочей. Железо не растворяется в холодных концентрированных серной и азотной кислотах из-за пассивации поверхности металла прочной оксидной плёнкой. Горячая концентрированная серная кислота, являясь более сильным окислителем, взаимодействует с железом.
Соединения железа(II)
[править | править код]Оксид железа(II) FeO обладает основными свойствами, ему отвечает основание Fe(OH)2. Соли железа(II) обладают светло-зелёным цветом. При их хранении, особенно во влажном воздухе, они коричневеют за счёт окисления до железа(III). Такой же процесс протекает при хранении водных растворов солей железа(II):
Из солей железа(II) в водных растворах устойчива соль Мора — двойной сульфат аммония и железа(II) (NH4)2Fe(SO4)2·6Н2O.
Реактивом на ионы Fe2+ в растворе может служить гексацианоферрат(III) калия K3[Fe(CN)6] (красная кровяная соль). При взаимодействии ионов Fe2+ и [Fe(CN)6]3− выпадает осадок гексацианоферрата(III) калия-железа(II) (турнбулева синь):
- ,
который внутримолекулярно перегруппировывается в гексацианоферрат(II) калия-железа(III) (берлинская лазурь):
Для количественного определения железа(II) в растворе используют фенантролин Phen, образующий с железом(II) красный комплекс FePhen3 (максимум светопоглощения — 520 нм) в широком диапазоне рН 4–9[42].
Соединения железа(III)
[править | править код]Оксид железа(III) Fe2O3 слабо амфотерен, ему отвечает ещё более слабое, чем Fe(OH)2, основание Fe(OH)3, которое реагирует с кислотами:
Соли Fe3+ склонны к образованию кристаллогидратов. В них ион Fe3+, как правило, окружён шестью молекулами воды. Такие соли имеют розовый или фиолетовый цвет.
Ион Fe3+ полностью гидролизуется даже в кислой среде. При pH>4 этот ион практически полностью осаждается в виде Fe(OH)3[43]:
При частичном гидролизе иона Fe3+ образуются многоядерные оксо- и гидроксокатионы, из-за чего растворы приобретают коричневый цвет.
Кислотные свойства гидроксида железа(III) Fe(OH)3 выражены очень слабо. Он способен реагировать только с концентрированными растворами щелочей:
Образующиеся при этом гидроксокомплексы железа(III) устойчивы только в сильно щелочных растворах. При разбавлении растворов водой они разрушаются, причём в осадок выпадает Fe(OH)3.
При сплавлении со щелочами и оксидами других металлов Fe2O3 образует разнообразные ферриты:
Соединения железа(III) в растворах восстанавливаются металлическим железом:
Железо(III) способно образовывать двойные сульфаты с однозарядными катионами типа квасцов, например, KFe(SO4)2 — железокалиевые квасцы, (NH4)Fe(SO4)2 — железоаммонийные квасцы и т. д.
Для качественного обнаружения в растворе соединений железа(III) используют качественную реакцию ионов Fe3+ с неорганическими тиоцианатами SCN−. При этом образуется смесь ярко-красных роданидных комплексов железа [Fe(SCN)]2+, [Fe(SCN)2]+, Fe(SCN)3, [Fe(SCN)4]−[44]. Состав смеси (а значит, и интенсивность её окраски) зависит от различных факторов, поэтому для точного качественного определения железа этот метод неприменим.
Другим качественным реактивом на ионы Fe3+ служит гексацианоферрат(II) калия K4[Fe(CN)6] (жёлтая кровяная соль). При взаимодействии ионов Fe3+ и [Fe(CN)6]4− выпадает ярко-синий осадок гексацианоферрата(II) калия-железа(III) (берлинская лазурь):
Количественно ионы Fe3+ определяют по образованию красных (в слабокислой среде) или жёлтых (в слабощелочной среде) комплексов с сульфосалициловой кислотой. Эта реакция требует грамотного подбора буферов, так как некоторые анионы (в частности, ацетат) образуют с железом и сульфосалициловой кислотой смешанные комплексы со своими оптическими характеристиками.
Соединения железа(VI)
[править | править код]Ферраты — соли не существующей в свободном виде железной кислоты H2FeO4. Это соединения фиолетового цвета, по окислительным свойствам напоминающие перманганаты, а по растворимости — сульфаты. Получают ферраты при действии газообразного хлора или озона на взвесь Fe(OH)3 в щёлочи[45]:
Ферраты также можно получить электролизом 30%-ного раствора щёлочи на железном аноде:
Ферраты — сильные окислители. В кислой среде разлагаются с выделением кислорода[46]:
Окислительные свойства ферратов используют для обеззараживания воды.
Соединения железа(VII) и железа(VIII)
[править | править код]Известна степень окисления +7 в анионе [FeO4]−[4].
Имеются сообщения об электрохимическом получении соединений железа(VIII)[47][48][49], однако независимых работ, подтверждающих эти результаты, нет.
Получение
[править | править код]В промышленности железо получают из железной руды, в основном из гематита (Fe2O3) и магнетита (FeO·Fe2O3).
Существуют различные способы извлечения железа из руд. Наиболее распространённым является доменный процесс.
Первый этап производства — восстановление железа углеродом в доменной печи при температуре 2000 °C. В доменной печи углерод в виде кокса, железная руда в виде агломерата или окатышей и флюс (например, известняк) подаются сверху, а снизу их встречает поток нагнетаемого горячего воздуха.
В печи углерод в виде кокса окисляется до монооксида углерода. Данный оксид образуется при горении в недостатке кислорода:
В свою очередь, монооксид углерода восстанавливает железо из руды. Чтобы данная реакция шла быстрее, нагретый угарный газ пропускают через оксид железа(III):
Флюс добавляется для избавления от нежелательных примесей (в первую очередь от силикатов; например, кварц) в добываемой руде. Типичный флюс содержит известняк (карбонат кальция) и доломит (карбонат магния). Для устранения других примесей используют другие флюсы.
Действие флюса (в данном случае карбонат кальция) заключается в том, что при его нагревании он разлагается до его оксида:
Оксид кальция соединяется с диоксидом кремния, образуя шлак — метасиликат кальция:
Шлак, в отличие от диоксида кремния, плавится в печи. Более лёгкий, чем железо, шлак плавает на поверхности — это свойство позволяет разделять шлак от металла. Шлак затем может использоваться при строительстве и сельском хозяйстве. Расплав железа, полученный в доменной печи, содержит довольно много углерода (чугун). Кроме таких случаев, когда чугун используется непосредственно, он требует дальнейшей переработки.
Излишки углерода и другие примеси (сера, фосфор) удаляют из чугуна окислением в мартеновских печах или в конвертерах. Электрические печи используются и для выплавки легированных сталей.
Кроме доменного процесса, распространён процесс прямого получения железа. В этом случае предварительно измельчённую руду смешивают с особой глиной, формируя окатыши. Окатыши обжигают, и обрабатывают в шахтной печи горячими продуктами конверсии метана, которые содержат водород. Водород легко восстанавливает железо:
- ,
при этом не происходит загрязнения железа такими примесями, как сера и фосфор, которые являются обычными примесями в каменном угле. Железо получается в твёрдом виде, и в дальнейшем переплавляется в электрических печах.
Химически чистое железо получается электролизом растворов его солей.
Применение
[править | править код]
Железо — один из самых используемых металлов, на него приходится до 95 % мирового металлургического производства.
- Железо является основным компонентом сталей и чугунов — важнейших конструкционных материалов.
- Железо может входить в состав сплавов на основе других металлов — например, никелевых.
- Магнитная окись железа (магнетит) — важный материал в производстве устройств долговременной компьютерной памяти: жёстких дисков, дискет и т. п.
- Уникальные ферромагнитные свойства ряда сплавов на основе железа способствуют их широкому применению в электротехнике для магнитопроводов трансформаторов и электродвигателей.
- Ультрадисперсный порошок магнетита используется во многих чёрно-белых лазерных принтерах в смеси с полимерными гранулами в качестве тонера. Здесь одновременно используется чёрный цвет магнетита и его способность прилипать к намагниченному валику переноса.
- Порошок железа используется как поглотитель кислорода при упаковке некоторых продуктов питания, что помогает продлить их срок хранения.
- Хлорид железа(III) (хлорное железо) используется в радиолюбительской практике для травления печатных плат.
- Семиводный сульфат железа (железный купорос) в смеси с медным купоросом используется для борьбы с вредными грибками в садоводстве и строительстве.
- Железо применяется в качестве анода в железо-никелевых аккумуляторах, железо-воздушных аккумуляторах.
- Водные растворы хлоридов двухвалентного и трёхвалентного железа, а также его сульфатов используются в качестве коагулянтов в процессах очистки природных и сточных вод на водоподготовке промышленных предприятий.
- Порошок железа и чугуна используется в качестве искрообразователя и горючего в пиротехнике[50].
Биологическое значение железа
[править | править код]В живых организмах железо является важным микроэлементом, катализирующим процессы обмена кислородом (дыхания). Основным внутриклеточным депо железа является глобулярный белковый комплекс — ферритин. Недостаток железа проявляется как болезнь организма: хлороз у растений и анемия у животных.
Обычно железо входит в ферменты в виде комплекса, называемого гемом. В частности, этот комплекс присутствует в гемоглобине — важнейшем белке, обеспечивающем транспорт кислорода с кровью ко всем органам человека и животных. Именно он окрашивает кровь в красный цвет.
Комплексы железа, отличные от гема, встречаются, например, в ферменте метан-моноксигеназе, окисляющем метан в метанол, в важном ферменте рибонуклеотид-редуктазе, который участвует в синтезе ДНК. Неорганические соединения железа встречаются в некоторых бактериях, иногда используется ими для связывания азота воздуха.
Железо в организме человека
[править | править код]В организме взрослого человека содержится около 3—4 граммов железа[51] (около 0,005 %), из которых только около 3,5 мг находится в плазме крови. Гемоглобин содержит примерно 68 % всего железа организма, ферритин — 27 %, миоглобин — 4 %, трансферрин — 0,1 %. Источниками железа при биосинтезе железосодержащих белков служат железо, поступающее из пищи, и железо, освобождающееся при постоянном распаде эритроцитов в гепатоцитах (клетках печени) и клетках селезёнки[52].
Суточная потребность человека в железе, по российским данным, следующая[53]: дети — от 4 до 18 мг, взрослые мужчины — 10 мг, взрослые женщины — 18 мг, беременные женщины во второй половине беременности — 33 мг.
У женщин детородного возраста потребность в железе выше ввиду регулярной кровопотери во время менструаций[54][55].
«Национальная академия медицины США» (National Academy of Medicine) различает среднюю потребность в железе и рекомендованное потребление железа, последняя норма разработана с тем, чтоб обеспечивать среднюю потребность для не менее 97 % в каждой группе населения. Расчёт средней потребности в железе зависит от усваиваемости железа, нижеприведённая таблица основана на предположении о потреблении 10 % железа из животных продуктов (средняя усваиваемость 25 %) и 90 % железа из растительных продуктов (средняя усваиваемость 16,8 %), с общей усваиваемостью 18 %. Поскольку рацион детей до года сильно отличается от взрослого, норма для них основана на предполагаемой усваиваемости 10 %[56].
| Пол | Возраст | Рекомендуемая суточная норма потребления железа (по данным «Национальной академии медицины США» (National Academy of Medicine))[56], мг/сутки |
|---|---|---|
| Младенцы | до 6 месяцев | 0,27 |
| Младенцы | 7—12 месяцев | 11 |
| Дети | 1—3 года | 7 |
| Дети | 4—8 лет | 10 |
| Подростки | 9—13 лет | 8 |
| Юноши | 14—18 лет | 11 |
| Девушки | 14—18 лет | 15 |
| Мужчины | 19 лет и старше | 8 |
| Женщины | 19—50 лет | 18 |
| Женщины | 50 лет и старше | 8 |
В организм животных и человека железо поступает с пищей. Наиболее богаты им печень и мясо, в меньшей степени яйца, бобовые (чечевица, фасоль), семена тыквы и кунжута, цельнозерновые крупы (крупа гречневая), а также некоторые виды зелени — тимьян, петрушка, полевой салат[57]. Долгое время список железосодержащих продуктов возглавлял шпинат, ошибочно внесённый из-за опечатки в результатах анализа (был потерян ноль после запятой).
Железо в питании подразделяют на гемовое, или гемное (из мяса и других животных источников) и негемовое (из растительной пищи). В гемсодержащих белках железо находится в составе гема. В негемовых железосодержащих белках железо непосредственно связывается с белком. К таким белкам относят трансферрин, ферритин, окислительные ферменты рибонуклеотидредуктазу и ксантиноксидазу, железофлавопротеины NADH-дегидрогеназа и сукцинатдегидрогеназа[52]. Описанные белки, содержащие негемовое железо, относятся к классу ферредоксинов, наиболее изученные из которых содержатся в хлоропластах зелёных растений и окисляются при переносе электрона в процессе фотосинтеза, а также бактериальные ферредоксины (например анаэробной бактерии Clostridium pasteurianum), участвующие в аэробном или анаэробном переносе электрона. Человеческий ферредоксин-1 участвует в гидроксилировании и расщеплении стероидных гормонов и холестерина в системе микросомальных (эндоплазматического ретикулума гепатоцитов) ферментов цитохрома Р450, а также в синтезе гормонов щитовидной железы. Сердцевина ферредоксина состоит из молекул двух- или четырёх-валентной серы и четырёхвалентного железа и имеет общую формулу вида (например ), она соединена с белковыми остовами через аминокислоту цистеин[58][59].Гемовое железо усваивается наиболее эффективно (от 15 до 35 %). На усвоение негемового железа (даже в животной пище его порядка 60 %[60]) влияют многочисленные факторы[61]. Заметно улучшают усвоение железа потребляемые вместе с пищей аскорбиновая кислота или мясной белок[62]. Препятствуют усвоению железа яйца, кальций, но главным образом антипитательные вещества — фитиновая кислота, оксалаты, танины и кофеин[63].
К примеру, из-за высокого уровня фитиновых соединений усвоение железа из бобовых находится в районе 0,84-0,91 %[56]. Согласно одному из американских исследований, потребление с железосодержащей пищей богатого танинами чая снижает усвоение микроэлемента на 62 %, кофе — на 35 %, а потребление апельсинового сока (с высоким содержанием аскорбиновой кислоты) увеличивает его на 85 %[64]. В то же время данные из Китая указывают на то, что даже очень высокое потребление чая в целом не сказывается на содержании железа в крови[65].
Дефицит железа
[править | править код]
При сбалансированной диете железа, поступающего с пищей, как правило, вполне достаточно. В организме легко восстанавливается равновесие между поступлением и выведением железа, и временный дефицит его легко восполняется за счёт имеющихся запасов. И, тем не менее, дефицит железа — обычное явление в развивающихся странах с ограниченной доступностью мясных продуктов. Это самое распространённое на Земле нарушение питания, которому подвержены до 2 млрд человек во всём мире[66].
В некоторых специальных случаях (анемия, а также при донорстве крови) необходимо применять железосодержащие препараты и пищевые добавки (гематоген, ферроплекс). Потребность в железе значительно возрастает при анемии, вызванной, например, такими паразитарными инвазиями, как малярия и анкилостомоз, которые очень широко распространены в тропических странах.
Вегетарианцам советуют принимать примерно в 1,8 раза больше железа, чем не вегетарианцам[67]. В западных странах продукты, ориентированные на веганов, часто обогащают железом, хотя усваиваемость солей железа (железосодержащих препаратов) зачастую проблематична и польза от приёма таких добавок здоровыми людьми не доказана[68]. Известно, что организм вегетарианцев приспосабливается к диете и более эффективно удерживает имеющиеся запасы железа[69].
По результатам ряда исследований, за время приготовления в железной и чугунной посуде содержание железа в пище возрастает в от 1,2 до 21 раза [70][71][72]. При этом содержание железа сильнее возрастает в соусах или еде, приготовленной в соусе (например, чили).
В то время, как некоторые исследователи считают, что кормление грудью приводит к дефициту железа, есть множество исследований, показывающих, что это не так, и дети, которых кормят грудью, усваивают железо намного лучше.
Переизбыток железа
[править | править код]Избыточное железо может попадать в организм городского жителя вместе с ржавой водой из-под крана (по чугунным трубам). Также использование железной и чугунной посуды в приготовлении пищи повышает содержание в ней железа[70].
Содержание железа в воде превышающее 1—2 мг/л значительно ухудшает её органолептические свойства, придавая ей неприятный вяжущий вкус, и делает воду малопригодной для использования, вызывает у человека аллергические реакции[73], может стать причиной болезни крови и печени — гемохроматоза. ПДК железа в воде 0,3 мг/л.
Избыточное накопление железа в организме оказывает токсическое действие. Передозировка железа стимулирует выработку свободных радикалов, угнетает антиоксидантную систему организма и, вероятно, способствует развитию атеросклероза[74], поэтому употреблять препараты железа здоровым людям не рекомендуется.
Примечания
[править | править код]- ↑ Michael E. Wieser, Norman Holden, Tyler B. Coplen, John K. Böhlke, Michael Berglund, Willi A. Brand, Paul De Bièvre, Manfred Gröning, Robert D. Loss, Juris Meija, Takafumi Hirata, Thomas Prohaska, Ronny Schoenberg, Glenda O’Connor, Thomas Walczyk, Shige Yoneda, Xiang‑Kun Zhu. Atomic weights of the elements 2011 (IUPAC Technical Report) (англ.) // Pure and Applied Chemistry. — 2013. — Vol. 85, no. 5. — P. 1047—1078. — ISSN 0033-4545. — doi:10.1351/PAC-REP-13-03-02. Архивировано 5 февраля 2014 года.
- ↑ 1 2 3 Л. Ю. Аликберова; С. В. Кузьминых, В. А. Попов (исторические сведения). Железо. Большая российская энциклопедия 2004-2017. Научное издательство "Большая Российская энциклопедия". Дата обращения: 12 февраля 2023. Архивировано 12 февраля 2023 года.
- ↑ 1 2 3 Коллектив авторов. Химическая энциклопедия в 5 томах. Том 2 / И.Л.Кнунянц - главный редактор. — М.: Советская энциклопедия, 1990. — С. 270. — 671 с. — ISBN 5-85270-008-8.
- ↑ 1 2 Jun-Bo Lu, Jiwen Jian, Wei Huang, Hailu Lin, Jun Li. Experimental and theoretical identification of the Fe(vii) oxidation state in FeO4− (англ.) // Phys. Chem. Chem. Phys.. — 2016-11-16. — Vol. 18, iss. 45. — P. 31125—31131. — ISSN 1463-9084. — doi:10.1039/c6cp06753k.
- ↑ Химическая энциклопедия: в 5 тт. / Редкол.: Кнунянц И. Л. (гл. ред.). — М.: Советская энциклопедия, 1990. — Т. 2. — С. 140. — 671 с. — 100 000 экз.
- ↑ Карапетьянц М. Х., Дракин С. И. Общая и неорганическая химия: Учебник для вузов. — 4-е изд., стер. — М.: Химия, 2000, ISBN 5-7245-1130-4, с. 529
- ↑ Иванов В. В., Шанский Н. М., Шанская Т. В., Краткий этимологический словарь русского языка, издание 2-е, испр. и доп., М. Просвещение, 1971, 542 стр.
- ↑ М. Фасмер. Этимологический словарь русского языка. — Прогресс. — 1986. — Т. 2. — С. 42—43.
- ↑ Трубачёв О. Н. Славянские этимологии. // Вопросы славянского языкознания, № 2, 1957.
- ↑ Boryś W. Słownik etymologiczny języka polskiego. — Kraków: Wydawnictwo Literackie. — 2005. — С. 753—754.
- ↑ Walde A. Lateinisches etymologisches Wörterbuch. — Carl Winter’s Universitätsbuchhandlung. — 1906. — С. 285.
- ↑ Мейе А. Основные особенности германской группы языков. — УРСС. — 2010. — С. 141.
- ↑ Matasović R. Etymological Dictionary of Proto-Celtic. — Brill. — 2009. — С. 172.
- ↑ Mallory, J. P., Adams, D. Q. Encyclopedia of Indo-European Culture. — Fitzroy-Dearborn. — 1997. — P. 314.
- ↑ Бахарева А. Древние египтяне назвали небо железной миской с водой. Архивная копия от 16 января 2021 на Wayback Machine
- ↑ Русакова E. Железо с неба. Архивная копия от 17 января 2021 на Wayback Machine
- ↑ Граков Б. Н. Ранний железный век. М.: Изд-во МГУ, 1977. С.16.
- ↑ Гиоргадзе Г. Г. «Текст Анитты» и некоторые вопросы ранней истории хеттов Архивная копия от 30 ноября 2007 на Wayback Machine // Вестник древней истории. 1965. № 4.
- ↑ Граков Б. Н. Ранний железный век. М.: Изд-во МГУ, 1977. С.16.; Кларк Г. Доисторическая Европа. Пер. M. Б. Граковой-Свиридовой. М. 1953. С. 201—203.; Дикшит С. К. Введение в археологию. М., 1960. С. 428—430.
- ↑ Менабде Э. А. Хеттское общество. Тбилиси, 1965. С. 67.; Арешян Г. Е. Железо в культуре древней Передней Азии и бассейна Эгейского моря (по данным письменных источников) Архивная копия от 2 июля 2021 на Wayback Machine // «Советская археология», 1976, № 1. С.90.
- ↑ Второзаконие III, 3,7,10,11.; Арешян Г. Е. Железо в культуре древней Передней Азии и бассейна Эгейского моря (по данным письменных источников)] // «Советская археология», 1976, № 1. С.95.
- ↑ Гомер. Илиада, песня 23.
- ↑ Давно ли люди гибнут за металл и как именно закаля (Ольга Листопад) / Проза.ру. proza.ru. Дата обращения: 26 сентября 2021. Архивировано 26 сентября 2021 года.
- ↑ Карл Бакс. Богатства земных недр. М.: Прогресс, 1986, стр. 244, глава «Железо»
- ↑ New Measurement of the 60Fe Half-Life (англ.) // Physical Review Letters : journal. — Vol. 103. — P. 72502. — doi:10.1103/PhysRevLett.103.072502.
- ↑ Audi G., Bersillon O., Blachot J., Wapstra A. H. The NUBASE evaluation of nuclear and decay properties // Nuclear Physics A. — 2003. — Т. 729. — С. 3—128. — doi:10.1016/j.nuclphysa.2003.11.001. — .

- ↑ Ю. М. Широков, Н. П. Юдин. Ядерная физика. М.: Наука, 1972. Глава Ядерная космофизика.
- ↑ Антон Бирюков. Недостающая часть элементов «железного пика» синтезируется во взрывах очень плотных белых карликов. «Элементы» (23 июля 2021). Дата обращения: 30 сентября 2024.
- ↑ Аркадий Курамшин. Тяжелые элементы попали в Солнечную систему из слившихся за 80 млн лет до ее образования нейтронных звезд. «Элементы» (24 мая 2019). Дата обращения: 30 сентября 2024.
- ↑ Рипан Р., И. Четяну. Неорганическая химия // Химия неметаллов = Chimia metalelor. — М.: Мир, 1972. — Т. 2. — С. 482—483. — 871 с.
- ↑ Gold and Precious Metals. Дата обращения: 25 августа 2011. Архивировано 20 августа 2011 года.
- ↑ Will Evo stick? Mines and Communities Website. Дата обращения: 29 марта 2008. Архивировано из оригинала 15 августа 2007 года.
- ↑ Iron Ore. U.S. Geological Survey Mineral Resources Program. Дата обращения: 20 октября 2006. Архивировано 2 января 2023 года.
- ↑ Modest global growth for iron ore production — report — MINING.COM. Дата обращения: 9 марта 2020. Архивировано 15 февраля 2020 года.
- ↑ Цена железной руды выросла до максимума за 5 лет. Кто от этого выиграет? :: Новости :: РБК Инвестиции. Дата обращения: 9 марта 2020. Архивировано 31 октября 2019 года.
- ↑ Металловедение и термическая обработка стали. Справ. изд. В 3-х т./ Под ред. М. Л. Берштейна, А. Г. Рахштадта. — 4-е изд., перераб. и доп. Т. 2. Основы термической обработки. В 2-х кн. Кн. 1. М.: Металлургия, 1995. 336 с.
- ↑ T. Takahashi & W.A. Bassett, «High-Pressure Polymorph of Iron», Science, Vol. 145 #3631, 31 Jul 1964, p 483—486. doi:10.1126/science.145.3631.483. .
- ↑ В виде стружки или проволоки
- ↑ Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
- ↑ Аликберова Л.Ю. Железа оксиды // Большая Российская энциклопедия / Председатель Науч.-ред. совета Ю. С. Осипов. Отв. ред. С. Л. Кравец. — М.: Большая Российская энциклопедия, 2007. — Т. 9. Динамика атмосферы — Железнодорожный узел. — С. 747.
- ↑ Горение железа в кислороде Архивная копия от 6 октября 2014 на Wayback Machine — видеоопыт в Единой коллекции цифровых образовательных ресурсов
- ↑ Schilt A. Analytical Application of 1,10-phenantroline and Related Compounds. Oxford, Pergamon Press, 1969.
- ↑ Лурье Ю. Ю. Справочник по аналитической химии. М., Химия, 1989. С. 297.
- ↑ Лурье Ю. Ю. Справочник по аналитической химии. М., Химия, 1989, С. 315.
- ↑ Брауэр Г. (ред.) Руководство по неорганическому синтезу. т. 5. М., Мир, 1985. С. 1757—1757.
- ↑ Реми Г. Курс неорганической химии. т. 2. М., Мир, 1966. С. 309.
- ↑ Киселёв Ю. М., Копелев Н. С., Спицын В. И., Мартыненко Л. И. Восьмивалентное железо // Докл. АН СССР. — 1987. — Т. 292. — С. 628—631.
- ↑ Перфильев Ю. Д., Копелев Н. С., Киселёв Ю. М., Спицын В. И. Мёссбауэровское исследование восьмивалентного железа // Докл. АН СССР. — 1987. — T. 296. — С. 1406—1409.
- ↑ Kopelev N.S., Kiselev Yu.M., Perfiliev Yu.D. Mossbauer spectroscopy of the oxocomplexes iron in higher oxidation states (недоступная ссылка) // J. Radioanal. Nucl. Chem. — 1992. — V. 157. — Р. 401—411.
- ↑ А. В. Чувурин. Занимательная пиротехника (2003) [страница не указана 1707 дней]
- ↑ Iron, Nature's Universal Element: Why People Need Iron & Animals Make Magnets. — С. 100. — 204 с. — ISBN 0-8135-2831-3.
- ↑ 1 2 Е. С. Северин. Биохимия. Учебник для ВУЗов. — 2003. — С. 641. — 779 с. — ISBN 5-9231-0254-4. Архивировано 25 июня 2013 года. Архивированная копия. Дата обращения: 3 августа 2014. Архивировано 25 июня 2013 года.
- ↑ «Нормы физиологических потребностей в энергии и пищевых веществах для различных групп населения Российской Федерации» (МР 2.3.1.2432—08). Архивная копия от 6 августа 2017 на Wayback Machine // rospotrebnadzor.ru (9 ноября 2015 года)
- ↑ Jo Lewin. Spotlight on… high-iron. — Are you getting enough iron? Jo Lewin explains when you should eat a high-iron diet, and which foods can help ensure you get your daily dose. Архивная копия от 5 июля 2014 на Wayback Machine (англ.) // bbcgoodfood.com
- ↑ Анастасия Каадзе. Железо: микроэлемент с высоким приоритетом важности. Архивная копия от 22 января 2021 на Wayback Machine Официальный сайт газеты «Комсомольская правда» // kp.ru (31 мая 2017 года)
- ↑ 1 2 3 Gregory J. Anderson, Gordon D. McLaren. Iron Physiology and Pathophysiology in Humans (Springer, 2012, pages 88-90). Архивная копия от 18 апреля 2017 на Wayback Machine (англ.) // books.google.com — ISBN 1-60327-484-7
- ↑ Foods highest in Iron. Дата обращения: 22 июня 2014. Архивировано 6 июля 2014 года.
- ↑ Д. Г. Кнорре, С. Д. Мызина. «Биологическая химия». — Москва: «Высшая школа», 2003. — С. 66. — 479 с. — ISBN 5-06-003720-7.
- ↑ И. В. Довжикова. Ферменты стероидогенеза (обзор литературы). Дальневосточный научный центр физиологии и патологии дыхания Сибирского отделения РАМН, Благовещенск. Бюллетень, выпуск № 37, 2010; УДК 577.175.63/.64:577.152.1. Архивная копия от 25 декабря 2015 на Wayback Machine // cyberleninka.ru
- ↑ Iron in the Vegan Diet. Архивная копия от 29 мая 2014 на Wayback Machine The Vegetarian Resource Group // vrg.org
- ↑ Review on iron and its importance for human health. Архивная копия от 9 апреля 2019 на Wayback Machine // ncbi.nlm.nih.gov
- ↑ [1]Архивная копия от 4 ноября 2017 на Wayback Machine Enhancers of iron absorption: ascorbic … [Int J Vitam Nutr Res. 2004] — PubMed — NCBI. // ncbi.nlm.nih.gov
- ↑ [2]Архивная копия от 23 июля 2018 на Wayback Machine Meat and ascorbic acid can promote Fe avai… [J Agric Food Chem. 2005] — PubMed — NCBI
- ↑ [3]Архивная копия от 19 февраля 2018 на Wayback Machine Effect of different drinks on the absorpt… [Hum Nutr Appl Nutr. 1982] — PubMed — NCBI
- ↑ [4]Архивная копия от 17 февраля 2018 на Wayback Machine Iron status of middle-aged women in five cou… [Eur J Clin Nutr. 1999] — PubMed — NCBI
- ↑ Micronutrient deficiencies. WHO. Дата обращения: 22 июня 2014. Архивировано из оригинала 13 июля 2017 года.
- ↑ Institute of Medicine, Food and Nutrition Board. Dietary Reference Intakes for Vitamin A, Vitamin K, Arsenic, Boron, Chromium, Copper, Iodine, Iron, Manganese, Molybdenum, Nickel, Silicon, Vanadium, and Zinc. Washington, DC: National Academy Press, 2001.
- ↑ Bioavailability of iron, zinc, and other trace minerals from vegetarian diets. Дата обращения: 22 июня 2014. Архивировано 16 января 2015 года.
- ↑ [5]Архивная копия от 17 октября 2016 на Wayback Machine Nonheme-iron absorption, fecal ferritin excre… [Am J Clin Nutr. 1999] — PubMed — NCBI
- ↑ 1 2 Andrew Weil, M.D. Cooking with Cast-Iron? (англ.). drweil.com (21 марта 2006). Дата обращения: 22 апреля 2018. Архивировано 22 апреля 2018 года.
- ↑ Результаты исследования влияния железной посуды на содержание железа в приготовленной в них пище, опубликованные в журнале Journal of the American Dietetic Association в выпуске от июля 1986 года. Таблица результатов доступна на: Linda Stradley. Iron and Carcinogens in Cast Iron (англ.). What's Cooking America (12 января 2005). Дата обращения: 11 октября 2014. Архивировано 1 октября 2014 года.
- ↑ Geerligs PD1, Brabin BJ, Omari AA. Food prepared in iron cooking pots as an intervention for reducing iron deficiency anaemia in developing countries: a systematic review. (англ.). Journal of human nutrition and dietetics : the official journal of the British Dietetic Association. The National Center for Biotechnology Information (8 января 2003). Дата обращения: 11 октября 2014. Архивировано 15 октября 2014 года.
- ↑ М.Д. Конев. Содержание железа в воде, его влияние на организм и способы удаления // Экономика и социум. — 2018. — № 5 (48). — С. 590–596.
- ↑ [6]Архивная копия от 25 декабря 2015 на Wayback Machine Iron overload augments the dev… [Arterioscler Thromb Vasc Biol. 1995] — PubMed — NCBI
Литература
[править | править код]- Железо, в технике // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- Железо, в химии // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- Железо, в медицине // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- Железо в Популярной библиотеке химических элементов.
- Климент Александрийский. «Строматы», глава 21.
- Абрамишвили Р. М. К вопросу об освоении железа на территории Восточной Грузии, ВГМГ, XXII-В, 1961.
- Арешян Г. Е. Железо в культуре древней передней Азии и бассейна Эгейского моря. М., 1976.
- Бакс К. Богатства земных недр. М.: Прогресс, 1986. 384 стр. Глава «Железо».
- Гиоргадзе Г. Г. «Текст Анитты» и некоторые вопросы ранней истории хеттов.
- Граков Б. Н. Ранний железный век. М.: Изд-во МГУ, 1977. 235 с.
- Татарченко Д.М. Металлургия чугуна, железа и стали в общедоступном изложении. — Государственное научно-техническое издательство, 1932.
- Хахутайшвили Д. А. К истории древнеколхской металлургии железа. Вопросы древней истории (Кавказско-ближневосточный сборник, вып. 4). Тбилиси, 1973.





















![{\displaystyle {\mathsf {K_{3}[Fe(CN)_{6}]+Fe^{2+}\rightarrow KFe^{II}[Fe^{III}(CN)_{6}]\downarrow +2K^{+}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a9b81a87fef766fae5e65b6c26babb38901c482a)
![{\displaystyle {\mathsf {KFe^{II}[Fe^{III}(CN)_{6}]\rightarrow KFe^{III}[Fe^{II}(CN)_{6}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/cd5754f2157be00c80a1ea3c3212d55a5fbb6178)


![{\displaystyle {\mathsf {Fe(OH)_{3}+3KOH\rightarrow K_{3}[Fe(OH)_{6}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a9970e88e8b33b0aec36c52ffd5aed803d95e468)
![{\displaystyle {\mathsf {K_{4}[Fe(CN)_{6}]+FeCl_{3}\rightarrow KFe^{III}[Fe^{II}(CN)_{6}]\downarrow +3KCl}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b02f4ca8c591e27abb75156eea3756341065a8f3)









