Реакция Поварова (Jygtenx Hkfgjkfg)
Реакция По́варова - трёхкомпонентная реакция ароматических аминов, альдегидов и алкенов (или алкинов), приводящая к образованию тетрагидрохинолинов или хинолинов. Формально является [4+2]-циклоприсоединением ароматических оснований Шиффа к электронообогащенным алкенам при катализе кислотами Льюиса или Брёнстеда.
Исторические сведения
[править | править код]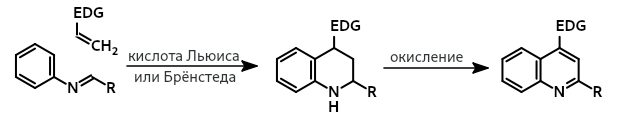
Открыта советским химиком-органиком Леонардом Сергеевичем Поваровым в 1962 году.
Л.С. Поваров и сотрудники нашли, что основания Шиффа в присутствии фтористого бора легко реагируют с винилалкиловыми эфирами, образуя аддукты по схеме диенового синтеза. Так, в реакции основания Шиффа, полученного из анилина и бензальдегида, с винилэтилсульфидом в результате отщепления этилмеркаптана был получен 2-фенилхинолин; с этоксиацетиленом – 2-фенил-4-этоксихинолин; с кетеном – 2-фенил-2,3-дигидрохинолин-4-он[1][2].
В дальнейшем было показано, что в качестве диенофилов в реакции с шиффовыми основаниями могут быть использованы и циклические эфиры — 2-метил-4,5-дигидрофуран и дигидропиран, циклогексенилэтиловый эфир. В качестве диенов были использованы основания Шиффа, содержащие различные заместители. Установлено, что анилы неароматических альдегидов также способны участвовать в реакции. Так, например, были получены аддукты с анилами α,β-непредельных альдегидов – коричного альдегида, цитраля, а также циклогексанона[3].
В настоящее время наиболее широко используется трёхкомпонентный вариант реакции Поварова, в котором основание Шиффа образуется из амина и альдегида и без выделения вступает в реакцию с электроноизбыточным алкеном. Трёхкомпонентный вариант реакции часто используется, если необходимо ввести в реакцию нестойкие имины, например, полученные из анилинов и алифатических альдегидов. В некоторых случаях тетрагидрохинолины окисляются до соответствующего хинолина кислородом воздуха.
Механизм реакции
[править | править код]Поваров с соавторами считали, что реакция ароматических оснований Шиффа с активированными олефинами протекает как сопряжённое [4+2]-циклоприсоединение. Однако в работах последующих лет[4][5] были получены многочисленные экспериментальные доказательства того, что катализируемая кислотами Льюиса или Брёнстеда конденсация ароматических оснований Шиффа с такими олефинами протекает по ступенчатому механизму. Таким образом, реакция Поварова лишь формально соответствует схеме циклоприсоединения по Дильсу-Альдеру[6].

С целью доказательства протекания реакции Поварова по ступенчатому механизму был осуществлен "перехват" ионных интермедиатов с помощью введённых в реакционную среду нуклеофилов, например метанола. Продукты перехвата были выделены и охарактеризованы[7].
Однако, ступенчатый механизм не объясняет образования единственного стереоизомера в реакциях с дигидрофураном и дигидропираном[8].
Механизм реакции Поварова также исследовался методами квантовой химии[9].
Синтетический потенциал
[править | править код]В классическом варианте реакции, когда приготовленный заранее имин вводят в реакцию с олефином, могут быть использованы различные бензилиденанилины, содержащие заместители как в остатке анилина, так и в бензольном кольце ароматического альдегида. Имины, полученные из неароматических альдегидов тоже способны вступать в реакцию Поварова; имины из алкиларилкетонов не вступают в эту реакцию.
Помимо виниловых эфиров, в реакцию с основаниями Шиффа можно вводить циклические виниловые эфиры (2,3-дигидропиран, 2,3-дигидрофуран и т.п.) и алкоксиацетилены.
Наиболее предпочтительным растворителем для проведения реакции Поварова является ацетонитрил, хотя могут быть использованы тетрагидрофуран, толуол, бензол, дихлорметан, трифторэтанол, гексафторизопропанол и другие растворители, а также ионные жидкости. В ряде случаев возможно проведение реакции в воде.
В качестве катализаторов используются кислоты Льюиса BF3·Et2O, ZnCl2, AlCl3, SnCl4, TiCl4 в свободном виде и в виде комплексов с хиральными спиртами, SmI2, FeCl3, InCl3, BiCl3, SbCl3 и другие, а также кислоты Брёнстеда KHSO4, CF3COOH, H2NSO3H и др., а также трифлаты лантаноидов.
Окислителями могут служить кислород воздуха, DDQ, сера, Mn(OAc)3 и другие.
Реакция Поварова, благодаря широкому синтетическому потенциалу, удобна для создания библиотек соединений методами комбинаторной химии. Например, в 2012 году с её использованием была создана библиотека из 2328 2,3,4-замещенных тетрагидрохинолинов.[10]
Четырехкомпонентный вариант реакции Поварова
[править | править код]В то время, как в традиционном варианте проведения реакции Поварова интермедиатный карбокатион вступает во внутримолекулярную реакцию с арильной группой, в четырёхкомпонентном варианте перехват нуклеофила используется как заключительная стадия в домино-конденсации. Циклизация в этом случае не происходит. Вариант такой реакции с этиловым эфиром глиоксиловой кислоты, 3,4-дигидро-4Н-пираном, анилином и этанолом с использованием трифлата скандия в качестве кислоты Льюиса и молекулярных сит приведён на схеме ниже[6]:

Асимметрический вариант реакции Поварова
[править | править код]Интерес к тетрагидрохинолинам как ключевому структурному фрагменту биоактивных, в том числе и природных, соединений требует развития методов синтеза оптически чистых веществ. Хотя реакция Поварова известна уже более 60 лет, разработки возможностей проведения её асимметрического варианта начались относительно недавно, и к настоящему моменту общего подхода не существует.[11]
В 1994 году была опубликована первая статья об асимметрическом варианте реакции Поварова, в которой хиральный комплекс, образованный трифлатом иттербия, (R)-БИНОЛом и ДБУ проявил каталитическую активность в реакциях орто-гидроксиарилиминов и различных диенофилов и привел к продукту реакции Поварова с высокой стереоселективностью.[12]

Впоследствии были опубликованы работы по асимметрическому катализу реакции Поварова другими хиральными кислотами Льюиса и Брёнстеда, а также хиральными производными мочевины. Структуры некоторых катализаторов, используемых для проведения этой реакции, изображены ниже.[13]

Внутримолекулярная реакция Поварова
[править | править код]Реакция Поварова может быть проведена во внутримолекулярном варианте, когда в молекуле исходного карбонильного соединения или амина изначально присутствет электрообогащенная двойная (С=C) или тройная (C≡C) связь в положении, которое пространственно обеспечивает возможность её дальнейшего внутримолекулярного взаимодействия с образующимся на первой стадии иминным фрагментом, что ведет к получению соответствующих тетрагидрохинолинов или хинолинов с дополнительным коденсированным циклическим фргаментом[14]:

Окса-реакция Поварова
[править | править код]В 2013 г. был опубликован вариант реакции Поварова, в котором исходным веществом вместо основания Шиффа выступали ацетали, полученные восстановлением различных фенилпиколинатов гидридом диизобутилалюминия (DIBAL) и последующим ацилированием. Было продемонстрировано, что эти соединения способны вступать в реакцию с алкенами и образовывать соответствующие хроманы. В качестве алкенов использовались стирол, циклопентен, циклогексен, норборнен. Получить продукты реакции Поварова с очень электроноизбыточными алкенами, такими как алкилвиниловые эфиры или дигидрофуран, в данном случае не удалось.[15]

Механизм этой реакции также исследовался квантовохимическими методами.[16]
Модификация Катрицкого
[править | править код]В модификации Катрицкого на первой стадии конденсацию ароматического амина с альдегидом проводят в присутствии бензотриазола, который присоединяется по двойной связи имина. Образующийся при этом аминаль (или смесь аминалей, получившихся в результате атаки N1 и N2 атомов бензотриазола[17]) может быть выделен и далее на второй стадии введен в реакцию с алкеном, который замещает бензотриазольный фрагмент и образует далее шестичленный цикл по стандартному механизму [18]. Этот приём был использован в синтезе препарата для лечения гиперхолестеринемии торцетрапиба[англ.].

Примеры применения
[править | править код]Синтетические возможности реакции Поварова можно оценить с помощью следующих примеров:

Обзоры
[править | править код]1. В.A. Глушков, А.Г. Толстиков. Синтез замещенных 1,2,3,4-тетрагидрохинолинов с использованием реакции Поварова. Новые возможности классической реакции. Успехи химии. Том 77, вып. 2, 2008, 138-160. https://www.uspkhim.ru/php/getFT.phtml?paperid=3749
2. Kouznetsov, V.V. Recent synthetic developments in a powerful imino Diels–Alder reaction (Povarov reaction): application to the synthesis of N-polyheterocycles and related alkaloids. Tetrahedron, 2009, 65, 2721–2750. https://doi.org/10.1016/j.tet.2008.12.059
3. Buonora, P., Olsen, J.-C., Oh, T. (2001) Recent Developments in Imino Diels-Alder Reactions. Tetrahedron, 57, 6099-6138. https://doi.org/10.1016/S0040-4020(01)00438-0
4. Forero, J.S.B., Junior, J.J., Da Silva, F.M. The Povarov Reaction as a Versatile Strategy for the Preparation of 1,2,3,4-Tetrahydroquinoline Derivatives: An Overview. Current Organic Synthesis, 2016, 13, 157-175. http://dx.doi.org/10.2174/1570179412666150706183906
5. Лиманцева Р. М. Стереоселективный синтез и биологическая активность циклопентен аннелированных полициклов с тетрагидрохинолиновым фрагментом: дисс. ... канд. хим. наук: 1.4.3. - Институт нефтехимии и катализа ИНК УФИЦ РАН. Уфа, 2022. 131 с. https://rusoil.net/sites/default/files/2022-09/LimantsevaRM-diss.pdf
См. также
[править | править код]Примечания
[править | править код]- ↑ Поваров Л. С., Григос В.И., Михайлов Б.М. Реакции бензилиденанилина с некоторыми ненасыщенными соединениями // Изв. АН СССР, сер. хим : журнал. — 1963. — С. 2039—2041.
- ↑ Поваров Л. С., Михайлов Б. М. Новый тип реакций диеновой конденсации // Изв. АН СССР, сер. хим.. — 1963. — С. 955—956.
- ↑ Поваров Л. С. а,β-Ненасыщенные эфиры и их аналоги в реакциях диенового синтеза // Успехи химии : журнал. — 1967. — Т. 36, № 9. — С. 1533—1562.
- ↑ Alves MJ, Azoia NG, Fortes AG (2007). "Regio- and stereo-selective aza-Diels–Alder reaction of ethyl glyoxylate 4-methoxyphenylimine with 1,3-dienes in the presence of BF3·Et2O. Evidence for a non-concerted mechanism". Tetrahedron. 63 (3): 727—734. doi:10.1016/j.tet.2006.10.085.
{{cite journal}}: Недопустимый|display-authors=3(справка) - ↑ Sridharan V, Avendaño C, Menéndez JC (2007). "CAN-catalyzed three-component reaction between anilines and alkyl vinyl ethers: stereoselective synthesis of 2-methyl-1,2,3,4-tetrahydroquinolines and studies on their aromatization". Tetrahedron. 63 (3): 673—681. doi:10.1016/j.tet.2006.11.002.
{{cite journal}}: Недопустимый|display-authors=3(справка) - ↑ 1 2 Jiménez O, de la Rosa G, Lavilla R (2005). "Straightforward Access to a Structurally Diverse Set of Oxacyclic Scaffolds through a Four-Component Reaction". Angewandte Chemie International Edition. 44 (40): 6521—6525. doi:10.1002/anie.200501548.
{{cite journal}}: Недопустимый|display-authors=3(справка) - ↑ Orru RV, de Greef M (2003). "Recent Advances in Solution-Phase Multicomponent Methodology for the Synthesis of Heterocyclic Compounds". Synthesis. 2003 (10): 1471—1499. doi:10.1055/s-2003-40507.
{{cite journal}}: Недопустимый|display-authors=2(справка) - ↑ Lucchini V, Prato M, Scorrano G, Stivanello M, Valle G (1992). "Acid-catalysed addition of N-aryl imines to dihydrofuran. Postulated dependence of the reaction mechanism on the relative face of approach of reactants". J. Chem. Soc. Perkin Trans. 2: 259—266. doi:10.1039/P29920000259.
{{cite journal}}: Недопустимый|display-authors=5(справка) - ↑ Domingo LR, Aurell MJ, Sáez JA, Mekelleche SM (2014). "Understanding the mechanism of the Povarov reaction. A DFT study". RSC Advances. 4: 25268—25278. doi:10.1039/c4ra02916j.
{{cite journal}}: Недопустимый|display-authors=4(справка) - ↑ Gerard B, O'Shea MW, Donckele E, et al. (2012). "Application of a catalytic asymmetric Povarov reaction using chiral ureas to the synthesis of a tetrahyroquinoline library". ACS Comb. Sci. 14 (11): 621—630. doi:10.1021/co300098v.
- ↑ Bianchini, Giulia (2018). Desarrollo y aplicaciones de la reacción de Povarov aza-viníloga de α-cetoiminas (PDF) (DSc thesis). Universidad Complutense de Madrid. Архивировано (PDF) 16 июня 2023. Дата обращения: 16 июня 2023.
- ↑ Kobayashi S, Ishitani H, Hachiya I, Araki M (1994). "Asymmetric Diels-Alder reactions catalyzed by chiral lanthanide(III) trifluoromethanesulfonates. Unique structure of the triflate and stereoselective synthesis of both enantiomers using a single chiral source and a choice of achiral ligands". Tetrahedron. 50 (40): 11623—11636. doi:10.1016/S0040-4020(01)85657-X.
{{cite journal}}: Недопустимый|display-authors=4(справка) - ↑ Fochi M, Caruana L, Bernardi L (2014). "Catalytic Asymmetric Aza-Diels–Alder Reactions: The Povarov Cycloaddition Reaction". Synthesis. 46 (02): 135—157. doi:10.1055/s-0033-1338581.
{{cite journal}}: Недопустимый|display-authors=3(справка) - ↑ Zhang YQ, Zhang YP, Zheng YX, Li ZY, Ye LW (2021). "Rapid and practical access to diverse quindolines by catalyst-free and regioselectivity-reversed Povarov reaction". Cell Reports Physical Science 2: 100448. doi:10.1016/j.xcrp.2021.100448.
{{cite journal}}: Недопустимый|display-authors=5(справка) - ↑ Taylor RR, Batey RA (2013). "A Hetero Diels−Alder Approach to the Synthesis of Chromans (3,4-Dihydrobenzopyrans) Using Oxonium Ion Chemistry: The Oxa-Povarov Reaction". The Journal of Organic Chemistry. 78: 1404−1420. doi:10.1021/jo302328s.
{{cite journal}}: Недопустимый|display-authors=2(справка) - ↑ Domingo LR, Aurell MJ, Pérez P (2014). "The mechanism of ionic Diels–Alder reactions. A DFT study of the oxa-Povarov reaction". RSC Advances. 4: 16567−16577. doi:10.1039/c3ra47805j.
{{cite journal}}: Недопустимый|display-authors=3(справка) - ↑ Katritzky AR, Rachwal B, Rachwal S (1995). "Reactions of Alkyl-N-phenyl-1H-benzotriazole-1-methanamines with α,β-Unsaturated Ethers. A Novel Route to 1,4- and 1,3-Disubstituted 1,2,3,4-Tetrahydroquinolines". Journal of Organic Chemistry. 60: 2588—2596. doi:10.1021/jo00113a043.
{{cite journal}}: Недопустимый|display-authors=3(справка) - ↑ Katrizky AR, Belyakov SA (1998). "Benzotriazole-Based Intermediates: Reagents for Efficient Organic Synthesis" (PDF). Aldrichimica Acta. 31: 35—45. Архивировано (PDF) 14 января 2023. Дата обращения: 13 июня 2023.
{{cite journal}}: Недопустимый|display-authors=2(справка)