Рак почки (Jgt hkctn)
| Рак почки | |
|---|---|
 Микрофотография, демонстрирующая наиболее частый тип рака почки — светлоклеточный (окраска гематоксилином и эозином) | |
| МКБ-11 | 2C90 |
| МКБ-10 | C64-C65 |
| МКБ-10-КМ | C64 |
| МКБ-9 | 189.0 |
| МКБ-9-КМ | 189.0[1][2] |
| МКБ-О | M8312/3 |
| OMIM | 144700 |
| DiseasesDB | 11245 |
| MedlinePlus | 000516 |
| eMedicine | med/2002 |
Рак по́чки — злокачественная опухоль почки, которая чаще всего представляет собой карциному и развивается либо из эпителия проксимальных канальцев и собирательных трубочек[англ.] (почечноклеточный рак, ПКР), либо из эпителия чашечно-лоханочной системы (переходноклеточный рак[3]; либо, в некоторых случаях, плоскоклеточный рак[англ.] [4]).
Почечноклеточный рак представляет собой ведущую разновидность злокачественных опухолей, локализующихся в почке (хотя метастазы почечноклеточного рака могут поражать другие органы). У взрослых доля почечноклеточного рака среди первичных злокачественных опухолей почки составляет 80—85 %[5]. По другим сведениям, на почечно-клеточный рак приходится примерно 90 % всех злокачественных опухолей почки[6].
История изучения
[править | править код]Первое описание расположенной в почке раковой опухоли дал немецкий врач Даниил Зеннерт, который практиковал в Виттенберге и поместил это описание в своей книге Practicae Medicinae (опубликована в 1613 году)[7]. Однако признание современников получило лишь описание, данное французским врачом Г. Мирилом, который в 1810 году описал[8] случай заболевания раком почки, выявленного у 35-летней беременной женщины Франсуазы Левелли[9][10].
В 1826 году Г. Кёниг опубликовал[11] первый вариант классификации опухолей почки; этот вариант был основан на данных макроскопической морфологии и предусматривал подразделение опухолей почки на четыре группы: скиррозные, стеатоматозные, фунгоидные и медуллярные. В 1855 году Ш. Ф. Робин установил, что рак почки развивается из эпителия почечных канальцев[англ.]. Наконец, в 1883 году немецкий врач-патолог Пауль Гравиц дал классическое описание почечно-клеточного рака под названием «гипернефрома», хотя в понимании его происхождения сделал шаг назад (считая, что опухоли почки берут начало из остатков ткани надпочечников)[10][12][13]. На данный момент термины «гипернефрома» или «гипернефроидный рак» не актуальны.
Эпидемиология
[править | править код]В мире ежегодно заболевает и погибает от почечноклеточного рака приблизительно 250 тыс. и 100 тыс. человек соответственно. В 2008 году в России было зарегистрировано 17 563 новых случая почечноклеточного рака и 8 370 человек умерло вследствие прогрессирования заболевания[14]. В 2010 году число новых случаев заболевания раком почки в России возросло до 18 723[5]. В 2011 году в России из 522 410 впервые выявленных онкологических больных диагноз рака почки был поставлен 19 657 (2,64 %) из них, в том числе 10 872 мужчинам и 8 785 женщинам; в том же году от рака почки в России умер уже 8 561 пациент[15]. В 2013 году число зарегистрированных в России новых случаев заболевания почечноклеточным раком возросло до 20 892[16].
В мировой структуре злокачественных новообразований доля почечно-клеточного рака в 2008 году занимала 2—3 %[17]. По данным на тот же год, в России почечно-клеточный рак составлял приблизительно 4,3 % всех злокачественных новообразований у мужчин (8-е место среди различных злокачественных новообразований) и 2,9 % у женщин (11-е место). При этом стандартизованные (по европейскому возрастному стандарту) показатели заболеваемости на 100 000 населения составили: 12,2 — среди всего населения, 16,5 — среди мужчин и 8,4 — среди женщин; стандартизованные показатели смертности составляли 6,2 для мужчин и 2,2 для женщин. Медиана возраста больного на момент постановки диагноза равнялась 61 году. Общая 5-летняя выживаемость в 2001—2005 годах составила 59,7 %; за период с 1999 по 2006 годы показатели опухоль-специфической выживаемости при почечно-клеточном раке среди обоих полов несколько улучшились, но незначительно[18].
В последние годы заболеваемость почечноклеточным раком в большинстве развитых стран возрастает, причём по темпам прироста заболеваемости рак почки уступает только новообразованиям предстательной и щитовидной желез[19].
Основные факторы риска
[править | править код]Главные факторы риска связаны с образом жизни. Курение, ожирение и гипертония являются причинами до 50 % случаев заболевания раком почки[20]. Хотя эпидемиологические исследования позволили выделить несколько факторов риска, которые могут иметь отношение к развитию почечноклеточного рака, этиология выяснена далеко не полностью[21].
В качестве основных факторов, повышающих риск развития рака почки, выделяют:
- принадлежность к мужскому полу (повышает риск в 2—3 раза)[22];
- курение (повышает риск в 1,5 раза)[22];
- ожирение (повышает риск примерно на 20 %)[23].
- удаление матки (повышает риск более чем в 2 раза по сравнению с остальными женщинами)[24].
Специфический фактор риска выявлен у пациентов с терминальной стадией хронической почечной недостаточности, к которым длительное время применяли процедуру гемодиализа. У таких пациентов почки в 35 — 47 % случаев претерпевают кистозную дегенерацию, причём клетки эпителия, выстилающего такие кисты, подвергаются раковому перерождению примерно в 30 раз чаще, чем клетки паренхимы почек здоровых людей[25].
Классификация
[править | править код]Клиническая классификация рака почки
[править | править код]
Клинически рак почки классифицируется, как и все другие злокачественные образования, по системе TNM. В данной системе компонент T (лат. tumor ‘опухоль’) характеризует размеры и распространённость первичной опухоли, компонент N (лат. nodus ‘узел’) — степень метастатического поражения регионарных лимфатических узлов, компонент M (греч. μετάστασις ‘перемещение’) — отсутствие или наличие метастазов в отдалённые органы. Такая клиническая классификация в компактной форме отражает диагноз, частично предопределяя тактику лечения и прогноз[26].
Применительно к почечно-клеточному раку TNM-классификация выглядит следующим образом[27]:
- Компонент T:
- Тх — невозможно оценить первичную опухоль;
- Т0 — данных о первичной опухоли нет;
- Т1 — первичная опухоль не более 7 см в наибольшем измерении, ограниченная почкой:
- 1) T1a — опухоль до 4 см в диаметре;
- 2) T1b — опухоль 4—7 см в диаметре;
- Т2 — опухоль более 7 см в наибольшем измерении, ограниченная почкой;
- Т3 — опухоль распространяется на крупные вены, или в надпочечник либо окружающие ткани, но при этом не выходит за пределы фасции Герота[англ.]:
- 1) Т3а — опухоль прорастает надпочечник или паранефральную клетчатку в пределах фасции Герота;
- 2) Т3b — опухоль распространяется на почечную вену или нижнюю полую вену ниже диафрагмы;
- 3) Т3с — опухоль распространяется на нижнюю полую вену выше диафрагмы или прорастает в её стенку;
- Т4 — опухоль распространяется за пределы фасции Герота.
- Компонент N:
- Nх — невозможно оценить регионарные лимфатические узлы;
- N0 — метастазов в регионарных лимфатических узлах нет;
- N1 — метастаз в одном регионарном лимфоузле;
- N2 — метастазы более чем в одном регионарном лимфоузле.
- Компонент М:
- Мх — невозможно оценить отдалённые метастазы;
- М0 — отдалённых метастазов нет;
- М1 — отдалённые метастазы есть.
Кроме классификации TNM, существует также классификация Робсона[28]:
- Стадия I. Опухоль ограничена почкой и не проникает через её капсулу.
- Стадия II. Опухоль проникает через капсулу почки.
- Стадия III. Опухоль проникает в лимфоузлы или переходит на почечную вену или нижнюю полую вену.
- Стадия IV. Опухоль переходит на соседние с почкой органы (например, на поджелудочную железу или кишечник) либо имеют место отдалённые метастазы (например, в лёгкие).
Метастазирование
[править | править код]Рак почки метастазирует гематогенным и лимфогенным путём. Метастазы обнаруживаются у 25 % пациентов на момент установления диагноза. Выживаемость данных больных составляет от 6 до 12 месяцев и только 10 % переживают 2 года. Приблизительно у 30 — 50 % больных в различные сроки после нефрэктомии появляются метахронные метастазы. Прогноз для последней группы несколько лучше, однако 5-летняя выживаемость не превышает 9 %. По данным Saitoh et al. (1982), наиболее частыми локализациями множественных метастазов являются: лёгкие (76 %), лимфатические узлы (64 %), кости (43 %), печень (41 %), ипсилатеральный и контралатеральный надпочечники (19 % и 11,5 %), контралатеральная почка (25 %), головной мозг (11,2 %). Солитарные метастазы или метастатическое поражение только одного органа имеет место только в 8—11 % случаев.
Способностью метастазировать, хотя и редко, обладают даже весьма скромные по размерам (менее 3 см в наибольшем измерении) первичные опухоли, обнаруженные в почках. В 1987 году японскими онкологами[29] был описан случай, когда пациент с выявленной в его почке 8-миллиметровой карциномой (светлоклеточный вариант почечно-клеточного рака) имел уже костные метастазы и умер через 7 месяцев после выявления заболевания[30].
При диссеминированных злокачественных опухолях почки костные метастазы возникают в 30 — 70 % случаев; при этом метастатические опухоли костей более распространены, чем первичные, составляя около 96 % всех новообразований костной системы[31]. Характерную особенность метастазирования почечно-клеточного рака в кости по сравнению с метастазами опухолей других локализаций составляет преобладание солитарных очагов[32]. Стратегия лечения костных метастазов зависит от их типа: при солитарных метастазах показано радикальное и абластичное их удаление (независимо от времени возникновения), что позволяет достичь длительной ремиссии, а при множественных метастатических поражениях (когда речь идёт лишь об улучшении качества жизни пациента) предпочтительны малоинвазивные хирургические вмешательства[33].
По данным проведённого в 2012 году многоцентрового кооперированного исследования с использованием базы данных, содержащей информацию о 7813 больных раком почки в России, было обнаружено 1158 больных с IV клинической стадией рака, причём отдалённые метастазы были выявлены у 1011 (87,3 %) из них. У 557 (54,1 %) пациентов наблюдались метастазы в лёгких, у 283 (28 %) — в костях, у 172 (17 %) — в нерегионарных лимфатических узлах, у 141 (13,9 %) — в печени, у 107 (10,6 %) — в контралатеральном надпочечнике и у 38 (3,8 %) — в головном мозге (у ряда больных метастазы появились в нескольких органах)[34].
Говоря о течении метастатической болезни при раке почки, нельзя не упомянуть о случаях спонтанной регрессии и стабилизации. Спонтанная регрессия отмечается у 0,4 — 0,8 % больных раком почки (это касается в подавляющем большинстве случаев регрессии лёгочных метастазов). Стабилизация болезни (определяемая как отсутствие роста и появления новых метастазов) наблюдается у 20 — 30 % больных, и с такой же частотой отмечается стабилизация болезни (отсутствие роста первичной опухоли) у больных раком почки без метастазов. Этот феномен должен учитываться при решении вопроса о хирургическом или системном лечении больных с высоким риском, которые в действительности могут прожить дольше без специальных методов лечения.
Гистологическая классификация рака почки
[править | править код]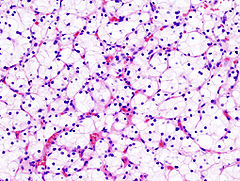


Ранее рак почки классифицировали по типу клеток и характеру роста. Позже было установлено что рак почки в абсолютном большинстве — смешанный. Современная классификация основывается на морфологических, цитогенетических и молекулярных исследованиях, а также иммуногистохимическом анализе и выделяет 5 видов почечно-клеточного рака[35]:
- светлоклеточный рак почки
- папиллярный (1 и 2 подтип) рак почки
- хромофобный рак почки
- онкоцитома почки[англ.]
- рак собирательных трубочек
- медуллярный рак почки
Папиллярный почечно-клеточный рак при этом включает два отдельных подтипа: 1-й из них представлен мелкими клетками со светлой цитоплазмой, 2-й — крупными клетками и эозинофильной цитоплазмой (для данного подтипа вероятность развития метастазов выше)[17].
В 2013 году в рамках Ванкуверской классификации злокачественных опухолей почки были выделены новые гистологические виды почечно-клеточного рака: тубулярно-кистозный ПКР, светлоклеточный папиллярный ПКР, ассоциированная с ПКР приобретённая кистозная болезнь, ПКР с транслокацией в семействе MiT и ассоциированный с ПКР наследственный лейомиоматоз. Эксперты выделяют также ещё 3 редких опухоли, которые в будущем могут войти в классификацию: ПКР с транслокацией ALK, подобный раку щитовидной железы фолликулярный ПКР, и ассоциированный с недостаточностью сукцинатдегидрогеназы B ПКР. Предполагается, что Ванкуверская классификация станет основой очередного пересмотра классификации опухолей Всемирной организации здравоохранения[36].
В рамках упоминавшегося выше многоцентрового кооперированного исследования 2012 года гистологический тип опухоли почки после операции был описан у 7357 из 7813 больных раком почки, присутствовавших в базе данных. При этом светлоклеточный вариант рака был выявлен у 6774 (92,1 %) пациентов, папиллярный — у 303 (4,1 %), хромофобный — у 175 (2,4 %), рак собирательных трубочек — у 17 (0,2 %), а наличие саркомоподобного рака в опухоли отмечалось у 88 пациентов. Частота выявления светлоклеточных и несветлоклеточных форм почечно-клеточного рака заметно отличалась от данных, полученных в начале 2000-х гг. в зарубежной клинической практике (где на долю светлоклеточного варианта приходилось 80—90 % злокачественных опухолей, папиллярного — 10—15 %, хромофобного — 4—5 %, рака из собирательных трубочек — менее 1 %, а 7 % случаев осталось неклассифицированными[17]); это, возможно, связано с определённой недооценкой частоты хромофобного и особенно папиллярного вариантов, допускаемой российскими морфологами[34].
Возникновение различных гистологических разновидностей почечно-клеточного рака сопряжено с различного характера изменениями в геноме. Так, для светлоклеточного рака почки основным «драйверным» механизмом оказывается инактивация (делеция, гиперметилирование или миссенс-мутация) гена VHL (расположен на коротком плече 3-й хромосомы[37]). Такая инактивация ведёт к потере функций кодируемого данным геном белка-супрессора pVHL), отмечаемой почти в 100 % случаев наследственного и более чем в 75 % спорадического светлоклеточного рака. В результате, в частности, нарушается внутриклеточная регуляция уровня одного из транскрипционных факторов — фактора HIF (фактор, индуцируемый гипоксией), следствием чего оказывается неконтролируемое усиление ангиогенеза (последнее выступает как необходимое условие развития опухоли)[38].
Гистологическая классификация оказывает основное влияние на выбор наиболее эффективных вариантов лечения, поскольку разные типы рака по-разному отвечают на различные препараты для химиотерапии, лучевую терапию и т. д.
Симптомы
[править | править код]- Кровь в моче (гематурия) и, как следствие, постгеморрагическая анемия (при большой кровопотере)
- Подъём давления (вторичная артериальная гипертензия)
- Боль в проекции почки
- Пальпируемое образование в проекции почки
- Общие симптомы рака (длительная постоянная потеря веса, постоянная субфебрильная температура, хронически нарастающая слабость)
Диагностика
[править | править код]В диагностике рака почки применяют следующие методы:
- Ультразвуковое исследование почек (УЗИ)
- Рентгенологическое исследование с применением контрастирующих препаратов — внутривенная урография
- Компьютерная томография
- Магнитно-резонансная томография (МРТ)
Окончательный диагноз любого рака ставится только на основании гистологического исследования образца опухоли (биопсия) или опухоли целиком.
Распространение и внедрение в клиническую практику высокотехнологичных методов диагностики опухолей (ультрасонография, мультиспиральная компьютерная и магнитно-резонансная томография) привели к росту выявляемости инцидентального почечно-клеточного рака (инцидентальные опухоли почек — опухоли, не проявившие себя клинически и обнаруженные случайно в ходе диспансеризации или обследования по поводу других заболеваний). Если в 1970-е годы такие опухоли выявлялись менее чем в 10 % случаев, то на рубеже XX—XXI вв. они составляли почти 60 % от всех случаев выявления рака почки[39].
Выявляемость рака почки на ранних стадиях заболевания продолжает желать лучшего. Так, в 2012 году в России 21,5 % больных обратилось в онкологические учреждения уже при наличии отдалённых метастазов, и ещё 20,1 % имели исходно III стадию заболевания. С учётом того, что примерно у 50 % пациентов, перенёсших радикальную нефрэктомию на ранней (М0) стадии заболевания, впоследствии возникают метастазы, необходимость в противоопухолевой лекарственной терапии рано или поздно возникает более чем у половины больных[40].
Методы лечения
[править | править код]К основным методам лечения почечно-клеточного рака относятся: оперативное удаление опухоли, химиотерапия, лучевая терапия, иммунотерапия, таргетная терапия, предоперационная и паллиативная химиоэмболизация.
Оперативное удаление опухоли
[править | править код]Оперативное удаление опухоли является основным и самым эффективным методом лечения почечно-клеточного рака. Удаление первичного очага увеличивает выживаемость на всех стадиях заболевания. Наилучшие результаты на первой стадии даёт нефрэктомия (полное удаление поражённой почки); однако если размеры опухоли невелики (либо почка всего одна, или же диагностирован двусторонний рак почек[41]), применяют органосохраняющее лечение — резекцию почки (в последние годы процентное соотношение резекций почки и нефрэктомий значительно возросло, что связано с улучшением диагностики и повышением частоты выявления ранних стадий опухолей[42]). В настоящее время часто считают, что показанием к резекции почки служит опухоль класса T1 с доступной для резекции локализацией, диаметр которой не превосходит 5 см; в этом случае органосохраняющее лечение оказывается предпочтительным, поскольку сохранение функционирующей паренхимы позволяет улучшить качество жизни пациента[43]. В последнее время всё большее применение находят также малоинвазивные методы удаления опухоли: радиочастотная абляция, криоабляция[англ.][44][45].
Химиотерапия
[править | править код]При лечении почечно-клеточного рака применяется крайне редко (чаще всего назначают капецитабин, доксорубицин), поскольку данный тип опухоли мало чувствителен к известным химиотерапевтическим препаратам. Одной из основных причин высокой устойчивости опухолей почки к химиотерапии считается гиперэкспрессия белка множественной лекарственной устойчивости (MDR-1), связанная, вероятнее всего, с тем, что данный белок в норме продуцируется в клетках проксимальных канальцев почки, из которых чаще всего и развиваются опухоли[19].
Лучевая терапия
[править | править код]Используется при лечении почечно-клеточного рака несколько чаще, чем химиотерапия; хотя чувствительность опухоли почки к облучению также невелика, но применение лучевой терапии иногда оправдано с паллиативной целью у пациентов с метастазами и выраженным болевым синдромом, поскольку это позволяет уменьшить испытываемые пациентом боли и улучшить на определённое время его самочувствие[46].
Иммунотерапия
[править | править код]Стала широко применяться при лечении почечно-клеточного рака в 80-е годы XX века. До недавнего времени иммунотерапевтические методы с применением интерферона-альфа или интерлейкина-2 являлись единственным стандартом при лекарственном лечении больных диссеминированными формами ПКР; однако частота объективных эффектов при их применении остаётся невысокой, и в настоящее время они уступили своё место препаратам таргетной терапии с связи с явными преимуществами последних[14][47].
Возрождение интереса к иммунотерапевтическим методам лечения почечно-клеточного рака произошло в середине 2010-х годов и связано, прежде всего, с появлением препарата ниволумаб (в США зарегистрирован для 2-й линии терапии метастатического ПКР в октябре 2015 года[48], в России — в 2016 году[49]). Этот препарат относится к группе таргетных иммуномодуляторов и представляет собой моноклональное антитело, действующее как ингибитор контрольной точки[англ.]. Его мишенью служат рецепторы программированной смерти 1 (PD-1) на поверхности T-лимфоцитов; подавляя их блокаду, вызванную лигандами PD-L1 и PD-L2 (их экспрессируют клетки развивающейся опухоли), ниволумаб восстанавливает иммунный ответ организма, направленный против опухоли. Результаты клинических исследований показали достаточно высокую эффективность ниволумаба при терапии светлоклеточного метастатического ПКР; обнадёживающие результаты получены и в отношении некоторых других гистологических видов ПКР[49][50]. Другие препараты: ипилимумаб.
Таргетная терапия
[править | править код]Таргетная терапия как метод лечения почечно-клеточного рака, предполагающий избирательную нацеленность на специфические «мишени» опухолевых клеток, возникла в начале XXI века[51]. Её появление связано с открытием — благодаря успехам молекулярной биологии — основных патогенетических путей развития данного типа рака, опосредованных через фактор роста эндотелия сосудов VEGF или через мишень рапамицина у млекопитающих mTOR. Рост раковой опухоли и её способность к метастазированию связаны с протекающим в опухолевых тканях интенсивным ангиогенезом[52], который стимулируется сигнальным белком VEGF, а белок mTOR регулирует клеточный рост; препараты таргетной терапии ингибируют эти белки, подавляя рост и размножение раковых клеток. В терапии почечно-клеточного рака находят применение следующие препараты: 1) ингибиторы VEGF-рецепторов: сорафениб, сунитиниб, пазопаниб[англ.][53]; 2) ингибиторы белка VEGF: бевацизумаб; 3) ингибиторы mTOR: темсиролимус, эверолимус[54]. В 2012 году к числу используемых ингибиторов VEGF-рецепторов добавились акситиниб[англ.] и тивозаниб[англ.][55].
Разработка новых таргетных препаратов для лечения почечно-клеточного рака активно ведётся в различных странах мира. Так, созданное российскими специалистами моноклональное антитело OM-RCA-01, нацеленное против рецептора фактора роста фибробластов FGFR1, показало в 2013—2014 гг. в доклинических испытаниях обнадёживающие результаты в качестве ингибитора ангиогенеза и переведено в фазу клинических испытаний с перспективой использования при лечении метастатического почечно-клеточного рака[56][57].
Наиболее универсальным среди таргетных препаратов первоначально считался сорафениб, подавляющий не только ангиогенез, но и клеточную пролиферацию[58]; в то же время проведённые в конце 2000-х — начале 2010-х гг. клинические исследования показали, что сунитиниб, пазопаниб и акситиниб имеют (по крайней мере на 1-й линии терапии) вполне сравнимые с сорафенибом показатели эффективности[59][60]. Получены данные в пользу целесообразности применения на 1-й линии терапии сунитиниба (при его непереносимости — пазопаниба), а на 2-й — акситиниба или эверолимуса[61]. В качестве стандарта лечения больных метастатическим почечно-клеточным раком светлоклеточного типа при неблагоприятном прогнозе рекомендован темсиролимус[62]. В России акситиниб применяется для лечения злокачественных новообразований почки, кроме почечной лоханки. Терапия рака почки пембролизумабом и акситинибом уже одобрена по ряду клинических показаний. Эффективность сочетания пембролизумаб/акситиниба, по сравнению с сунитинибом, была выражена в увеличении выживаемости пациентов, а также в продлении ремиссии, что способствовало статистически значимому повышению качества их жизни[63].
Серьёзной проблемой на пути применения препаратов данного класса является, впрочем, быстро развивающаяся резистентность организма к ним, а также (наблюдаемая достаточно часто) плохая их переносимость, сопровождающаяся различными побочными эффектами[64][65]; для борьбы с этим пытаются применять комбинированную терапию (по предварительным данным, обнадёживающие результаты даёт совместное применение бевацизумаба и одного из ингибиторов mTOR)[66].
Тем не менее именно применение таргетной терапии позволило перевести рак почки в разряд хронических онкозаболеваний, поскольку во многих случаях метастатического процесса удалось добиться увеличения продолжительности жизни больных на годы. В последние годы всё большее распространение получает современная онкологическая концепция, основанная на принципе «если болезнь нельзя вылечить — её можно контролировать». Применение данной концепции предполагает активную хирургическую тактику в отношении метастазов: их стремятся удалять во всех возможных (и целесообразных) случаях на фоне проводимой таргетной терапии[67].
Прогноз
[править | править код]При диагностике заболевания на первой стадии полностью излечиваются 90 % больных. При диагностике заболевания на четвёртой стадии прогноз неблагоприятный, тяжело добиться даже однолетней выживаемости.
Примечания
[править | править код]- ↑ Disease Ontology (англ.) — 2016.
- ↑ Monarch Disease Ontology release 2018-06-29 — 2018-06-29 — 2018.
- ↑ Онкология, 2007, с. 547.
- ↑ Дзитиев В. К. [и др.] Коралловидный нефролитиаз и плоскоклеточный рак лоханки: клиническое наблюдение и обзор литературных данных // Вестник урологии. — 2023. — Т. 11, № 2. — С. 171-180.
- ↑ 1 2 Москвина Л. В., Андреева Ю. Ю., Мальков П. Г., Франк Г. А., Алексеев Б. Я., Калпинский А. С., Прядилова Е. В. Клинически значимые морфологические параметры почечно-клеточного рака // Онкология. — 2013. — № 4. — С. 34—39.
- ↑ Ljungberg, Bensalah, Bex et al., 2014, p. 8.
- ↑ Antic T., Taxy J. B. . Renal Neoplasms: An Integrative Approach to Cytopathologic Diagnosis. — New York: Springer, 2014. — ix + 69 p. — ISBN 978-1-4939-0430-3. (недоступная ссылка) — P. 1—3.
- ↑ Miriel G. . Reflexions sommaires sur l'importance du diagnostic. — Paris, 1810. — 13 p.
- ↑ Delahunt B., Thornton A. . Renal cell carcinoma. A historical perspective // Journal of Urologic Pathology, 1996, 4. — P. 31—49.
- ↑ 1 2 Delahunt B., Eble J. N. . History of the Development of the Classification of Renal Cell Neoplasia // Clinics in Laboratory Medicine, 2005, 25 (2). — P. 231—246. — doi:10.1016/j.cll.2005.01.007.
- ↑ König G. . Praktische Abhandlungen über die Krankheiten der Niere. — Leipzig: C. Cnobloch, 1826.
- ↑ Онкология, 2007, с. 548.
- ↑ Renal Cell Cancer: Diagnosis and Therapy, 2008, p. 15.
- ↑ 1 2 Носов, 2012, с. 185.
- ↑ Широкорад и др., 2013, с. 24.
- ↑ Алексеев Б. Я., Нюшко К. М., Калпинский А. С. Неоадъювантная таргетная терапия у больных почечно-клеточным раком // Онкоурология. — 2015. — Т. 11, № 2. — С. 23—33. — doi:10.17650/1726-9776-2015-11-2-23-33. Архивировано 21 октября 2020 года.
- ↑ 1 2 3 Padrik P. Лечение несветлоклеточного почечно-клеточного рака // Злокачественные опухоли. — 2011. — Т. 1, № 1. — С. 40—44. Архивировано 24 сентября 2015 года.
- ↑ Тимофеев И. В., Аксель Е. М. Почечно-клеточный рак в России в 2008 году // Злокачественные опухоли. — 2011. — Т. 1, № 1. — С. 6—10. Архивировано 24 сентября 2015 года.
- ↑ 1 2 Алексеев, Шегай, 2007, с. 6.
- ↑ Häggström C., Rapp K., Stocks T., Manjer J., Bjørge T., Ulmer H., Engeland A., Almqvist M., Concin H., Selmer R., Ljungberg B., Tretli S., Nagel G., Hallmans G., Jonsson H., Stattin P. Metabolic Factors Associated with Risk of Renal Cell Carcinoma // PLoS ONE. — 2013. — Vol. 8, no. 2. — P. e57475. — doi:10.1371/journal.pone.0057475. — PMID 23468995.
- ↑ Renal Cell Cancer: Diagnosis and Therapy, 2008, p. 2.
- ↑ 1 2 Черенков, 2010, с. 256.
- ↑ Риски для здоровья при избыточном весе и похудении. Дата обращения: 6 февраля 2014. Архивировано 19 февраля 2014 года.
- ↑ Zucchetto A., Talamini R., Dal Maso L., Negri E., Polesel J., Ramazzotti V., Montella M., Canzonieri V., Serraino D., La Vecchia C., Franceschi S. Reproductive, Menstrual, and Other Hormone-Related Factors and Risk of Renal Cell Cancer // International Journal of Cancer. — 2008. — Vol. 123, no. 9. — P. 2213—2216. — doi:10.1002/ijc.23750. — PMID 18711701.
- ↑ Онкология, 2007, с. 549.
- ↑ Черенков, 2010, с. 33—34.
- ↑ Онкоурология. Фармакотерапия без ошибок, 2014, с. 541.
- ↑ Robson C. J. . Staging of Renal Cell Carcinoma // Prog. Clin. Biol. Res, 1982, 100. — P. 439—445. — PMID 7145967.
- ↑ Aizawa S., Suzuki M., Kikuchi Y., Nikaido T., Matsumoto K. . Clinicopathological Study on Small Renal Cell Carcinomas with Metastases // Acta Pathologica Japonica, 1987, 37 (6). — P. 947—954. — doi:10.1111/j.1440-1827.1987.tb00444.x. — PMID 3630706.
- ↑ Renal Cell Cancer: Diagnosis and Therapy, 2008, p. 10.
- ↑ Семков и др., 2010, с. 10.
- ↑ Кострицкий С. В., Широкорад В. И., Семёнов Д. В., Пташников Д. А., Щупак М. Ю., Махсон А. Н., Манихас Г. М., Шестаев А. Ю., Костюк И. П., Карлов П. А., Митрофанов П. П. Хирургическое лечение больных с метастазами рака почки в позвоночник // Онкоурология. — 2014. — Т. 10, № 3. — С. 40—42. — doi:10.17650/1726-9776-2014-10-3-40-42. Архивировано 10 августа 2016 года.
- ↑ Семков и др., 2010, с. 14—15.
- ↑ 1 2 Алексеев Б. Я., Анжиганова Ю. В., Лыков А. В., Леонов О. В., Варламов С. А., Горбачёв А. Л., Магер В. О., Демичева Н. Н., Мишугин С. В., Зырянов А. В., Карнаух П. А., Никитин Р. В. Особенности диагностики и лечения рака почки в России: предварительные результаты многоцентрового кооперированного исследования // Онкоурология. — 2012. — № 3. — С. 24—30. Архивировано 11 сентября 2014 года.
- ↑ Матвеев В. Б. Классификация рака почки. Клиническая картина. // Сайт netoncology.ru. Дата обращения: 29 апреля 2015. Архивировано 15 июля 2015 года.
- ↑ Тимофеев И. В. Современные возможности лечения несветлоклеточного почечно-клеточного рака // Онкоурология. — 2015. — Т. 11, № 4. — С. 24—33. — doi:10.17650/1726-9776-2015-11-4-24-33. Архивировано 12 августа 2020 года.
- ↑ Human chromosome 3 map view. // Vertebrate Genome Annotation (VEGA) database. Дата обращения: 23 февраля 2016. Архивировано 5 апреля 2012 года.
- ↑ Носов Д. А., Ворошилова Е. А., Саяпина М. С. Современное представление об алгоритме лекарственного лечения и оптимальной последовательности использования таргетных препаратов // Онкоурология. — 2014. — Т. 10, № 3. — С. 12—21. — doi:10.17650/1726-9776-2014-10-3-12-21. Архивировано 21 сентября 2017 года.
- ↑ Базаев В. В., Дутов В. В., Тян П. А., Казанцева И. А. Инцидентальный почечно-клеточный рак: клинико-морфологические особенности // Урология. — 2013. — № 2. — С. 66—68.
- ↑ Широкорад и др., 2013, с. 25.
- ↑ Аляев Ю. Г., Григорян З. Г. Двусторонний рак почек // Онкоурология. — 2008. — № 3. — С. 16—24. Архивировано 28 июня 2011 года.
- ↑ Матвеев и др., 2007, с. 8.
- ↑ Матвеев и др., 2007, с. 11.
- ↑ Павлов А. Ю., Клименко А. А., Момджан Б. К., Иванов С. А. Радиочастотная интерстициальная термоабляция (РЧА) рака почки // Экспериментальная и клиническая урология. — 2011. — № 2—3. — С. 112—113. Архивировано 21 февраля 2014 года.
- ↑ Жернов А. А., Корякин А. В. Криоабляция опухоли почки // Экспериментальная и клиническая урология. — 2011. — № 2—3. — С. 109—111. Архивировано 21 февраля 2014 года.
- ↑ Онкоурология. Фармакотерапия без ошибок, 2014, с. 354.
- ↑ Онкоурология. Фармакотерапия без ошибок, 2014, с. 355—357.
- ↑ Venur V. A., Joshi M., Nepple K. G., Zakharia Y. Spotlight on nivolumab in the treatment of renal cell carcinoma: design, development, and place in therapy // Drug Design, Development and Therapy. — 2017. — Vol. 11. — P. 1175—1182. — doi:10.2147/DDDT.S110209. — PMID 28442891.
- ↑ 1 2 Попов А. М. Таргетная терапия распространённого почечно-клеточного рака // Онкоурология. — 2017. — Т. 13, № 2. — С. 56—62. Архивировано 30 августа 2018 года.
- ↑ Матвеев В. Б. Ниволумаб — новый стандарт в лечении метастатического рака почки // Онкоурология. — 2017. — Т. 13, № 3. — С. 18—26. Архивировано 30 августа 2018 года.
- ↑ Черенков, 2010, с. 87.
- ↑ Алексеев, Шегай, 2007, с. 7.
- ↑ Онкоурология. Фармакотерапия без ошибок, 2014, с. 116—117.
- ↑ Алексеев, Калпинский, 2010, с. 16, 20.
- ↑ Носов, 2012, с. 189.
- ↑ Tsimafeyeu I., Zaveleva E., Stepanova E., Low W. OM-RCA-01, a novel humanized monoclonal antibody targeting fibroblast growth factor receptor 1, in renal cell carcinoma model // Investigational New Drugs, 2013, 31 (6). — P. 1436—1443. — doi:10.1007/s10637-013-0017-x.
- ↑ Разрабатываемый компанией «ОнкоМакс» препарат вошёл в Топ-100 изобретений России за 2013 год. Дата обращения: 10 сентября 2014. Архивировано из оригинала 11 сентября 2014 года.
- ↑ Алексеев, Шегай, 2007, с. 9.
- ↑ Онкоурология. Фармакотерапия без ошибок, 2014, с. 356—357.
- ↑ Широкорад и др., 2013, с. 28.
- ↑ Sun M., Larcher A., Karakiewicz P. I. Optimal first-line and second-line treatments for metastatic renal cell carcinoma: current evidence // International Journal of Nephrology and Renovascular Disease, 2014, 7. — P. 401—407. — doi:10.2147/IJNRD.S48496. — PMID 25378943.
- ↑ Алексеев Б. Я., Калпинский А. С. Эффективность применения таргетной терапии в гетерогенной популяции больных метастатическим раком почки // Онкоурология. — 2012. — № 3. — С. 37—43. Архивировано 11 сентября 2014 года.
- ↑ Merck, Pfizer combo treatment meets main goals of kidney cancer trial Архивная копия от 22 октября 2018 на Wayback Machine Reuters, (October 18, 2018)
- ↑ Алексеев Б. Я., Калпинский А. С. Таргетная терапия распространённого рака почки Сутентом®: побочные эффекты и их коррекция // Онкоурология. — 2008. — № 3. — С. 31—38. Архивировано 28 июня 2011 года.
- ↑ Бирюков В. А., Карякин О. Б. Безопасность и переносимость сорафениба при лечении распространённого рака почки // Онкоурология. — 2009. — № 1. — С. 22—26. Архивировано 28 июня 2011 года.
- ↑ Алексеев, Калпинский, 2010, с. 21.
- ↑ Широкорад и др., 2013, с. 25—26.
Литература
[править | править код]Монографии, учебные пособия и справочники
[править | править код]- Клиническая онкоурология / Под ред. Б. П. Матвеева. — М.: АБВ-Пресс, 2011. — 934 с. — ISBN 978-5-903018-23-9.
- Онкология / Под ред. И. В. Залуцкого. — Минск: Вышэйшая школа, 2007. — 703 с. — ISBN 978-985-06-1330-1.
- Онкоурология. Фармакотерапия без ошибок / Под ред. И. Г. Русакова, В. И. Борисова. — М.: Е-ното, 2014. — 544 с. — ISBN 978-5-906023-07-0.
- Струков А. И., Серов В. В. Патологическая анатомия. — М.: Литтерра, 2010. — 848 с. — ISBN 978-5-904090-63-0.
- Черенков В. Г. Клиническая онкология. 3-е изд. — М.: Медицинская книга, 2010. — 434 с. — ISBN 978-5-91894-002-0.
- Ljungberg B., Bensalah K., Bex A. et al. Renal Cell Carcinoma: EAU Guideline. — European Association of Urology, 2014. — 70 p.
- Renal Cell Cancer: Diagnosis and Therapy / Ed. by J. J. M. C. H. de la Rosette, C. N. Sternberg, H. P. A. van Poppel. — London: Springer Verlag, 2008. — xvii + 584 p. — ISBN 978-1-84628-385-7.
Статьи
[править | править код]- Давыдов М. И., Матвеев В. Б., Полоцкий Б. Е., Матвеев Б. П., Носов Д. А. Хирургическое лечение метастазов рака почки в лёгких // Российский онкологический журнал. — 2003. — № 4. — С. 15—18.
- Матвеев В. Б., Матвеев Б. П., Волкова М. И., Перлин Д. В., Фигурин К. М. Роль органосохраняющего хирургического лечения рака почки на современном этапе // Онкоурология. — 2007. — № 2. — С. 5—11.
- Алексеев Б. Я., Шегай П. В. Таргетная терапия распространённого рака почки // Онкоурология. — 2007. — № 4. — С. 6—11.
- Алексеев Б. Я., Калпинский А. С. Применение таргетных препаратов в лечении метастатического рака почки: последовательное назначение или комбинация // Онкоурология. — 2010. — № 4. — С. 16—23.
- Семков А. С., Махсон А. Н., Петерсон С. Б., Широкорад В. И., Щупак М. Ю. Хирургическое лечение костных метастазов рака почки // Онкоурология. — 2010. — № 4. — С. 10—15.
- Носов Д. А. Диссеминированный рак почки: современные возможности лекарственного лечения // Практическая онкология. — 2012. — Т. 15, № 3. — С. 185—195.
- Широкорад В. И., Махсон А. Н., Борисов В. И., Минакова Л. Р., Попов М. И., Щупак М. Ю., Кирдакова Н. В., Мишугин С. В., Матуров М. Р., Виноградский А. Г., Шихов С. Д., Гайдамака Е. В., Апольская Н. А., Шушаков М., Бабаев Э. Р., Воронцова А. А., Иванов А. М., Амосов Ф. Р., Колесников Г. П. Первые результаты таргетной терапии при раке почки в Москве // Онкоурология. — 2013. — № 3. — С. 24—29.
Ссылки
[править | править код]- Портал «RAKPOCHKI.NET»
- Исследование «Значение паллиативной эмболизации в лечении больных неоперабельным почечно-клеточным раком» ФГУ РНЦРХТ, Санкт-Петербург, 2010 год
- Исследование «Первичные результаты химиоэмболизации почечно-клеточного рака гепасферами с доксирубицином» ФГУ РНЦРХТ, Санкт-Петербург, 2010 год
- Лига пациентов по раку почки