Гафний (Igsunw)
| Гафний | ||||
|---|---|---|---|---|
| ← Лютеций | Тантал → | ||||
| ||||
| Внешний вид простого вещества | ||||
 Образцы гафния |
||||
| Свойства атома | ||||
| Название, символ, номер | Га́фний / Hafnium (Hf), 72 | |||
| Группа, период, блок |
4 (устар. 4), 6, d-элемент |
|||
| Атомная масса (молярная масса) |
178,49(2)[1] а. е. м. (г/моль) | |||
| Электронная конфигурация | [Xe] 4f145d26s2 | |||
| Радиус атома | 167 пм | |||
| Химические свойства | ||||
| Ковалентный радиус | 144 пм | |||
| Радиус иона | (+4e) 78 пм | |||
| Электроотрицательность | 1,3 (шкала Полинга) | |||
| Электродный потенциал | 0 | |||
| Степени окисления | 0, +2, +3, +4 | |||
| Энергия ионизации (первый электрон) |
575,2 (5,96) кДж/моль (эВ) | |||
| Термодинамические свойства простого вещества | ||||
| Плотность (при н. у.) | 13,31[2] г/см³ | |||
| Температура плавления | 2506 K (2233 °C)[2] | |||
| Температура кипения | 4876 K (4603 °C)[2] | |||
| Мол. теплота плавления | 25,1 кДж/моль | |||
| Мол. теплота испарения | 575 кДж/моль | |||
| Молярная теплоёмкость | 25,7[3] Дж/(K·моль) | |||
| Молярный объём | 13,6 см³/моль | |||
| Кристаллическая решётка простого вещества | ||||
| Структура решётки | Гексагональная | |||
| Параметры решётки | a = 3,196 Å; c = 5,051 Å[4] | |||
| Отношение c/a | 1,580 | |||
| Прочие характеристики | ||||
| Теплопроводность | (300 K) 23,0 Вт/(м·К) | |||
| Номер CAS | 7440-58-6 | |||
| 72 | Гафний
|
| 4f145d26s2 | |
Га́фний (химический символ — Hf, от лат. Hafnium) — химический элемент 4-й группы (по устаревшей классификации — побочной подгруппы четвёртой группы, IVB) шестого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 72. Относится к переходным металлам. Из-за химической схожести с цирконием он стал последним открытым нерадиоактивным элементом (то есть имеющим стабильные изотопы), его открыли только в 1923 году.
Простое вещество гафний — тяжёлый тугоплавкий металл серебристо-белого цвета.
История открытия и происхождение названия
[править | править код]Элемент был открыт в 1923 году.
Гафний искали среди редкоземельных элементов, так как не было выяснено строение 6-го периода системы Д. И. Менделеева. В 1911 году французский химик Жорж Урбен объявил об открытии нового элемента, названного им кельтием. В действительности он получил смесь, состоящую из иттербия, лютеция и небольшого количества гафния. И только после того, как Нильс Бор на основании квантовомеханических расчётов показал, что последним редкоземельным элементом является элемент с номером 71, стало ясно, что гафний — аналог циркония[5].
Базируясь на выводах Бора, который предсказал его свойства и валентность, в 1923 году Дирк Костер и Дьёрдь де Хевеши систематически проанализировали рентгеноспектральным методом норвежские и гренландские цирконы. Совпадение линий рентгенограмм остатков после выщелачивания циркона кипящими растворами кислот с вычисленными по закону Мозли для 72-го элемента позволило исследователям объявить об открытии элемента, который они назвали гафнием в честь города, где было сделано открытие (лат. Hafnia — латинское название Копенгагена). Начавшийся после этого спор о приоритете между Ж. Урбеном, Д. Костером и Д. Хевеши продолжался длительное время. В 1949 году название элемента «гафний» было утверждено Международной комиссией и принято всюду[5].
Мировые ресурсы гафния
[править | править код]Цены на гафний чистотой в 99 % в 2007 году в среднем составляли 780 USD за килограмм (по материалам infogeo.ru[источник не указан 925 дней]).
В год в мире добывается приблизительно 70 тонн гафния, и объёмы его добычи пропорциональны объёмам добычи циркония.
Мировые ресурсы гафния в пересчёте на двуокись гафния несколько превышают 1 миллион тонн. Структура распределения этих ресурсов выглядит приблизительно следующим образом:
- Австралия — более 630 тысяч тонн,
- ЮАР — почти 287 тысяч тонн,
- США — чуть более 105 тысяч тонн,
- Индия — около 70 тысяч тонн,
- Бразилия — 9,88 тысячи тонн.
Подавляющая часть сырьевой базы гафния в зарубежных странах[где?] представлена цирконом прибрежных морских россыпей.
Запасы гафния в России и СНГ, по оценкам независимых специалистов[каких?], весьма велики[Насколько?] и в этом отношении при развитии гафниевой промышленности Россия способна стать безусловным лидером на мировом рынке гафния. Стоит также в связи с этим упомянуть весьма значительные ресурсы гафния на Украине. Основные гафнийсодержащие минералы в России и СНГ представлены лопаритом, цирконом, бадделеитом, редкометалльными щелочными гранитами[источник не указан 1151 день].
Физические свойства
[править | править код]
Полная электронная конфигурация атома гафния: 1s22s22p63s23p64s23d104p65s24d105p66s24f145d2.
Гафний — блестящий серебристо-белый металл, твёрдый и тугоплавкий. В мелкодисперсном состоянии имеет тёмно-серый, почти чёрный цвет; матовый[3]. Плотность при нормальных условиях — 13,31 г/см3[2]. Температура плавления составляет 2506 K (2233 °C), кипит при 4876 K (4603 °C)[2].
Гафний имеет две модификации. При комнатной температуре гафний обладает гексагональной плотноупакованной кристаллической решёткой. При температуре, равной 2016 K, гафний претерпевает аллотропическое превращение — гексагональная решётка переходит в объёмноцентрированную кубическую решётку.
Гафний обладает высоким сечением захвата тепловых нейтронов — (115 барн у естественной смеси изотопов[6]), тогда как у его химического аналога, циркония, сечение захвата на 3 порядка меньше, около 0,2 барн. В связи с этим цирконий, используемый для создания реакторных ТВЭЛов, должен быть тщательно очищен от гафния.
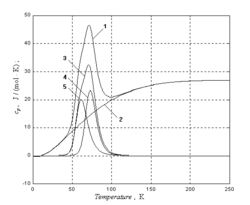
Температурная зависимость теплоёмкости гафния (аналогично теплоёмкости германия — Ge) имеет аномальный вид — на кривой теплоёмкости в диапазоне температур 60—80 К наблюдается пик[7], который не может быть объяснён никакой теорией, предполагающей гуковский закон сил, так как никакая суперпозиция эйнштейновских функций не даёт кривой с максимумом[8]. В данном случае аномальный вид кривой теплоёмкости определяется суперпозицией колебательной (дебаевской) и диффузионной (больцмановской) компонент поглощения тепла кристаллической решёткой[9].
Изотопы гафния
[править | править код]Известно более 30 изотопов гафния с массовыми числами от 153 до 188 (количество протонов составляет 72, нейтронов — от 81 до 116), и 26 ядерных изомеров. 5 изотопов стабильны и встречаются в природе (176Hf, 177Hf, 178Hf, 179Hf, 180Hf). Благодаря огромному периоду полураспада (период полураспада 2×1015 лет) в природе встречается один нестабильный изотоп, 174Hf.
Известен изомер гафния 178m2Hf. Он привлёк внимание общественности в связи с исследованиями агентства оборонных исследований DARPA по принудительному распаду изомера с выделением значительных энергий[10][11]. Начали высказываться гипотезы о возможности построения гафниевой бомбы. Тем не менее в научной среде ставится под сомнение как возможность управляемого взрывного распада 178m2Hf, так и возможность получения изомера в количествах, необходимых для создания оружия.
Химические свойства
[править | править код]Гафний, как и тантал, — достаточно инертный материал из-за образования тонкой пассивной плёнки оксидов на поверхности. В целом химическая стойкость гафния гораздо больше, чем у его аналога — циркония.
Лучшим растворителем гафния является фтороводородная кислота (HF) или смесь фтороводородной и азотной кислот, а также царская водка.
При высоких температурах (свыше 1000 К) гафний окисляется на воздухе, а в кислороде сгорает. Реагирует с галогенами. По стойкости к кислотам подобен стеклу. Так же, как и цирконий, обладает гидрофобными свойствами (не смачивается водой).
Важнейшие химические соединения
[править | править код]Соединения двухвалентного гафния
[править | править код]- HfBr2, дибромид гафния — твёрдое вещество чёрного цвета, самовоспламеняющееся на воздухе. Разлагается при температуре 400 °C на гафний и тетрабромид гафния. Получают диспропорционированием трибромида гафния в вакууме при нагревании.
Соединения трёхвалентного гафния
[править | править код]- HfBr3, трибромид гафния — чёрно-синее твёрдое вещество. Диспропорционирует при 400 °C на дибромид и тетрабромид гафния. Получают восстановлением тетрабромида гафния при нагревании в атмосфере водорода или с металлическим алюминием.
Соединения четырёхвалентного гафния
[править | править код]- HfO2, диоксид гафния — бесцветные моноклинные кристаллы (плотность — 9,98 г/см³) или бесцветные тетрагональные кристаллы (плотность — 10,47 г/см³). Последние имеют Tпл 2900 °C, малорастворимы в воде, диамагнитны, обладают более осно́вным характером, чем ZrO2 и обнаруживают каталитические свойства. Получают нагреванием металлического гафния в кислороде или прокаливанием гидроксида, диоксалата, дисульфата гафния.
- Hf(OH)4, гидроксид гафния — белый осадок, растворяющийся при добавлении щелочей и пероксида водорода с образованием пероксогафниатов. Получают глубоким гидролизом солей четырёхвалентного гафния при нагревании или обработкой растворов солей гафния(IV) щелочами.
- HfF4, тетрафторид гафния — бесцветные кристаллы. Tпл 1025 °C, плотность — 7,13 г/см³. Растворим в воде. Получают термическим разложением соединения (NH4)2[HfF6] в токе азота при 300 °C.
- HfCl4, тетрахлорид гафния — белый порошок, сублимирующийся при 317 °C. Tпл 432 °C. Получают действием хлора на металлический гафний, карбид гафния или смесь оксида гафния(II) с углём.
- HfBr4, тетрабромид гафния — бесцветные кристаллы. Сублимируются при 322 °C. Tпл 420 °C. Получают действием паров брома на нагретую до 500 °C смесь оксида гафния(II) с углём.
- HfI4, тетраиодид гафния — жёлтые кристаллы. Сублимирует при 427 °C и термически диссоциирует при 1400 °C. Получается взаимодействием гафния с иодом при 300 °C.
- Hf(HPO4)2, гидрофосфат гафния — белый осадок, растворимый в серной и фтороводородной кислотах. Получают обработкой растворов солей гафния(IV) ортофосфорной кислотой.
Получение
[править | править код]Среднее содержание гафния в земной коре — около 4 г/т. Ввиду отсутствия у гафния собственных минералов и постоянного сопутствия его цирконию, его получают путём переработки циркониевых руд, где он содержится в количестве 2,5 % от веса циркония (циркон содержит 4 % HfO2, бадделеит — 4—6 % HfO2). В мире в год в среднем добывается около 70 тонн гафния, и объёмы его добычи пропорциональны объёмам добычи циркония. Интересна особенность скандиевого минерала — тортвейтита: в нём содержится гафния в процентном отношении гораздо больше, чем циркония, и это обстоятельство очень важно при переработке тортвейтита на скандий и концентрировании гафния из него.
Применение
[править | править код]В разделе не хватает ссылок на источники (см. рекомендации по поиску). |

Основные области применения металлического гафния — производство сплавов для аэрокосмической техники, атомная промышленность, специальная оптика.
- В атомной технике используется способность гафния к захвату нейтронов, и его применение в атомной промышленности — это производство регулирующих стержней, специальной керамики и стекла (оксид, карбид, борид, оксокарбид, гафнат диспрозия, гафнат лития). Особенностью и преимуществом диборида гафния является очень малое газовыделение (гелий, водород) при «выгорании» бора.
- В оптике применяется оксид гафния в связи с его температурной стойкостью (т. пл. 2780 °C) и очень высоким показателем преломления. Значительную сферу потребления гафния составляет производство специальных марок стекла для волоконно-оптических изделий, а также для получения особо высококачественных оптических изделий, покрытия зеркал, в том числе и для приборов ночного видения, тепловизоров. Схожую область применения имеет и фторид гафния.
- Карбид и борид гафния (т. пл. 3250 °C) находят применение в качестве чрезвычайно износоустойчивых покрытий и производства сверхтвёрдых сплавов. Кроме того, карбид гафния является одним из самых тугоплавких соединений (т. пл. 3960 °C) и используется для производства сопел космических ракет и некоторых конструкционных элементов газофазных ядерных реактивных двигателей.
- Гафний отличает сравнительно низкая работа выхода электрона (3,53 эВ), и поэтому он применяется для изготовления катодов мощных радиоламп и электронных пушек. В то же время это его качество наряду с высокой температурой плавления позволяет использовать гафний для производства электродов для сварки металлов в аргоне и особенно электродов (катодов) для сварки низкоуглеродистой стали в углекислом газе. Стойкость таких электродов в углекислом газе более чем в 3,7 раза выше, чем вольфрамовых. В качестве эффективных катодов с малой работой выхода применяется также гафнат бария.
- Карбид гафния в виде мелкопористого керамического изделия может служить чрезвычайно эффективным коллектором электронов при условии испарения с его поверхности в вакууме паров цезия-133, в этом случае работа выхода электронов снижается менее чем 0,1—0,12 эВ, и этот эффект может быть использован для создания высокоэффективных термоэмиссионных электрогенераторов и частей мощных ионных двигателей.
- На основе диборида гафния и никеля разработано и уже давно используется высокоизносоустойчивое и твёрдое композиционное покрытие.
- Сплавы тантал-вольфрам-гафний являются лучшими сплавами для подачи топлива в газофазных ядерных ракетных двигателях.
- Сплавы титана, легированные гафнием, применяются в судостроении (производство деталей судовых двигателей). Гафний как легирующий элемент повышает термическую стабильность сплава, увеличивает сопротивление ползучести (медленной деформации металла под воздействием постоянной нагрузки), улучшает свариваемость, механическую прочность и модуль упругости титана[12].
- Легирование гафнием никеля не только увеличивает его прочность и коррозионную стойкость, но и резко улучшает свариваемость и прочность сварных швов.
- Карбид тантала-гафния. Добавление гафния к танталу резко увеличивает его стойкость к окислению на воздухе (жаростойкость) за счёт образования плотной и непроницаемой плёнки сложных оксидов на поверхности, и, кроме всего, эта плёнка оксидов очень стойка к теплосменам (тепловой удар). Эти свойства позволили создать очень важные сплавы для ракетной техники (сопла, газовые рули). Один из лучших сплавов гафния и тантала для сопел ракет содержит до 20 % гафния. Также следует отметить большой экономический эффект при применении сплава гафний-тантал для производства электродов для воздушно-плазменной и кислородно-пламенной резки металлов. Опыт применения такого сплава (гафний — 77 %, тантал — 20 %, вольфрам — 2 %, серебро — 0,5 %, цезий — 0,1 %, хром — 0,4 %) показал в 9 раз больший ресурс работы по сравнению с чистым гафнием. Сплав карбида гафния (HfC, 20 %) и карбида тантала (TaC, 80 %) является самым тугоплавким сплавом. Кроме того, есть отдельные указания на то, что при легировании этого сплава небольшим количеством карбида титана температура плавления может быть увеличена ещё на 180 градусов.
- Самым тугоплавким материалом на 2022 год являлась керамика из карбонитрида гафния (HfC0.5N0.35) (около 4200 °С), обладающая высокой механической прочностью[13][14].
- Легирование гафнием резко упрочняет многие сплавы кобальта, очень важных в турбостроении, нефтяной, химической и пищевой промышленности.
- Гафний используется в некоторых сплавах для сверхмощных постоянных магнитов на основе редких земель (в частности, на основе тербия и самария).
- Добавлением 1 % гафния в алюминий получают сверхпрочные сплавы алюминия с размером зёрен металла 40—50 нм. При этом не только упрочняется сплав, но и достигается значительное относительное удлинение и повышается предел прочности при сдвиге и кручении, а также улучшается вибростойкость.
- Диэлектрики с высокой диэлектрической проницаемостью на основе оксида гафния в течение следующего десятилетия заменят в микроэлектронике традиционный оксид кремния, что позволит достичь гораздо более высокой плотности элементов в чипах[15]. С 2007 года диоксид гафния используется в 45-нм процессорах Intel Penryn[16][17]. Также в качестве диэлектрика с высокой диэлектрической проницаемостью в электронике применяется силицид гафния. Сплавы гафния и скандия применяются в микроэлектронике для получения резистивных плёнок с особыми свойствами.
- Гафний используется для производства высококачественных многослойных рентгеновских зеркал.
- Гафниевая бомба
Биологическая роль
[править | править код]Гафний не играет никакой биологической роли в организме[источник не указан 925 дней].
Примечания
[править | править код]- ↑ Meija J. et al. Atomic weights of the elements 2013 (IUPAC Technical Report) (англ.) // Pure and Applied Chemistry. — 2016. — Vol. 88, no. 3. — P. 265—291. — doi:10.1515/pac-2015-0305.
- ↑ 1 2 3 4 5 Hafnium: physical properties (англ.). WebElements. Дата обращения: 17 августа 2013. Архивировано 4 сентября 2013 года.
- ↑ 1 2 Ягодин Г. А., Чекмарев А. М. Гафний // Химическая энциклопедия : в 5 т. / Гл. ред. И. Л. Кнунянц. — М.: Советская энциклопедия, 1988. — Т. 1: А — Дарзана. — С. 504—506. — 623 с. — 100 000 экз. — ISBN 5-85270-008-8.
- ↑ Hafnium: crystal structure (англ.). WebElements. Дата обращения: 17 августа 2013. Архивировано 12 августа 2013 года.
- ↑ 1 2 Венецкий С.И., 1980.
- ↑ С. С. Бердоносов. Гафний // Физическая энциклопедия : [в 5 т.] / Гл. ред. А. М. Прохоров. — М.: Советская энциклопедия, 1988. — Т. 1: Ааронова — Бома эффект — Длинные линии. — 707 с. — 100 000 экз.
- ↑ Cristescu Silvia, Simon Franz. Die spezifischen Wärmen von Beryllium, Germanium und Hafnium bei tiefen Temperaturen (нем.) // Zeitschrift für Physikalische Chemie. — 1934. — Bd. 25B, H. 1. — S. 273—282. — ISSN 2196-7156. — doi:10.1515/zpch-1934-2523.
- ↑ Зейтц Ф. Современная теория твёрдого тела. — М.—Л.: Госиздат технической литературы, 1949. — 736 с.
- ↑ Андреев В. Д. Аномальные пики на кривых теплоёмкости Ge и Hf // Избранные проблемы теоретической физики. — Киев: Аванпост-Прим, 2012. — С. 224—228. Архивировано 3 декабря 2013 года.
- ↑ Ошибка Пентагона. Популярная механика (октябрь 2007). Дата обращения: 11 декабря 2008. Архивировано из оригинала 10 мая 2011 года.
- ↑ Индуцированный распад ядерного изомера 178m2Hf и «изомерная бомба». УФН (май 2005). Архивировано 22 августа 2011 года.
- ↑ Владимир Тесленко, кандидат химических наук. Лучше, чем титан. Материаловеды из «Росатома» создали гафнийсодержащий сплав и технологию его получения. «Коммерсантъ» (13 июня 2019). Дата обращения: 28 апреля 2024.
- ↑ Ученые создали самый тугоплавкий материал. ТАСС (19 мая 2020). Дата обращения: 15 мая 2024.
- ↑ Получен новый материал, имеющий рекордную температуру точки плавления выше 4 тысяч градусов Цельсия. «РИТМ Машиностроения» (11 июня 2020). Дата обращения: 15 мая 2024.
- ↑ SRC говорит о «революции» в полупроводниковой отрасли. iXBT.com (2 февраля 2007). Дата обращения: 17 августа 2013. Архивировано из оригинала 4 марта 2016 года.
- ↑ Исследования в области диэлектриков High-k и металлических затворов. Intel Corporation. Дата обращения: 17 августа 2013. Архивировано из оригинала 26 декабря 2012 года.
- ↑ Инновационное решение, которое устраняет ограничения производительности. Intel Corporation. Дата обращения: 17 августа 2013. Архивировано из оригинала 6 декабря 2012 года.
Литература
[править | править код]- Химия и технология редких и рассеянных элементов. Ч. 2. Под ред К. Большакова. Изд. 2. М.: Высшая школа, 1976.
- Венецкий С.И. "Жил элемент рассеянный"... (Гафний) // О редких и рассеянных (Рассказы о металлах). — Москва: Металлургия, 1980. — 200 000 экз.
Ссылки
[править | править код]- Гафний в Популярной библиотеке химических элементов
- Кельтий // Большая советская энциклопедия : в 66 т. (65 т. и 1 доп.) / гл. ред. О. Ю. Шмидт. — М. : Советская энциклопедия, 1926—1947.
