Димер хлорида золота(III) (:nbyj ]lkjn;g [klkmg(III))
Перейти к навигации
Перейти к поиску
| Димер хлорида золота(III) | |||
|---|---|---|---|
| |||
 | |||
| Общие | |||
| Систематическое наименование |
Димер хлорида золота(III) | ||
| Хим. формула | Au2Cl6 | ||
| Физические свойства | |||
| Состояние | рубиново-красные блестящие кристаллы, раствор имеет оранжевый цвет | ||
| Молярная масса | 606,66 г/моль | ||
| Плотность | 4,3; 4,67 г/см³ | ||
| Термические свойства | |||
| Температура | |||
| • разложения | >175 °C | ||
| Энтальпия | |||
| • образования | −118 кДж/моль | ||
| Классификация | |||
| Рег. номер CAS | 13453-07-1 | ||
| PubChem | 26030 | ||
| Рег. номер EINECS | 236-623-1 | ||
| SMILES | |||
| InChI | |||
| RTECS | MD5420000 | ||
| ChEBI | 30076 | ||
| ChemSpider | 8036939 и 24244 | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Димер хлорида золота(III) — неорганическое соединение, соль металла золота и хлористоводородной кислоты, с формулой Au2Cl6. При нормальных условиях представляет собой блестящие призматические рубиново-красные кристаллы, хорошо растворимые в воде и органических растворителях. Легко восстанавливается до элементарного золота.
Получение
[править | править код]- Действие газообразного хлора на тонкие листочки или порошок золота при нагревании:
- Взаимодействие металлического золота с хлорной водой или с царской водкой:
- Нагревание тетрагидрата золотохлористоводородной кислоты:
- Реакция сжиженного хлора с золотом:
Физические свойства
[править | править код]Димер хлорида золота(III) образует гигроскопичные тёмно-красные призматические кристаллы, моноклинной сингонии, пространственная группа P 21/c, параметры ячейки a = 0,657 нм, b = 1,104 нм, c = 0,644 нм, β = 113,3°, Z = 2.
При нагревании выше 175 °С разлагается, не плавясь.
Хорошо растворяется в воде, спиртах и эфирах.
Химические свойства
[править | править код]- Разлагается при нагревании, причём продукты реакции могут отличаться в зависимости от температуры:
- Разбавленный раствор Au2Cl6 имеет более кислую реакцию, чем концентрированные растворы (красно-коричневого цвета) вследствие гидролиза:
- Взаимодействует с соляной кислотой и растворами солей щелочных металлов:
- Реакция с избытками щелочей приводит к образованию тетрагидроксоауратов:
- Реакция с гидроксидом калия:
- Восстанавливается цинком:
- При небольшом нагревании реагирует с угарным газом:
- Восстанавливается иодом при нормальной температуре:
- Взаимодействует с иодидом калия:
- Реакции с фосфином:
- Реагирует с фосфидом золота(I) и фосфорными кислотами:
- Димер хлорида золота(III) восстанавливается перекисью водорода, причём реакция идёт тем легче, чем pH среды больше:
- В кислых и щелочных растворах Au2Cl6 восстанавливается солями Fe(II). При этом образуется чистое золото:
- Соединение также восстанавливается сернистой кислотой (в кислой или нейтральной среде):
- Восстановление Au2Cl6 (или других солей Au(III)) хлоридом олова(II) в сильнокислой среде даёт коричнево-чёрный мелкодисперсный, а в слабо кислых растворах — пурпурно-розовый осадок коллоидного золота («кассиев пурпур»):
- Осаждается хлоридом сурьмы(III):
- Оксиды свинца PbO и Pb3O4 в нейтральных и щелочных растворах также выделяют из димера чистое золото. В качестве других восстановителей для этого соединения используются сахара, индиго, бензидин и другие органические вещества.
Применение
[править | править код]Вещество применяется для получения других соединений золота, гидрозолей и кассиевого пурпура.
Литература
[править | править код]- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1972. — Т. 2. — 871 с.
- Химическая энциклопедия / Редкол.: Кнунянц И. Л. и др.. — М.: Советская энциклопедия, 1992. — Т. 3. — 639 с. — ISBN 5-82270-039-8.
- Справочник химика / Редкол.: Никольский Б. П. и др.. — 2-е изд., испр. — М.—Л.: Химия, 1966. — Т. 1. — 1072 с.
- Справочник химика / Редкол.: Никольский Б. П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Лидин Р. А. и др. Химические свойства неорганических веществ: Учебное пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
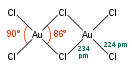

![{\displaystyle {\ce {2Au\ +3Cl2->[245{-}260~^{\circ }{\text{C}}]Au2Cl6{}+56~kcal}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9d826b07740a2db97ace320c2edc111cfdcdf54c)

![{\displaystyle {\ce {2 Au + 3 Cl2 ->[{\ce {H2O}}] Au2Cl6}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6fff9c2452d2760e172aca40a4242ae92dacb4d4)
![{\displaystyle {\ce {2H[AuCl4].4H2O->[120~^{\circ }{\text{C}}]Au2Cl6{}+2HCl{\uparrow }+8H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/50ebdd3bd2f9ea54b214778434a869c81696b8de)
![{\displaystyle {\ce {2Au\ +3Cl2->[80{-}100~^{\circ }{\text{C}}]Au2Cl6}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/973339b674a8174ed3ed7f8434f9add011346f05)
![{\displaystyle {\ce {Au2Cl6->[175~^{\circ }{\text{C}}]2AuCl{}+2Cl2{\uparrow }}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c038a03590978808f9a6d71707a634a16aaf00e6)
![{\displaystyle {\ce {Au2Cl6->[288~^{\circ }{\text{C}}]2Au{}+3Cl2{\uparrow }}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2cbfedf4adaf36a30bcfed2bbc7eab8df2785f9f)
![{\displaystyle {\ce {Au2Cl6 + 2 H2O <=> 2 H2[AuOCl3] <=> 2 [AuOCl3]^{2-}{}+ 4 H+}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a431b7a337e78fb57e85a002f91782cad5120f5f)
![{\displaystyle {\ce {Au2Cl6 + 2 H2O <=> 2 H[AuOHCl3] <=> 2 [AuOHCl3]- + 2 H+}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/893f6f35d47b7fd31cbedc5d23a493d06e44be31)
![{\displaystyle {\ce {Au2Cl6 + 2 HCl + 8 H2O -> 2 H[AuCl4].4H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/806ff7e45edfdb4a9f0caf2d6e8c439d1373a97c)
![{\displaystyle {\ce {Au2Cl6 + 2 NaCl -> 2 Na[AuCl4]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/cef82885c6a5813223947ad79491d182970af430)
![{\displaystyle {\ce {Au2Cl6 + 8 MeOH + 8 H2O -> 2 Me[Au(OH)4].4H2O + 6 MeCl}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7097fbdaf580394b9b752d60a833737790be8149)

![{\displaystyle {\ce {Au2Cl6{}+3Zn->[{\ce {H2O}}]2Au{\downarrow }+3ZnCl2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f11296aebf6965c4805c4c6454723819f2417549)
![{\displaystyle {\ce {Au2Cl6{}+4CO->[55~^{\circ }{\text{C}}]2AuCOCl{}+2COCl2{\uparrow }}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6729c19f54cb04bea5017b7defa24ef9d14ac670)











