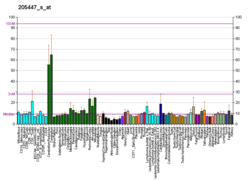
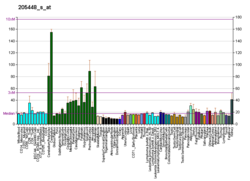
MAP3K12 (MAP3K12)
MAP3K12 («митоген-активируемая белковая киназа киназы киназы 12»; англ. mitogen-activated protein kinase kinase kinase 12, MLK) — цитозольная серин/треониновая протеинкиназа семейства MAP3K, продукт гена MAP3K12[5][6].
Структура
[править | править код]MAP3K12 состоит из 859 аминокислот, молекулярная масса 93,2 кДа. Вторичная структура включает два белковых мотива лейциновая застёжка-молния. Описано 2 изоформы белка, образующиеся в результате альтернативного сплайсинга, также предполагается существование ещё 2 изоформ.
Функция
[править | править код]Белок, кодируемый геном MAP3K12, также обозначается DLK. Член семейства MAP3K серин/треониновая протеинкиназ. MAP3K12 содержит двойной белковый мотив лейциновая застёжка-молния, экспрессирована преимущественно на нейрональных клетках. Фосфорилирование киназы в синаптическом терминале регулируется мембранной деполяризацией за счёт кальцинейрина. Эта киназа образует гетеродимеры за счёт своего домена лейциновая застёжка-молния с белками CREB и MYC. Играет регуляторную роль в нейрональной дифференцировке, индуцированной протеинкиназой A или ретиноевой кислотой[6].
Роль в развитии
[править | править код]MAP3K12 может инициировать координированные сигнальные каскады приводящие к фосфорилированию киназ JNK. Это может играть роль в развитии нервной системы у млекопитающих[7]. В нейрональном развитии критически важными процессами являются миграция нейронов и рост аксонов. Отсутствие MAP3K12 у мышей приводило к нарушению нейрональной миграции, гипоплазии нескольких аксональных трактов и сниженному количеству аксонов в различных областях мозга, таких как пояс и внутренняя капсула[7]. Кроме этого, ингибирование MAP3K12 или JNK задерживает радиальную миграцию и нарушает формирование неокортекса у мыши[7]. Другой важный процесс в развитии нервной системы — апоптоз нейронов. Отсутствие MAP3K12 защищает сенсорные нейроны в клеточной культуре от апоптоза, который в нормальных условиях запускается при отсутствии фактора роста нервов[7].
Взаимодействия
[править | править код]MAP3K12 взаимодействует с MAPK8IP1[8], MAP2K7[9] и MAPK8IP2[8].
Примечания
[править | править код]- ↑ 1 2 3 GRCh38: Ensembl release 89: ENSG00000139625 - Ensembl, May 2017
- ↑ 1 2 3 GRCm38: Ensembl release 89: ENSMUSG00000023050 - Ensembl, May 2017
- ↑ Ссылка на публикацию человека на PubMed: Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ↑ Ссылка на публикацию мыши на PubMed: Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ↑ Reddy UR, Pleasure D (Aug 1994). "Cloning of a novel putative protein kinase having a leucine zipper domain from human brain". Biochem Biophys Res Commun. 202 (1): 613—20. doi:10.1006/bbrc.1994.1972. PMID 8037767.
- ↑ 1 2 Entrez Gene: MAP3K12 mitogen-activated protein kinase kinase kinase 12.
- ↑ 1 2 3 4 Tedeschi A, Bradke F (May 2013). "The DLK signalling pathway—a double-edged sword in neural development and regeneration". EMBO Reports. 14 (7): 605—614. doi:10.1038/embor.2013.64. PMC 3701236. PMID 23681442.
- ↑ 1 2 Yasuda J, Whitmarsh AJ, Cavanagh J, Sharma M, Davis RJ (Oct 1999). "The JIP group of mitogen-activated protein kinase scaffold proteins". Mol. Cell. Biol. 19 (10): 7245—54. doi:10.1128/mcb.19.10.7245. PMC 84717. PMID 10490659.
- ↑ Merritt SE, Mata M, Nihalani D, Zhu C, Hu X, Holzman LB (Apr 1999). "The mixed lineage kinase DLK utilizes MKK7 and not MKK4 as substrate". J. Biol. Chem. 274 (15): 10195—202. doi:10.1074/jbc.274.15.10195. PMID 10187804.
Литература
[править | править код]- Reddy UR, Nycum L, Slavc I, Biegel JA (1995). "Localization of the human zipper protein kinase gene (ZPK) to chromosome 12q13 by fluorescence in situ hybridization and somatic cell hybrid analysis". Genomics. 25 (2): 597—8. doi:10.1016/0888-7543(95)80069-X. PMID 7790002.
- Holzman LB, Merritt SE, Fan G (1995). "Identification, molecular cloning, and characterization of dual leucine zipper bearing kinase. A novel serine/threonine protein kinase that defines a second subfamily of mixed lineage kinases". J. Biol. Chem. 269 (49): 30808—17. PMID 7983011.
- Hirai S, Izawa M, Osada S, Spyrou G, Ohno S (1996). "Activation of the JNK pathway by distantly related protein kinases, MEKK and MUK". Oncogene. 12 (3): 641—50. PMID 8637721.
- Mata M, Merritt SE, Fan G, Yu GG, Holzman LB (1996). "Characterization of dual leucine zipper-bearing kinase, a mixed lineage kinase present in synaptic terminals whose phosphorylation state is regulated by membrane depolarization via calcineurin". J. Biol. Chem. 271 (28): 16888—96. doi:10.1074/jbc.271.28.16888. PMID 8663324.
- Sakuma H, Ikeda A, Oka S, Kozutsumi Y, Zanetta JP, Kawasaki T (1997). "Molecular cloning and functional expression of a cDNA encoding a new member of mixed lineage protein kinase from human brain". J. Biol. Chem. 272 (45): 28622—9. doi:10.1074/jbc.272.45.28622. PMID 9353328.
- Merritt SE, Mata M, Nihalani D, Zhu C, Hu X, Holzman LB (1999). "The mixed lineage kinase DLK utilizes MKK7 and not MKK4 as substrate". J. Biol. Chem. 274 (15): 10195—202. doi:10.1074/jbc.274.15.10195. PMID 10187804.
- Reddy UR, Basu A, Bannerman P, Ikegaki N, Reddy CD, Pleasure D (1999). "ZPK inhibits PKA induced transcriptional activation by CREB and blocks retinoic acid induced neuronal differentiation". Oncogene. 18 (31): 4474—84. doi:10.1038/sj.onc.1202813. PMID 10442638.
- Douziech M, Laberge G, Grondin G, Daigle N, Blouin R (1999). "Localization of the mixed-lineage kinase DLK/MUK/ZPK to the Golgi apparatus in NIH 3T3 cells". J. Histochem. Cytochem. 47 (10): 1287—96. doi:10.1177/002215549904701008. PMID 10490457.
- Fukuyama K, Yoshida M, Yamashita A, Deyama T, Baba M, Suzuki A, Mohri H, Ikezawa Z, Nakajima H, Hirai S, Ohno S (2000). "MAPK upstream kinase (MUK)-binding inhibitory protein, a negative regulator of MUK/dual leucine zipper-bearing kinase/leucine zipper protein kinase". J. Biol. Chem. 275 (28): 21247—54. doi:10.1074/jbc.M001488200. PMID 10801814.
- Hébert SS, Daviau A, Grondin G, Latreille M, Aubin RA, Blouin R (2000). "The mixed lineage kinase DLK is oligomerized by tissue transglutaminase during apoptosis". J. Biol. Chem. 275 (42): 32482—90. doi:10.1074/jbc.M006528200. PMID 10922377.
- Figueroa C, Tarras S, Taylor J, Vojtek AB (2004). "Akt2 negatively regulates assembly of the POSH-MLK-JNK signaling complex". J. Biol. Chem. 278 (48): 47922—7. doi:10.1074/jbc.M307357200. PMID 14504284.
- Itoh A, Wang Z, Ito Y, Reddy UR, Itoh T (2004). "SP3 acts as a positive regulator on the core promoter of human ZPK gene". Biochem. Biophys. Res. Commun. 313 (3): 612—8. doi:10.1016/j.bbrc.2003.11.152. PMID 14697235.
- Graves PR, Winkfield KM, Haystead TA (2005). "Regulation of zipper-interacting protein kinase activity in vitro and in vivo by multisite phosphorylation". J. Biol. Chem. 280 (10): 9363—74. doi:10.1074/jbc.M412538200. PMID 15611134.
- Robitaille H, Proulx R, Robitaille K, Blouin R, Germain L (2005). "The mitogen-activated protein kinase kinase kinase dual leucine zipper-bearing kinase (DLK) acts as a key regulator of keratinocyte terminal differentiation". J. Biol. Chem. 280 (13): 12732—41. doi:10.1074/jbc.M411619200. PMID 15695824.
- Stelzl U, Worm U, Lalowski M, Haenig C, Brembeck FH, Goehler H, Stroedicke M, Zenkner M, Schoenherr A, Koeppen S, Timm J, Mintzlaff S, Abraham C, Bock N, Kietzmann S, Goedde A, Toksöz E, Droege A, Krobitsch S, Korn B, Birchmeier W, Lehrach H, Wanker EE (2005). "A human protein-protein interaction network: a resource for annotating the proteome". Cell. 122 (6): 957—68. doi:10.1016/j.cell.2005.08.029. hdl:11858/00-001M-0000-0010-8592-0. PMID 16169070. S2CID 8235923.