FANTOM (FANTOM)
FANTOM (англ. FANTOM — Functional Annotation of the Mammalian Genome, рус. Функциональная аннотация геномов млекопитающих) — международный исследовательский консорциум, основанный доктором Хаяшизаки[1] и его коллегами в 2000 году с целью функционального аннотирования[англ.] полноразмерных кДНК, которые были собраны в ходе проекта Mouse Encyclopedia[2] в научном центре RIKEN. С тех пор FANTOM стал самостоятельным и развитым проектом, который затрагивает разные сферы анализа транскриптомов. Цель проекта — прийти от понимания «элементов» — транскриптов к понимания «системы» — транскрипционной регуляторной сети[3].
Этапы работы проекта: история и публикации
[править | править код]FANTOM1
[править | править код]The RIKEN Mouse Gene Encyclopaedia Project[2] — проект, методы которого позволяют определить содержит ли геном мыши кодирующую ДНК. В ходе данного проекта, работа которого началась в 1995 году, была получена коллекция последовательностей полноразмерных кДНК с последующим картированием соответствующих генов на геноме мыши. Следствием этого проекта стало основание ассоциации FANTOM в 2000 году с целью аннотирования первых 21076 кДНК. Эта коллекция кДНК стала одной из крупнейших для какого-либо организма на тот момент. Анализ этих кДНК расширил уже существующие семейства генов[англ.] и определил новые[4].
В ходе первого этапа работы консорциума была разработана эффективная система функциональной аннотации генов, основанная на разработанных de novo правилах и методах. Основные результаты были опубликованы в журнале Nature в 2001 году[4].
Технология получения полноразмерных кДНК
[править | править код]Данный протокол, разработанный в ходе проекта Mouse Encyclopedia[2], является усовершенствованной версией существовавшего на тот момент метода получения полноразмерных кДНК. Данные, полученные этой технологией, были проаннотированы в рамках проекта FANTOM1[5]. Общий вид последовательных стадий можно представить следующим образом[6]:
- Экстракция РНК из клеток;
- Синтез полноразмерных кДНК;
- Селекция полноразмерных кДНК;
- Нормировка;
- Клонирование;
- Секвенирование;
- Компьютерный анализ.
Трегалозный метод синтеза полноразмерных кДНК
[править | править код]Раньше одной из самых больших трудностей получения полноразмерных кДНК являлась неэффективность работы ревертазы при синтезе второй цепи. Было показано, что добавление трегалозы значительно увеличивает термостабильность и активность фермента. Это открытие позволило проводить ревертазные реакции при 60 °C вместо 42 °С, как раньше. При температуре 60 °C вторичная структура РНК из образца подплавляется и участок на 5'-конце мРНК становится доступным для транскрипции[7].
Метод биотинилированной кэп-ловушки для отсеивания неполноразмерных кДНК
[править | править код]Метод разработан для селекции только полноразмерных кДНК. Сначала кэп, который есть на 5'-конце всех эукариотических мРНК биотинилируется. Затем происходит обратная транскрипция, и одноцепочечнаяРНК подвергается деградации. Если траскрипция кДНК прервалась, то после расщепления одноцепочечных участков биотин на их 5'-конце будет отсутствовать. Оставшиеся полноразмерные кДНК с биотинилированным кэпом «вылавливаются» стрептавидиновыми бусинами. Затем в щелочной среде цепи ДНК элюируются[англ.] и производится достраивание второй цепи ДНК[8].
Вектор для клонирования
[править | править код]Проблема того, что короткие мРНК более вероятно будут иметь больше клонов, чем более длинные, была решена разработкой нового вектора, подходящего для клонирования кДНК размером от 6 тысяч пар оснований (п. о.) до 20 кб, — λFlcIII-L. Этот вектор был усовершенствован (фоновое лигирование снижено практически до нуля) и назван λFlcIV. Именно он использовался для клонирования[9].
Нормировка
[править | править код]Так как от 50 до 60 % всей РНК клетки соответствуют генам домашнего хозяйства, то для оценки относительно низкого уровня РНК необходимо нормализовать библиотеки[англ.] частоты встречаемости конкретных кДНК[9].
FANTOM2
[править | править код]После первого съезда консорциума FANTOM, группа из RIKEN продолжила создание мышиных полноразмерных кДНК. В ходе второй фазы были определены последовательности и созданы функциональные аннотации для этого набора из 60770 полноразмерных кДНК мыши. Это стало первым всемирным проектом по стандартизации полноразмерных кДНК млекопитающих[10].
Проект FANTOM2[11] можно подразделить на три этапа: собрания «Typhoon», телеконференции MATRICS и собрания «Cherry Blossom».
Собрание «Typhoon»
[править | править код]Собрание «Typhoon» было проведено 15—19 октября 2001 года. Обсуждались стратегии и правила аннотации для более эффективного аннотирования с использованием информации о профилях экспрессии, картирования и данных о белок-белковых взаимодействиях, а также традиционного выравнивания последовательностей. В качестве тестовой выборки для встречи «Typhoon» FANTOM2 были подготовлены и проанализированы 46000 последовательностей[12].
MATRICS (Mouse Annotation Teleconference for RIken CDNA Sequences)
[править | править код]MATRICS (от англ. Mouse Annotation Teleconference for RIken CDNA Sequences) — телеконференция, в ходе которой кураторы аннотировали последовательности кДНК из RIKEN через Интернет, используя систему защищённых серверов и систему FANTOM[13] .
Собрание «Cherry Blossom»
[править | править код]После MATRICS была проведена встреча «Cherry Blossom» (с 29 апреля по 4 мая 2002 года) для доклада и обсуждения результатов функциональных аннотаций и биологически интересных находок[10].
По результатам была опубликована статья в журнале Nature в 2002 году[14].
FANTOM3
[править | править код]Аналогично двум другим этапам были проведены встречи до начала работы (Tanabata Meeting: 04.07 — 08.07.2004, RIKEN, GSC, Япония) и после окончания работы проекта (Harvest Meeting: 10.09 — 15.09.2004, RIKEN, Япония)[15].
В FANTOM3[16] для получения данных, которые раскрывают динамическое регулирование транскриптома, была изменена стратегия аннотации[17]. В частности, были подготовлены новые наборы данных для:
- Идентификации новых полноразмерных кДНК для 103000 клонов;
- Детерминирования и аннотирования транскриптов, транскрипционных единиц, анализа их сложности и экспрессии;
- Экспериментальной идентификации стартовых позиций инициации транскрипции и её терминации, а также вычисления сложности человеческого транскриптома;
- Выявления промоторов.
Таким образом, помимо подготовления новых данных для более функционального анализа транскриптома, идентификации и аннотирования новых и низкоуровневых мРНК, конечной целью FANTOM3 было функционально аннотировать сложность транскриптома (определить разнообразие транскриптов), идентифицировать стартовые сайты инициации транскрипции, сайты терминации транскрипции, а также промоторы. Ещё одним аспектом понимания сложности транскриптома было осмысление некодирущих РНК, которые составляют до половины транскриптома. В новвовведения входили также технологии CAGE, GIS (от англ. Gene Identification Signature) и GSC (от англ. Genome Signature Cloning)[18].
MATRICS-RELOADED
[править | править код]103000 полноразмерных кДНК были аннотированы в ходе телеконференции MATRICS-RELOADED, аналогичной MATRICS FANTOM2. В телемосте участвовало свыше 100 учёных со всего мира[15]. Функциональные аннотации полноразмерных кДНК можно найти на сервере FANTOM3[19].
Технология CAGE
[править | править код]Технология кэп-анализа экспрессии генов (CAGE) позволяет проводить высокопроизводительный анализ экспрессии генов, получать профили участков транскрипции[15].
Применение новой технологии CAGE показало, что более чем 63 % генома (а не около 1,5 % белок-кодирующих экзонов, как считалось ранее) транскрибируется с образованием РНК. Также было обнаружено более 23000 некодирующих РНК и что более 73 % генов могут подвергаться смысловой и антисмысловой транскрипции. Также был начат анализ кДНК и профилей экспрессии генов человека[20][21].
FANTOM4
[править | править код]Для работы четвёртой фазы проекта динамические паттерны экспрессии генов мРНК, микроРНК и активности промоторов были измерены для дифференцирующихся клеток миелоидной лейкемии человека — клеточной линии[англ.] THP-1[англ.][22].
Во время работы этого этапа для мониторинга динамики использования точек инициации транскрипции (англ. transcription start site, TSS) в ходе клеточной дифференцировки использовалась технология deepCAGE[23]. Для построения модели транскрипционной регуляторной сети были использованы предсказанные сайты связывания транскрипционных факторов и данные об уровнях активности промоторов. Благодаря этому стало возможным предсказывать регуляторные границы (EDGES) между транскрипционным фактором и целевым промотором, делать выводы о регуляции транскрипции с исследуемого промотора определённым транскрипционным фактором. На основе этих данных была разработана EDGE EXPRESS DB[24], в которой можно найти регуляционные сети одного или нескольких интересующих генов[25].
Также были созданы геномные браузеры[англ.][26] для графического отображения в геноме мыши или человека важных мест, таких как промоторы, экзоны, места ацетилирования гистона H3[англ.] (H3K9ac[англ.]) и сайты связывания транскрипционных факторов[27][28].
FANTOM5
[править | править код]Информация в этом разделе устарела. |
Эта стадия проекта по поиску общих правил клеточной дифференциации, полностью основанная на опыте предыдущих стадий, на 2020 год еще продолжается. Главной целью является систематическое исследование наборов генов, используемых при кодировании большинства типов клеток. Создаётся карта основных промоторв человека и относительная модель транскрипционной сети регуляции каждого клеточного состояния. Для этого используется deepCAGE[23] секвенирование РНК, выделенных из всех основных органов человека и более 200 раковых клеточных линий[29].
В ходе первой фазы были получены карты для наборов транскриптов, транскрипционных факторов, промоторов и энхансеров, активных в большинстве первичных клеток млекопитающих и части раковых клеточных линий[30][31]. Примерно 30 публикаций этой фазы проекта описывают такие разные результаты, как первичные клетки, семейства генов, полногеномные исследования и новые биоинформатические инструменты[29].
В ходе второй фазы сравнительный анализ уровней РНК в разных типах клеток показал, что когда клетка дифференцируется, первичная активация этого процесса случается в энхансерных участках ДНК[32][33].
Существуют серьёзные споры о том, являются ли тысячи длинных некодирующих РНК, транскрибируемые с наших геномов, функциональными или просто побочными продуктами шумового транскрипционного механизма. Учёные из консорциума FANTOM5 под руководством RIKEN использовали технологию, известную как CAGE, для создания атласа длинных некодирующих РНК человека с точными 5'-концами и суммировали их паттерны экспрессии по основным типам клеток. При публикации после пересечения этого атласа экспрессии с другими генетическими и геномными наборами данных (другими атласами экспрессии) авторы предположили, что многие из этих длинных некодирующих РНК могут быть функциональными, так как были показаны пересечения атласов[34].
CAGE в большой коллекции первичных типов клеток показал, что многие промоторы млекопитающих представляют собой составные объекты, состоящие из множества близко расположенных точек инициаций транскрипций, с независимыми профилями экспрессии, специфичными для типа клеток. Атлас экспрессии, ориентированный на промотор FANTOM5[29], обеспечивает профили экспрессии для большинства кодирующих и некодирующих транскриптов в геномах человека и мыши[30].
С помощью FANTOM5[29] был получен транскриптом свежеизолированных тучных клеток кожи человека. Тучные клетки уникальны в гемопоэтической линии и только отдалённо связаны с базофилами. Было показано, что тучные клетки экспрессируют BMP-рецепторы и что BMP может способствовать выживанию и восстановлению после стимуляции тучных клеток человека[35].
-
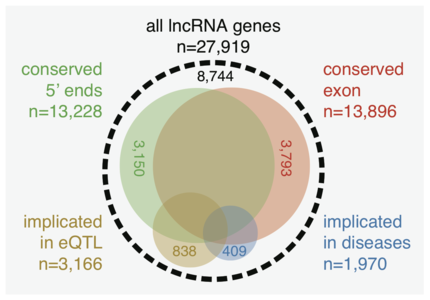
Атлас длинных некодирующих РНК человека
-
Атлас экспрессии промоторов млекопитающих
-
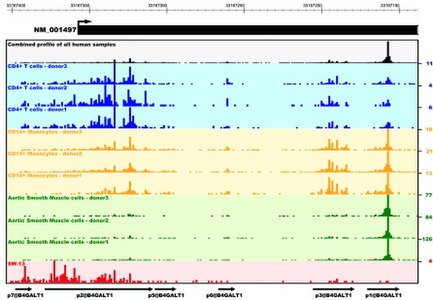
Переоценка транскриптома тучных клеток человека методом deepCAGE
FANTOM6
[править | править код]В настоящее время проводится исследование FANTOM6, целью которого является систематическая характеристика роли днкРНК в геноме человека. Биологическая функция этих больших (более 200 нуклеотидов) и нетранслируемых РНК в значительной степени неизвестна. На основании нескольких работ, посвященных днкРНК, считается, что они участвуют в регуляции транскрипции, трансляции, посттрансляционных модификациях и эпигенетических метках. Однако текущие знания о масштабах и диапазоне этих предполагаемых регуляторных взаимодействий являются рудиментарными.
Этот раздел статьи ещё не написан. |
Доступность данных
[править | править код]Интерактивные базы данных (interactive viewer, data exporter) и все файлы за время работы всех стадий проекта находятся в свободном доступе в общей базе данных FANTOM[36].
Все полноразмерные кДНК клоны доступны в Dnaform, Invitrogen, RZPD и Gene Service[37][38][39].
Примечания
[править | править код]- ↑ Bonetta Laura. Profile of Yoshihide Hayashizaki, M.D., Ph.D. (англ.) // BioTechniques. — 2005. — March (vol. 38, no. 3). — P. 339. — ISSN 0736-6205. — doi:10.2144/05383SP01.
- ↑ 1 2 3 A new tool for tracking the tiniest changes | RIKEN (англ.). RIKEN. Дата обращения: 21 мая 2020.
- ↑ FANTOM (англ.). FANTOM. Дата обращения: 21 мая 2020. Архивировано 15 июня 2020 года.
- ↑ 1 2 The RIKEN Genome Exploration Research Group Phase II Team and the FANTOM Consortium. Functional annotation of a full-length mouse cDNA collection (англ.) // Nature. — 2001. — February (vol. 409, no. 6821). — P. 685—690. — ISSN 0028-0836. — doi:10.1038/35055500.
- ↑ Michiel de Hoon, Jay W. Shin, Piero Carninci. Paradigm shifts in genomics through the FANTOM projects // Mammalian Genome. — 2015. — Т. 26, вып. 9—10. — С. 391—402. — ISSN 0938-8990. — doi:10.1007/s00335-015-9593-8.
- ↑ Chen Nan, Wang Wei-Min, Wang Huan-Ling. An efficient full-length cDNA amplification strategy based on bioinformatics technology and multiplexed PCR methods (англ.) // Scientific Reports. — 2016. — 13 January (vol. 6, no. 1). — ISSN 2045-2322. — doi:10.1038/srep19420.
- ↑ Carninci P., Nishiyama Y., Westover A., Itoh M., Nagaoka S., Sasaki N., Okazaki Y., Muramatsu M., Hayashizaki Y. Thermostabilization and thermoactivation of thermolabile enzymes by trehalose and its application for the synthesis of full length cDNA (англ.) // Proceedings of the National Academy of Sciences. — 1998. — 20 January (vol. 95, no. 2). — P. 520—524. — ISSN 0027-8424. — doi:10.1073/pnas.95.2.520.
- ↑ Carninci Piero, Kvam Catrine, Kitamura Akiko, Ohsumi Tomoya, Okazaki Yasushi, Itoh Mitsuteru, Kamiya Mamoru, Shibata Kazuhiro, Sasaki Nobuya, Izawa Masaki, Muramatsu Masami, Hayashizaki Yoshihide, Schneider Claudio. High-Efficiency Full-Length cDNA Cloning by Biotinylated CAP Trapper (англ.) // Genomics. — 1996. — November (vol. 37, no. 3). — P. 327—336. — ISSN 0888-7543. — doi:10.1006/geno.1996.0567.
- ↑ 1 2 Carninci Piero, Shibata Yuko, Hayatsu Norihito, Itoh Masayoshi, Shiraki Toshiyuki, Hirozane Tomoko, Watahiki Akira, Shibata Kazuhiro, Konno Hideaki, Muramatsu Masami, Hayashizaki Yoshihide. Balanced-Size and Long-Size Cloning of Full-Length, Cap-Trapped cDNAs into Vectors of the Novel λ-FLC Family Allows Enhanced Gene Discovery Rate and Functional Analysis (англ.) // Genomics. — 2001. — September (vol. 77, no. 1-2). — P. 79—90. — ISSN 0888-7543. — doi:10.1006/geno.2001.6601.
- ↑ 1 2 История FANTOM2. FANTOM. Дата обращения: 11 мая 2020. Архивировано 21 ноября 2018 года.
- ↑ FANTOM2. FANTOM. Дата обращения: 21 мая 2020. Архивировано 25 марта 2020 года.
- ↑ Kasukawa T. Development and Evaluation of an Automated Annotation Pipeline and cDNA Annotation System (англ.) // Genome Research. — 2003. — 2 June (vol. 13, no. 6). — P. 1542—1551. — ISSN 1088-9051. — doi:10.1101/gr.992803.
- ↑ Online resources for MATRICS FANTOM2. FANTOM. Дата обращения: 21 мая 2020. Архивировано 30 августа 2016 года.
- ↑ The FANTOM Consortium and the RIKEN Genome Exploration Research Group Phase I & II Team. Analysis of the mouse transcriptome based on functional annotation of 60,770 full-length cDNAs (англ.) // Nature. — 2002. — December (vol. 420, no. 6915). — P. 563—573. — ISSN 0028-0836. — doi:10.1038/nature01266.
- ↑ 1 2 3 История FANTOM3. FANTOM3. Дата обращения: 21 мая 2020. Архивировано 8 мая 2021 года.
- ↑ FANTOM3. FANTOM3. Дата обращения: 21 мая 2020. Архивировано 1 декабря 2019 года.
- ↑ Стратегия аннотации FANTOM3. FANTOM. Дата обращения: 21 мая 2020. Архивировано 21 мая 2017 года.
- ↑ Maeda Norihiro, Kasukawa Takeya, Oyama Rieko, Gough Julian, Frith Martin, Engström Pär G, Lenhard Boris, Aturaliya Rajith N, Batalov Serge, Beisel Kirk W, Bult Carol J, Fletcher Colin F, Forrest Alistair R. R, Furuno Masaaki, Hill David, Itoh Masayoshi, Kanamori-Katayama Mutsumi, Katayama Shintaro, Katoh Masaru, Kawashima Tsugumi, Quackenbush John, Ravasi Timothy, Ring Brian Z, Shibata Kazuhiro, Sugiura Koji, Takenaka Yoichi, Teasdale Rohan D, Wells Christine A, Zhu Yunxia, Kai Chikatoshi, Kawai Jun, Hume David A, Carninci Piero, Hayashizaki Yoshihide. Transcript Annotation in FANTOM3: Mouse Gene Catalog Based on Physical cDNAs (англ.) // PLoS Genetics. — 2006. — 28 April (vol. 2, no. 4). — P. e62. — ISSN 1553-7404. — doi:10.1371/journal.pgen.0020062.
- ↑ Сервер FANTOM3. FANTOM. Дата обращения: 21 мая 2020. Архивировано 15 августа 2020 года.
- ↑ RIKEN Genome Exploration Research Group and Genome Science Group (Genome Network Project Core Group) and the FANTOM Consortium. Antisense Transcription in the Mammalian Transcriptome (англ.) // Science. — 2005. — 2 September (vol. 309, no. 5740). — P. 1564—1566. — ISSN 0036-8075. — doi:10.1126/science.1112009.
- ↑ The FANTOM Consortium. The Transcriptional Landscape of the Mammalian Genome (англ.) // Science. — 2005. — 2 September (vol. 309, no. 5740). — P. 1559—1563. — ISSN 0036-8075. — doi:10.1126/science.1112014.
- ↑ Suzuki Harukazu, Carninci Piero, Daub Carsten, Kawai Jun, Hayashizaki Yoshihide. Beyond the FANTOM4 (англ.) // Genome Biology. — 2010. — Vol. 11, no. Suppl 1. — P. O11. — ISSN 1465-6906. — doi:10.1186/gb-2010-11-s1-o11.
- ↑ 1 2 DeepCAGE. FANTOM. Дата обращения: 21 мая 2020. Архивировано 20 декабря 2019 года.
- ↑ EDGE EXPRESS DB. FANTOM. Дата обращения: 21 мая 2020. Архивировано 6 апреля 2022 года.
- ↑ The FANTOM Consortium, Riken Omics Science Center. The transcriptional network that controls growth arrest and differentiation in a human myeloid leukemia cell line (англ.) // Nature Genetics. — 2009. — 19 April (vol. 41, no. 5). — P. 553—562. — ISSN 1061-4036. — doi:10.1038/ng.375.
- ↑ Геномные браузеры. FANTOM. Дата обращения: 21 мая 2020. Архивировано 31 октября 2020 года.
- ↑ Human (hg18) genome viewer for THP-1 analysis [Release 2009/03/02]: chr16:31160546..31269948. RIKEN. Дата обращения: 14 мая 2020. Архивировано 31 октября 2020 года.
- ↑ Hideya Kawaji, Jessica Severin, Marina Lizio, Andrew Waterhouse, Shintaro Katayama. The FANTOM web resource: from mammalian transcriptional landscape to its dynamic regulation // Genome Biology. — 2009-04-19. — Т. 10, вып. 4. — С. R40. — ISSN 1474-760X. — doi:10.1186/gb-2009-10-4-r40.
- ↑ 1 2 3 4 DGT PR. FANTOM5 (англ.). FANTOM. Дата обращения: 11 мая 2020. Архивировано 2 мая 2020 года.
- ↑ 1 2 The FANTOM Consortium and the RIKEN PMI and CLST (DGT). A promoter-level mammalian expression atlas (англ.) // Nature. — 2014. — March (vol. 507, no. 7493). — P. 462—470. — ISSN 0028-0836. — doi:10.1038/nature13182.
- ↑ Andersson Robin, The FANTOM Consortium, Gebhard Claudia, Miguel-Escalada Irene, Hoof Ilka, Bornholdt Jette, Boyd Mette, Chen Yun, Zhao Xiaobei, Schmidl Christian, Suzuki Takahiro, Ntini Evgenia, Arner Erik, Valen Eivind, Li Kang, Schwarzfischer Lucia, Glatz Dagmar, Raithel Johanna, Lilje Berit, Rapin Nicolas, Bagger Frederik Otzen, Jørgensen Mette, Andersen Peter Refsing, Bertin Nicolas, Rackham Owen, Burroughs A. Maxwell, Baillie J. Kenneth, Ishizu Yuri, Shimizu Yuri, Furuhata Erina, Maeda Shiori, Negishi Yutaka, Mungall Christopher J., Meehan Terrence F., Lassmann Timo, Itoh Masayoshi, Kawaji Hideya, Kondo Naoto, Kawai Jun, Lennartsson Andreas, Daub Carsten O., Heutink Peter, Hume David A., Jensen Torben Heick, Suzuki Harukazu, Hayashizaki Yoshihide, Müller Ferenc, Forrest Alistair R. R., Carninci Piero, Rehli Michael, Sandelin Albin. An atlas of active enhancers across human cell types and tissues (англ.) // Nature. — 2014. — March (vol. 507, no. 7493). — P. 455—461. — ISSN 0028-0836. — doi:10.1038/nature12787.
- ↑ Arner Erik et al. Transcribed enhancers lead waves of coordinated transcription in transitioning mammalian cells (англ.) // Science. — 2015. — 12 February (vol. 347, no. 6225). — P. 1010—1014. — ISSN 0036-8075. — doi:10.1126/science.1259418.
- ↑ Marina Lizio, Jayson Harshbarger, Imad Abugessaisa, Shuei Noguchi, Atsushi Kondo. Update of the FANTOM web resource: high resolution transcriptome of diverse cell types in mammals // Nucleic Acids Research. — 2017-01-04. — Т. 45, вып. Database issue. — С. D737–D743. — ISSN 0305-1048. — doi:10.1093/nar/gkw995.
- ↑ Hon Chung-Chau, Ramilowski Jordan A., Harshbarger Jayson, Bertin Nicolas, Rackham Owen J. L., Gough Julian, Denisenko Elena, Schmeier Sebastian, Poulsen Thomas M., Severin Jessica, Lizio Marina, Kawaji Hideya, Kasukawa Takeya, Itoh Masayoshi, Burroughs A. Maxwell, Noma Shohei, Djebali Sarah, Alam Tanvir, Medvedeva Yulia A., Testa Alison C., Lipovich Leonard, Yip Chi-Wai, Abugessaisa Imad, Mendez Mickaël, Hasegawa Akira, Tang Dave, Lassmann Timo, Heutink Peter, Babina Magda, Wells Christine A., Kojima Soichi, Nakamura Yukio, Suzuki Harukazu, Daub Carsten O., de Hoon Michiel J. L., Arner Erik, Hayashizaki Yoshihide, Carninci Piero, Forrest Alistair R. R. An atlas of human long non-coding RNAs with accurate 5′ ends (англ.) // Nature. — 2017. — March (vol. 543, no. 7644). — P. 199—204. — ISSN 0028-0836. — doi:10.1038/nature21374.
- ↑ Motakis Efthymios, Guhl Sven, Ishizu Yuri, Itoh Masayoshi, Kawaji Hideya, de Hoon Michiel, Lassmann Timo, Carninci Piero, Hayashizaki Yoshihide, Zuberbier Torsten, Forrest Alistair R. R., Babina Magda. Redefinition of the human mast cell transcriptome by deep-CAGE sequencing (англ.) // Blood. — 2014. — 24 April (vol. 123, no. 17). — P. e58—e67. — ISSN 0006-4971. — doi:10.1182/blood-2013-02-483792.
- ↑ FANTOM database. FANTOM. Дата обращения: 21 мая 2020. Архивировано 25 марта 2020 года.
- ↑ RIKEN Human cDNA Clones | K.K. DNAFORM. DNAFORM. Дата обращения: 21 мая 2020. Архивировано 14 июня 2016 года.
- ↑ Cloning - US (англ.). Thermo Fisher Scientific. Дата обращения: 21 мая 2020. Архивировано 28 мая 2020 года.
- ↑ Tips on Finding cDNA Clones. NCBI. Дата обращения: 21 мая 2020. Архивировано 23 октября 2020 года.