Антисмысловые РНК (Gumnvbdvlkfdy JUT)
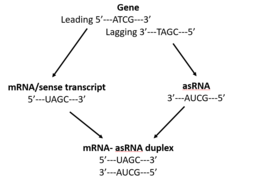
Антисмысловы́е РНК (англ. Antisense RNA) — одноцепочечные РНК, которые комплементарны мРНК, транскрибируемой в клетке, или гену-мишени. Механизмы действия антисмысловых РНК весьма разнообразны, они могут как подавлять, так и активировать экспрессию гена-мишени. Природные антисмысловые РНК есть и у прокариот, и у эукариот[1]; они относятся к длинным некодирующим РНК как РНК длиной более 200 нуклеотидов[2]. Синтетические антисмысловые РНК нашли широкое применение у исследователей в качестве инструмента для нокдауна генов. Антисмысловые РНК также находят медицинское применение[3][1][2].
История изучения
[править | править код]Первые антисмысловые РНК были открыты при изучении функциональных белков. Например, при изучении порина внешней мембраны ompC кишечной палочки Escherichia coli было показано, что некоторые промоторы этого гена могут подавлять экспрессию других мембранных поринов, таких как ompF. Оказалось, что собственно в подавлении участвует участок длиной 300 нуклеотидов, расположенный выше промотора ompC. Он на 70 % гомологичен последовательности 5'-концевой части мРНК ompF, и считанный с него транскрипт (micF) может связываться с ней за счёт комплементарного взаимодействия. Оказалось, что в условиях стресса происходит экспрессия micF, который формирует дуплекс с мРНК ompF, вызывая её деградацию[4].
В отличие от micF, открытого случайно, большинство антисмысловых РНК были открыты входе целенаправленного полногеномного поиска малых регуляторных РНК и анализа транскриптома. Однако большинство алгоритмов анализа рассматривают только межгенные участки, и антисмысловые РНК, считанные с цепи ДНК, противоположной матричной (кодирующей цепи) в области кодирующей области, остаются неучтёнными. Для обнаружения таких антисмысловых РНК можно использовать олигонуклеотидные чипы. Для того чтобы минимизировать количество ложноположительных результатов, в последнее время активно разрабатываются методы изучения транскрипции, специфичной для одной из цепей, некодирующих РНК, взаимодействующих с хроматином, и РНК одиночных клеток[англ.][1].
Идея об использовании антисмысловых РНК в медицине впервые была высказана в 1978 году, когда Zamecnik и Stephenson получили антисмысловые олигонуклеотиды, комплементарные РНК вируса саркомы Рауса[англ.]. Оказалось, что они подавляли вирусную репликацию и синтез вирусных белков. С тех пор на разработку медицинского применения антисмысловых РНК были брошены колоссальные усилия. Первый препарат такого рода, фомивирсен, был одобрен FDA в 1998 году. Он был предназначен для лечения цитомегаловирусного ретинита у пациентов со СПИДом. Однако в 2004 году препарат был снят с производства из-за потери рынка[5].
Распространение и функции
[править | править код]Первые антисмысловые РНК были обнаружены в бактериальных клетках. Они кодировались плазмидами, геномами самих бактерий и бактериофагов. Например, антисмысловая РНК, известная как РНК I, считывается с плазмиды ColE1 и играет важную роль в определении числа копий плазмид и контролирует их репликацию. Для репликации плазмиды ColE1, кроме того, необходима другая антисмысловая РНК (РНК II). Она гибридизуется с ДНК и выступает в роли праймера при репликации, а после разрушается РНКазой H. Если РНК II не удаётся гибридизоваться с ДНК ColE1, то число копий этой плазмиды уменьшается. У бактериофага P22[англ.] антисмысловая РНК sar регулирует переход от лизогенного цикла к литическому, контролируя экспрессию белка Ant[6]. Антисмысловые РНК также обнаружены у растений. Самая изученная растительная антисмысловая РНК считывается с гена FLC. У Arabidopsis thaliana этому гену соответствует транскрипционный фактор, подавляющий экспрессию ряда генов, стимулирующих цветение. В холодных условиях экспрессируется антисмысловая РНК этого гена, известная как COOLAIR. Она подавляет экспрессию FLC, модифицируя хроматин, что вызывает цветение[7]. В клетках млекопитающих типичным примером действия антисмысловых РНК является инактивация X-хромосомы. Антисмысловая РНК Xist привлекает репрессивный комплекс polycomb 2 (PRC2[англ.]) к одной из X-хромосом, что вызывает её гетерохроматинизацию[8].
Классификация
[править | править код]Антисмысловые РНК можно классифицировать по-разному. Некоторые авторы подразделяют их на антисмысловые РНК, взаимодействующие с РНК, с ДНК и с белками[8]. Их также можно классифицировать по типу промотора, с которого начинается их экспрессия: независимые промоторы, двунаправленные промоторы или криптические промоторы. Фактором классификации антисмысловых РНК также может выступать длина. Хотя большинство антисмысловых РНК имеют длину более 200 нуклеотидов и, следовательно, относятся к длинным некодирующим РНК, некоторые из них существенно короче. Поскольку большинство механизмов действия антисмысловых РНК специфичны для конкретных биологических видов, их можно разделять и по видам. Однако наиболее распространённая классификация антисмысловых РНК построена на том, как транскрипция этих РНК соотносится с их генами-мишенями[1].
Цис-регуляторные антисмысловые РНК транскрибируются в том же локусе, что и мРНК-мишень, но с противоположной цепи ДНК. По этой причине они нередко почти полностью комплементарны гену-мишени. Если действие цис-регуляторных антисмысловых РНК связано с мРНК, то мишенями одной антисмысловой РНК может быть только одна мРНК. Действие таких антисмысловых РНК на мРНК выражается в блокировании доступа рибосомы к мРНК или в привлечении РНКазы, разрушающей мРНК[4]. Среди цис-регуляторных антисмысловых РНК есть также эпигенетические сайленсеры и активаторы. Они могут вызывать эпигенетические изменения в локусе, с которого они были транскрибированы. Они могут привлекать к локусу-мишени белки, модифицирующие хроматин, что может сказаться на экспрессии не только гена-мишени, но и соседних генов[8].
Транс-регуляторные антисмысловые РНК транскрибируются с локусов, удалённых от генов-мишеней. В отличие от цис-регуляторных РНК, они слабо комплементарны гену-мишени, однако могут быть длиннее цис-регуляторных РНК. Их мишенями также могут быть несколько локусов. Из-за неполной комплементарности комплексы транс-регуляторных антисмысловых РНК с транскриптами-мишенями не очень стабильны, и для функционирования таких РНК нередко нужны РНК-шапероны. Из-за сложности действия транс-регуляторные РНК почти не рассматривают в качестве потенциальных мишеней лекарственных препаратов[4].
Механизмы
[править | править код]
Многие антисмысловые РНК подавляют транскрипцию генов-мишеней при помощи эпигенетических механизмов. Например, они могут вызывать метилирование ДНК, что нередко связано с болезнями. Так, при альфа-талассемии[англ.] экспрессия гена гемоглобина α1 (HBA1[англ.]) подавляется ненормальным транскриптом гена LUC71. Он выступает в роли антисмысловой РНК и вызывает метилирование промотора HBA1. При острой лимфобластной лейкемии и острой миелоидной лейкемии происходит сайленсинг гена-супрессора опухолей p15INK4b. Он вызван антисмысловой РНК ANRIL[англ.], которая считывается с того же локуса, что и p15INK4b[8]. Антисмысловые РНК также могут вызывать метилирование гистонов, что может приводить как к репрессии, так и к активации генов[9]. Например, ANRIL не только запускает метилирование ДНК, но и репрессирует соседние гены CDKN2B[англ.] и CDKN2A[англ.], привлекая к ним PRC2, вносящий репрессивную эпигенетическую метку (H3K27me). Ещё один пример — инактивация X-хромосомы у млекопитающих антисмысловой РНК Xist[1]. Вызываемые антисмысловыми РНК изменения хроматина могут быть и транс-регуляторными. Например, у млекопитающих антисмысловая РНК HOTAIR[англ.] считывается с гена гомеобокса C (HOXC), но привлекает PRC2 к HOXD. HOTAIR активно экспрессируется в клетках первичного рака груди[1].
Антисмысловые РНК могут включаться в регуляцию экспрессии гена не только на этапе инициации транскрипции, но и на её элонгации и терминации. Например, у прокариот и эукариот иногда имеет место двунаправленная транскрипция, когда две РНК-полимеразы считывают один и тот же ген с противоположных цепей. В конце концов они сталкиваются, что приводит к преждевременной терминации транскрипции. Даже если полимеразы движутся медленно и их столкновение маловероятно, они могут остановиться, преждевременно обрывая элонгацию транскрипции, что также приводит к сайленсингу гена. По такому механизму ген IME4 репрессируется антисмысловой РНК RME2. Антисмысловые РНК также могут нарушать сплайсинг. Так, для трансляции мРНК гена ZEB2[англ.] необходим IRES, расположенный в одном из интронов. Когда происходит экспрессия антисмысловой РНК этого гена, она маскирует сайт сплайсинга, из-за чего IRES не удаляется из транскрипта, благодаря чему происходит эффективная трансляция. Наконец, уровень экспрессии антисмысловой РНК может влиять на то, какие изоформы смыслового транскрипта будут синтезироваться[1].
Антисмысловые РНК могут действовать посттранскрипционно, а именно непосредственно влиять на трансляцию мРНК-мишени. Они могут блокировать доступ рибосомы к мРНК или привлекать к мРНК РНКазу H. Иногда, впрочем, антисмысловые РНК оказывают позитивный эффект на трансляцию[1].
Медицинское значение
[править | править код]Как регуляторные элементы, действующие очень специфично, антисмысловые РНК могут быть перспективными мишенями лекарственных препаратов. Кроме того, для достижения нужного эффекта нужно совсем немного молекул антисмысловых РНК, что делает их ещё более удобными мишенями. Активно прорабатывается идея о специфичном повышении экспрессии гена-мишени за счёт подавления соответствующей антисмысловой РНК. Из-за особенностей дизайна препаратов[англ.] создать ингибитор гораздо проще, чем активатор. Однако в некоторых случаях бывает необходимым именно повысить экспрессию гена-мишени, например гена-супрессора опухолей. Этого можно добиться, подавив работу соответствующей ему антисмысловой РНК. Кроме того, в тех случаях, когда требуется подавление гена-мишени, сами антисмысловые РНК могут выступать в роли терапевтического агента. Однако введённые в клетку РНК будут быстро разрушены РНКазами, поэтому необходимо защитить их от деградации. Чаще всего это достигается при помощи химических модификаций, например присоединения фосфоротиоата[англ.]. Однако модификация фосфоротиоатом может спровоцировать воспаление. Кроме того, антисмысловые РНК могут иметь весьма серьёзные побочные эффекты. Несмотря на специфичность эндогенных антисмысловых РНК, только 10—50 % синтетических олигонуклеотидов действуют на ген-мишень. Вероятно, это связано с тем, что важную роль в распознавании мишени и защите от РНКаз играет нативная пространственная структура антисмысловых РНК. Замена лишь одного нуклеотида может сильно изменить структуру молекулы и повлиять на её взаимодействие с мишенью. Наконец, искусственные антисмысловые РНК очень плохо проникают внутрь клеток. Нейроны и глиальные клетки успешно поглощают голые олигонуклеотиды, но для доставки антисмысловых РНК в клетки других типов требуется разработка специальных носителей, например липидных везикул или специальных вирусов[2].
В качестве примера используемого в данный момент препарата, представляющего собой антисмысловую РНК, можно привести мипомерсен[англ.], одобренный FDA в 2013 году. Он был разработан для регуляции уровня холестеринсодержащих липопротеинов низкой плотности в крови пациентов, страдающих от гомозиготной семейной гиперхолестеринемии — редкого аутосомно-доминантного генетического заболевания[10].
Подробнее смотри литературу к статье РНК-терапия.
Примечания
[править | править код]- ↑ 1 2 3 4 5 6 7 8 Pelechano V., Steinmetz L. M. Gene regulation by antisense transcription. (англ.) // Nature Reviews. Genetics. — 2013. — December (vol. 14, no. 12). — P. 880—893. — doi:10.1038/nrg3594. — PMID 24217315.
- ↑ 1 2 3 Wahlestedt C. Targeting long non-coding RNA to therapeutically upregulate gene expression. (англ.) // Nature Reviews. Drug Discovery. — 2013. — June (vol. 12, no. 6). — P. 433—446. — doi:10.1038/nrd4018. — PMID 23722346.
- ↑ Weiss B., Davidkova G., Zhou L. W. Antisense RNA gene therapy for studying and modulating biological processes. (англ.) // Cellular And Molecular Life Sciences : CMLS. — 1999. — March (vol. 55, no. 3). — P. 334—358. — doi:10.1007/s000180050296. — PMID 10228554.
- ↑ 1 2 3 Saberi F., Kamali M., Najafi A., Yazdanparast A., Moghaddam M. M. Natural antisense RNAs as mRNA regulatory elements in bacteria: a review on function and applications. (англ.) // Cellular & Molecular Biology Letters. — 2016. — Vol. 21. — P. 6—6. — doi:10.1186/s11658-016-0007-z. — PMID 28536609.
- ↑ Kole R., Krainer A. R., Altman S. RNA therapeutics: beyond RNA interference and antisense oligonucleotides. (англ.) // Nature Reviews. Drug Discovery. — 2012. — 20 January (vol. 11, no. 2). — P. 125—140. — doi:10.1038/nrd3625. — PMID 22262036.
- ↑ Simons R. W. Naturally occurring antisense RNA control--a brief review. (англ.) // Gene. — 1988. — 10 December (vol. 72, no. 1-2). — P. 35—44. — PMID 2468573.
- ↑ Ietswaart R., Wu Z., Dean C. Flowering time control: another window to the connection between antisense RNA and chromatin. (англ.) // Trends In Genetics : TIG. — 2012. — September (vol. 28, no. 9). — P. 445—453. — doi:10.1016/j.tig.2012.06.002. — PMID 22785023.
- ↑ 1 2 3 4 Magistri M., Faghihi M. A., St Laurent G 3rd., Wahlestedt C. Regulation of chromatin structure by long noncoding RNAs: focus on natural antisense transcripts. (англ.) // Trends In Genetics : TIG. — 2012. — August (vol. 28, no. 8). — P. 389—396. — doi:10.1016/j.tig.2012.03.013. — PMID 22541732.
- ↑ Whetstine, Johnathan R. Histone Methylation // Handbook of Cell Signaling (англ.). — Second. — P. 2389—2397. — ISBN 978-0-12-374148-6. — doi:10.1016/b978-0-12-374145-5.00287-4.
- ↑ Wong E., Goldberg T. Mipomersen (kynamro): a novel antisense oligonucleotide inhibitor for the management of homozygous familial hypercholesterolemia. (англ.) // P & T : A Peer-reviewed Journal For Formulary Management. — 2014. — February (vol. 39, no. 2). — P. 119—122. — PMID 24669178.
Эта статья входит в число добротных статей русскоязычного раздела Википедии. |