Химия морской среды (}nbnx bkjvtkw vjy;d)
| Компонент | Концентрация (mol/kg) |
|---|---|
| H2O | 53.6 |
| Cl- | 0.546 |
| Na+ | 0.469 |
| Mg2+ | 0.0528 |
| SO42- | 0.0282 |
| Ca2+ | 0.0103 |
| K+ | 0.0102 |
| Общий не органический углерод[англ.]*|CT | 0.00206 |
| Br- | 0.000844 |
| Общий бор[англ.]*BT | 0.000416 |
| Sr2+ | 0.000091 |
| F- | 0.000068 |
Морская химия (также химия океана или химическая океанография) — наука о химическом составе и процессах в Мировом океане, включая взаимодействие между морской водой, атмосферой, морским дном и морскими организмами[2]. Рассматривается круговорот таких элементов, как углерод, азот и фосфор, поведение микроэлементов, газов и питательных веществ в морской среде. Химия морской среды зависит от глобальных биогеохимических циклов, морских течений и влияния деятельности человека (загрязнение и изменение климата) на океанические системы[2]. Учитывается тектоника плит и спрединг морского дна, мутность, течения, осадки, уровень pH, атмосферные составляющие, метаморфическая активность и экология.
Влияние деятельности человека на химию океанов Земли усилилось. Промышленность существенно загрязняет океаны. Более того, повышение уровня углекислого газа в атмосфере Земли привело к закислению океана, что оказывает негативное воздействие на морские экосистемы. Восстановление химии океанов является приоритетной задачей, и усилия по достижению этой цели отслеживаются в рамках Цели устойчивого развития 14[англ.] .
Химическая океанография связана с физической океанографией[англ.], геологией и геохимией, биологией и биохимией, наукой об атмосфере[англ.] . Многие из них изучают биогеохимические циклы, причём морской углеродный цикл[англ.] привлекает значительный интерес из-за его роли в секвестрации углерода и закислении океана[3]. Другие важные темы, представляющие интерес, включают аналитическую химию океанов, загрязнение морской среды и антропогенное изменение климата.
Органические соединения в океанах
[править | править код]Растворённые органические вещества
[править | править код]
Растворённые органические вещества (англ. DOM) являются важнейшим компонентом углеродного пула океана и включает в себя множество молекул (аминокислоты, сахара, липиды). Составляют около 90 % от общего количества органического углерода в морской среде[4]. Цветное растворённое органическое вещество[англ.] (англ. CDOM) составляет от 20 до 70 % содержания углерода в океанах, причём его содержание повышено вблизи устьев рек и понижено в открытом океане[5].
Растворённые органические вещества могут быть переработаны и возвращены в пищевую сеть посредством процесса, называемого микробной петлёй[6]. Они также играют важную роль в глобальном регулировании хранения углерода в океане, поскольку некоторые его формы устойчивы к микробному разложению и могут существовать в океане в течение столетий[7]. Морская жизнь является наиболее богатым источником галогенорганических соединений[8].
В состав частиц органического вещества (англ. POM) входят:
- организмы
- фекальные шарики
- детрит.
Частицы органического вещества — основной компонент биологического насоса — процесса, посредством которого углерод переносится с поверхности океана в глубинные воды.
По мере того, как частицы тонут, они разлагается под действием бактерий, выделяя питательные вещества и углекислый газ. Фракция тугоплавкого полиоксиметилена может оседать на дне океана и вносить значительный вклад в секвестрацию углерода в течение очень длительного периода времени[9].
Химическая экология экстремофилов
[править | править код]Такие морские организмы, как экстремофилы, процветают в условиях экстремальных температур, давления и освещенности. Экстремофилы населяют множество уникальных местообитаний в океане, таких как гидротермальные источники, чёрные курильщики, холодные просачивания, гиперсоленые области и карманы с рассолом на морском льду. Некоторые учёные предполагают, что жизнь могла зародиться в гидротермальных источниках океана.
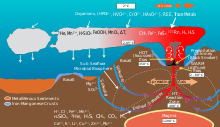
В гидротермальных источниках экстремофилы получают энергию посредством хемоавтотрофии (источник энергии— химические соединения, а не свет, как при фотосинтезе). Гидротермальные источники содержат такие химические вещества, как элементарная сера, H2, H2S, Fe2 + и метан . Хемоавтотрофные организмы, в первую очередь прокариоты, получают энергию из этих химических веществ посредством окислительно-восстановительных реакций, служа впоследствии источниками пищи для более высоких трофических уровней.
В экосистемах гидротермальных источников присутствует несколько различных видов метаболизма. Многие морские микроорганизмы, включая Thiomicrospira, Halothiobacillus и Beggiatoa, способны окислять соединения серы, включая элементарную серу и часто токсичное соединение H2S (цикл серы[англ.]). Сероводород в гидротермальных источниках образуется при взаимодействии, при высоких температурах, морской воды и горных пород. В более холодных водах, окружающих жерла, окисление серы может происходить с использованием кислорода в качестве акцептора электронов; ближе к жерлам с использованием нитратов. Некоторые виды Thiomicrospira могут использовать тиосульфат в качестве донора электронов, образуя элементарную серу. Такие морские микроорганизмы, как Mariprofundus ferrooxydans[англ.], способны окислять железо. Окисление железа может быть кислородным (в богатых кислородом частях океана) или бескислородным, требующим либо акцептора электронов (такого как нитрат), либо световой энергии. При окислении железа Fe(II) используется в качестве донора электронов; наоборот, восстановители железа используют Fe(III) в качестве акцептора электронов. Эти два метаболизма составляют основу железо-окислительно-восстановительного цикла и, возможно, способствовали образованию полосчатого железа[англ.] .
Некоторые экстремофилы обитают в рассолах морских льдов, где температура очень низкая, а солёность очень высокая(в 3 раза выше, чем в обычной морской воде), что требует приспособления организмов к быстрому изменению солёности при попадании в лёд и при таянии льда. Большинство организмов, обитающих в соляных карманах, являются фотосинтезирующими, поэтому эти микросреды могут стать гиперкислородными, что может быть токсичным для их обитателей. Поэтому эти экстремофилы часто вырабатывают высокие уровни антиоксидантов[10].
Тектоника плит
[править | править код]
Спрединг морского дна срединно-океанических хребтов —ионообменная система глобального масштаба[11]. Гидротермальные источники в центрах спрединга привносят в океан различные количества железа, серы, марганца, кремния и других элементов, некоторые из которых повторно используются в океанической коре. Гелий-3, изотоп, сопровождающий вулканизм из мантии, выбрасывается гидротермальными источниками и может быть обнаружен в шлейфах в океане[12].
Скорость спрединга на срединно-океанических хребтах варьируется от 10 до 200 мм/год. Высокие скорости спрединга приводят к усилению реакций базальта с морской водой. Соотношение ионов магний / кальций понижено: ионов магния больше удаляется из морской воды, ионов кальция больше удаляется из породы и высвобождается в морскую воду. Гидротермальная активность на гребне хребта эффективна для удаления магния[13]. Более низкое отношение Mg/Ca способствует осаждению полиморфов карбоната кальция с низким содержанием Mg (кальцитовые моря[англ.])[11].
Медленный спрединг на срединно-океанических хребтах имеет противоположный эффект и приводитт к более высокому соотношению Mg/Ca, что благоприятствует осаждению арагонита и полиморфов карбоната кальция с высоким содержанием Mg (арагонитовые моря[англ.])[11].
Эксперименты показывают, что большинство современных организмов с высоким содержанием Mg в кальците прошлых кальцитовых морей были бы организмами с низким содержанием Mg в кальците[14]. Соотношение Mg/Ca в скелете зависит от соотношения Mg/Ca в морской воде, в которой организм рос.
Таким образом, минералогия рифообразующих и осадкообразующих организмов регулируется химическими реакциями вдоль срединно-океанического хребта, скорость которых контролируется скоростью расширения морского дна[13][14].
Влияние человека
[править | править код]Загрязнение морской среды
[править | править код]В результате деятельности человека мировой океан загрязняется:
- нефтью и нефтепродуктами, поступающими в него как в результате обычной деятельности по добыче и транспортировке нефти, так и в результате аварий, а также смываемыми с дорог.
- пестицидами, хлорорганическими соединениями (в том числе, диоксинами), фенолами, тяжёлыми металлами (в том числе кадмием и ртутью), радиоактивными веществами
- биогенными элементами (из сточных вод, а также в результате хозяйственной деятельности), что приводит к антропогенной эвтрофикации прибрежных районов
- мусором, в том числе пластиковым (включая микропластик)
- углекислым газом, связанным с деятельностью человека, попадающим из атмосферы (приводит к подкислению морских вод)[15][16][17][18].
Изменение климата
[править | править код]Повышение уровня углекислого газа (из-за сжигания ископаемого топлива) меняет химию океана. Глобальное потепление и изменение солёности[19] —факторы влияния на экологию морской среды[20].
История
[править | править код]
Ранние исследования химии морской воды, включая работы Роберта Бойля, обычно касались солёности океана. Современная химическая океанография как отрасль науки зародилась в 1872—1876 годах в ходе экспедиции «Челленджера», тогда был систематически исследован состав морской воды (содержание хлорида, натрия и сульфатов в океанских водах)[21].
В начале XX века в области морской химии произошел значительный прогресс, в частности, благодаря появлению более точных аналитических методов (был создан инструмент сбора проб воды с разных глубин океана — бутылка Кнудсена)[22]. За 1970-е, 1980-е и 1990-е годы, в рамках инициативы Национального научного фонда, известной как «Будущее химии океана в Соединённых Штатах» (FOCUS), была проведена комплексная оценка достижений в области химической океанографии.
После Второй мировой войны исследователи начали использовать изотопный анализ для изучения циркуляции океана и углеродного цикла. Роджер Ревелль и Ганс Зюсс были пионерами в использовании радиоуглеродного датирования для исследования океанических резервуаров углерода и их обмена с атмосферой[23].
Начиная с 1970-х годов учёные смогли измерять содержание следов металлов, органических соединений и изотопных соотношений с беспрецедентной точностью. Исследования морских биогеохимических циклов (циклы углерода, азота и серы) стали основой для понимания глобального изменения климата. Использование технологии дистанционного зондирования и глобальных программ наблюдения за океаном, таких как Международная программа геосферы и биосферы (IGBP), предоставило масштабные данные о химии океана, что позволило учёным отслеживать закисление океана, дезоксигенацию и другие процессы, влияющие на морскую среду.[24]
Инструменты, используемые для анализа
[править | править код]Инструменты химиков-океанографов:
- стандартный набор аналитической химии,
- измерители pH,
- измерители электропроводности,
- флуорометры
- измерители растворённого CO₂.
Большая часть данных собирается посредством измерений на борту судна и с автономных поплавков или буев, но также используется дистанционное зондирование. На океанографическом исследовательском судне проводятся измерения электропроводности, температуры и давления[25], сбор проб производится при помощи бутылок Нансена[26]. Отложения обычно изучаются с помощью ящичного керноотборника или ловушки для осадка, а более старые отложения могут быть извлечены путем научного бурения .

Для обнаружения следовых количеств элементов, изотопов и органических соединений применяется современное аналитическое оборудование[27]:
- масс-спектрометры
- хроматографы.
Автономные подводные аппараты и технологии дистанционного зондирования позволили осуществлять непрерывный крупномасштабный мониторинг химии океана, в частности, отслеживание изменений в закислении океана и циклах питательных веществ[28].
Химия морской среды на других планетах и их спутниках
[править | править код]Предполагается подобие химического состава подповерхностного океана Европы земному[29]. Подповерхностный океан Энцелада выбрасывает в космос водород и углекислый газ[30].
См. также
[править | править код]Примечания
[править | править код]- ↑ DOE. 5 // Handbook of methods for the analysis of the various parameters of the carbon dioxide system in sea water / A.G. Dickson ; C. Goyet. — ORNL/CDIAC-74, 1994. Архивировано {{{2}}}.
- ↑ 1 2 Pilson, Michael E. Q. An Introduction to the Chemistry of the Sea. — 2. — Cambridge : Cambridge University Press, 2012. — ISBN 978-0-521-88707-6. — doi:10.1017/cbo9781139047203.
- ↑ Gillis. Pace of Ocean Acidification Has No Parallel in 300 Million Years, Paper Says (амер. англ.). Green Blog (2 марта 2012). Дата обращения: 28 апреля 2020.
- ↑ Biogeochemistry of marine dissolved organic matter / Hansell ; Carlson. — Amsterdam ; Boston : Academic Press, 2002. — ISBN 978-0-12-323841-2.
- ↑ Coble, Paula G. (2007). "Marine Optical Biogeochemistry: The Chemistry of Ocean Color". Chemical Reviews. 107 (2): 402—418. doi:10.1021/cr050350+. PMID 17256912.
- ↑ Azam, F; Fenchel, T; Field, Jg; Gray, Js; Meyer-Reil, La; Thingstad, F (1983). "The Ecological Role of Water-Column Microbes in the Sea" (PDF). Marine Ecology Progress Series (англ.). 10: 257—263. doi:10.3354/meps010257. ISSN 0171-8630.
- ↑ Hansell, Dennis; Carlson, Craig; Repeta, Daniel; Schlitzer, Reiner (2009-12-01). "Dissolved Organic Matter in the Ocean: A Controversy Stimulates New Insights". Oceanography. 22 (4): 202—211. doi:10.5670/oceanog.2009.109.
{{cite journal}}:|hdl-access=требует|hdl=(справка) - ↑ Gribble, Gordon W. (2004). "Natural Organohalogens: A New Frontier for Medicinal Agents?". Journal of Chemical Education. 81 (10): 1441. Bibcode:2004JChEd..81.1441G. doi:10.1021/ed081p1441.
- ↑ Hedges, John I.; Baldock, Jeffrey A.; Gélinas, Yves; Lee, Cindy; Peterson, Michael; Wakeham, Stuart G. (2001-02-15). "Evidence for non-selective preservation of organic matter in sinking marine particles". Nature (англ.). 409 (6822): 801—804. doi:10.1038/35057247. ISSN 0028-0836.
- ↑ Chemoautotrophy at Deep-Sea Vents: Past, Present, and Future | Oceanography. tos.org. doi:10.5670/oceanog.2012.21. Дата обращения: 8 февраля 2024.
- ↑ 1 2 3 Stanley, S.M.; Hardie, L.A. (1999). "Hypercalcification: paleontology links plate tectonics and geochemistry to sedimentology". GSA Today. 9 (2): 1—7.
- ↑ Lupton, John (1998-07-15). "Hydrothermal helium plumes in the Pacific Ocean". Journal of Geophysical Research: Oceans. 103 (C8): 15853—15868. Bibcode:1998JGR...10315853L. doi:10.1029/98jc00146. ISSN 0148-0227.
- ↑ 1 2 Coggon, R. M.; Teagle, D. A. H.; Smith-Duque, C. E.; Alt, J. C.; Cooper, M. J. (2010-02-26). "Reconstructing Past Seawater Mg/Ca and Sr/Ca from Mid-Ocean Ridge Flank Calcium Carbonate Veins". Science (англ.). 327 (5969): 1114—1117. Bibcode:2010Sci...327.1114C. doi:10.1126/science.1182252. ISSN 0036-8075. PMID 20133522. S2CID 22739139.
- ↑ 1 2 Ries, Justin B. (2004). "Effect of ambient Mg/Ca ratio on Mg fractionation in calcareous marine invertebrates: A record of the oceanic Mg/Ca ratio over the Phanerozoic". Geology (англ.). 32 (11): 981. Bibcode:2004Geo....32..981R. doi:10.1130/G20851.1. ISSN 0091-7613.
- ↑ Недостаточно голубая лагуна: что делать, чтобы остановить загрязнение Мирового океана. Forbes.ru (15 июня 2021). Дата обращения: 16 июля 2024.
- ↑ Ковалевич Ольга Геннадьевна. Основные загрязнители Мирового океана // Научные труды Дальрыбвтуза. — 2013. — Т. 28. — С. 7–11. — ISSN 2222-4661.
- ↑ Е. Г. Дурягина НЕФТЕПРОДУКТЫ В МОРСКОЙ СРЕДЕ
- ↑ В. А. Иванов, К. В. Показеев, Е. Е. Совга Загрязнение мирового океана : учебное пособие. Москва : МАКС Пресс, 2006, 163 с., ISBN 5-317-01810-2
- ↑ Ocean salinity: Climate change is also changing the water cycle (англ.). usys.ethz.ch. Дата обращения: 22 мая 2022.
- ↑ Millero, Frank J. (2007). "The Marine Inorganic Carbon Cycle". Chemical Reviews. 107 (2): 308—341. doi:10.1021/cr0503557. PMID 17300138.
- ↑ Thomson, C. Wyville. Report on the scientific results of the voyage of H.M.S. Challenger during the years 1873-76 under the command of Captain George S. Nares and the late Captain Frank Tourle Thomson / C. Wyville Thomson, John Murray, George S. Nares … [и др.]. — 1889.
- ↑ Carpenter, James H. (1966). "NEW MEASUREMENTS OF OXYGEN SOLUBILITY IN PURE AND NATURAL WATER1". Limnology and Oceanography (англ.). 11 (2): 264—277. doi:10.4319/lo.1966.11.2.0264. ISSN 0024-3590.
- ↑ Revelle, Roger; Suess, Hans E. (1957-01-01). "Carbon Dioxide Exchange Between Atmosphere and Ocean and the Question of an Increase of Atmospheric CO2 during the Past Decades". Tellus A: Dynamic Meteorology and Oceanography. 9 (1): 18—27. doi:10.3402/tellusa.v9i1.9075. ISSN 1600-0870.
- ↑ Falkowski, P.; Scholes, R. J.; Boyle, E.; Canadell, J.; Canfield, D.; Elser, J.; Gruber, N.; Hibbard, K.; Högberg, P.; Linder, S.; Mackenzie, F. T.; Moore III, B.; Pedersen, T.; Rosenthal, Y.; Seitzinger, S. (2000-10-13). "The Global Carbon Cycle: A Test of Our Knowledge of Earth as a System". Science (англ.). 290 (5490): 291—296. doi:10.1126/science.290.5490.291. ISSN 0036-8075.
- ↑ Waveland Press - Introduction to Physical Oceanography, Third Edition, by John A. Knauss, Newell Garfield. www.waveland.com. Дата обращения: 13 октября 2024.
- ↑ Dickson, A.G.; et, al (2007). Guide to best practices for ocean CO2 measurement (Report). [object Object]. doi:10.25607/obp-1342.
- ↑ Aquatic Photosynthesis | Princeton University Press (англ.). press.princeton.edu (11 февраля 2007). Дата обращения: 13 октября 2024.
- ↑ George, Robert A. “Tony” (2006). "Advances in AUV remote-sensing technology for imaging deepwater geohazards". The Leading Edge (англ.). 25 (12): 1478—1483. doi:10.1190/1.2405333. ISSN 1070-485X.
- ↑ Greicius. Europa's Ocean May Have An Earthlike Chemical Balance. NASA (16 мая 2016). Дата обращения: 22 мая 2022.
- ↑ The Chemistry of Enceladus' Plumes: Life or Not?
На эту статью не ссылаются другие статьи Википедии. |