Фотохимия (Skmk]nbnx)
Фотохи́мия — раздел физической химии и химии высоких энергий — изучает превращения химических веществ (химия возбужденных состояний молекул, фотохимические реакции), протекающие под действием электромагнитного излучения в ультрафиолетовом (~100—400 нм), видимом (400—800 нм) и ближнем инфракрасном (800—1500 нм) диапазонах[1][2].
Законы фотохимии
[править | править код]- Фотохимические изменения происходят только под действием света, поглощаемого системой (закон Гротгуса — Дрепера, 1818—1843 гг.).
- Каждый поглощенный фотон в первичном акте способен активировать только одну молекулу (закон фотохимической эквивалентности Эйнштейна, 1912 г.).
Следующие два закона относятся в основном к фотохимии органических соединений и были сформулированы М. Кашей:
- при поглощении каждого фотона молекулой имеется определенная вероятность заселения или самого нижнего синглетного (с мультиплетностью 1) состояния, либо самого нижнего триплетного (с мультиплетностью 3) состояния;
- в большинстве органических фотохимических процессов, протекающих в растворах, участвует либо первое возбужденное синглетное, либо первое возбужденное триплетное состояния.
Электронные переходы в молекуле
[править | править код]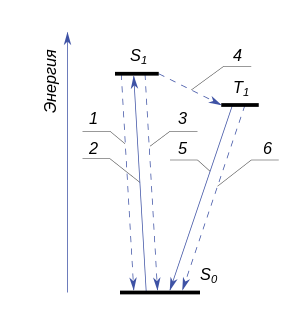
Диапазон волн, представляющий практическую ценность для фотохимии, включает в себя ближний ультрафиолет, видимую область и ограничен с длинноволновой стороны началом ИК-области, то есть это интервал длин волн от 190 до примерно 700—800 нм.
В этом диапазоне наблюдается изменение электронной энергии молекулы при поглощении кванта света, что является определяющим процессом для инициирования химической реакции.
Молекула, переходя в возбужденное состояние, способна терять избыток энергии либо путём излучения, либо безызлучательно, либо вступив в химическое превращение — на преодоление активационного барьера. На рисунке показаны возможные электронные переходы, пунктиром обозначены те, которые происходят без излучения:
- Возбуждение.
- Флуоресценция (переход из состояния S1 в S0 c излучением).
- Внутренняя конверсия из состояния S1 в S0 без излучения.
- Интеркомбинационная конверсия из состояния S1 в T1.
- Фосфоресценция (переход из состояния Т1 в S0 c излучением).
- Интеркомбинационная конверсия из состояния T1 в S0.
Процесс фотохимического превращения можно разделить на три стадии:
- акт поглощения фотона, при котором образуется электронно-возбуждённое состояние;
- первичные фотохимические процессы, в которых участвуют электронно-возбуждённые состояния;
- вторичные, или темновые реакции различных химических веществ, образующихся в результате первичных процессов.
Роль фотохимии в природных процессах
[править | править код]Многие важнейшие процессы, происходящие в окружающей среде и в организме человека, имеют фотохимическую природу[2]. Под действием солнечного света в хлоропластах растений происходит фотосинтез, обеспечивающий существование жизни на Земле за счет выделения кислорода и трансформации солнечной энергии в энергию химических связей углеводов:
.
Зрение, посредством которого человек и большинство животных получает подавляющую часть информации о мире, основано на процессе фотоизомеризации родопсина, которая запускает цепь ферментативных процессов, усиливающих сигнал и обеспеичвающих исключительно высокую чувствительность вплоть до регистрации глазом отдельных фотонов.
Озон образуется в верхних слоях атмосферы под действием коротковолнового (<180 нм) УФ-излучения Солнца по реакции:
.
См. также
[править | править код]- Фотоэффект
- Фотохимические реакции
- Фотокатализ
- Фотодиссоциация
- Фотосинтез
- Искусственный фотосинтез
- Супрамолекулярная фотохимия
- Фотоводород
- Фотоэлектрохимическая ячейка
Примечания
[править | править код]- ↑ Photochemistry (англ.). IUPAC Compendium of Chemical Terminology, 3rd ed.. International Union of Pure and Applied Chemistry. Дата обращения: 19 октября 2011. Архивировано 18 марта 2012 года.
- ↑ 1 2 Химическая Энциклопедия, 1999, Т. 5, с. 182–183.
Литература
[править | править код]- Химическая энциклопедия : [рус.] : в 5 т. / под ред. Н. С. Зефирова. — М. : Большая российская энциклопедия, 1999. — Т. 5. — 783 с. — ISBN 5-85270-310-9.
- Турро Н. Молекулярная фотохимия. — М.: Мир, 1967.
![{\displaystyle {\ce {6CO2{}+6H2O->[hv,~{\text{хлорофилл}}]C6H12O6{}+6O2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/cf098f635ae477c3e84f7d8c0ad33e8c5d3bb03f)
![{\displaystyle {\ce {O2 ->[{hν}] O3}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/07b21303dabffa945564ac1d217021bb1fd494b3)