Пиррол (Hnjjkl)
| Пиррол | |||
|---|---|---|---|
| |||
| Общие | |||
| Хим. формула | C4H5N | ||
| Физические свойства | |||
| Молярная масса | 67,09 г/моль | ||
| Плотность | 0,967 г/см³ | ||
| Поверхностное натяжение | 38,71 мН/м[3], 37,06 мН/м[3] и 34,31 мН/м[3] | ||
| Динамическая вязкость | 2,08 мПа·с[4], 1,225 мПа·с[4], 0,828 мПа·с[4] и 0,612 мПа·с[4] | ||
| Энергия ионизации | 8,21 эВ[5] | ||
| Термические свойства | |||
| Температура | |||
| • плавления | -23 °C | ||
| • кипения | 130 °C | ||
| • вспышки | 39 °C[1][2] | ||
| Давление пара | 1,1 кПа[1][2] | ||
| Химические свойства | |||
| Константа диссоциации кислоты | −3,8[6] | ||
| Оптические свойства | |||
| Показатель преломления | 1,5085[7] | ||
| Структура | |||
| Дипольный момент | 1,767 ± 0,001 Д[8] | ||
| Классификация | |||
| Рег. номер CAS | 109-97-7 | ||
| PubChem | 8027 | ||
| Рег. номер EINECS | 203-724-7 | ||
| SMILES | |||
| InChI | |||
| RTECS | UX9275000 | ||
| ChEBI | 19203 | ||
| ChemSpider | 7736 | ||
| Безопасность | |||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Пиррол — ароматический пятичленный азотистый гетероцикл, обладает слабыми кислотными свойствами. Содержится в костном масле (которое получают при сухой перегонке костей), а также в каменноугольной смоле. Пиррольные кольца входят в состав порфиринов — хлорофилла растений, гема гемоглобинов и цитохромов и ряда других биологически важных соединений.
Строение и свойства
[править | править код]Пиррол представляет собой бесцветную жидкость, напоминающую по запаху хлороформ, медленно темнеющую при стоянии на воздухе. Он слегка гигроскопичен, немного растворим в воде и хорошо растворим в большинстве органических растворителей. Структуру пиррола предложил в 1870 г. Байер, основываясь на его окислении хромовой кислотой в малеинимид и образовании его при перегонке сукцинимида с цинковой пылью.
Кислотность и металлирование
[править | править код]Пиррол является слабой NH-кислотой (pKa 17,5 в воде) и реагирует с щелочными металлами и их амидами в жидком аммиаке или инертных растворителях с депротонированием по положению 1 и образованием соответствующих солей. Аналогично проходит и реакция с реактивами Гриньяра, при которой образуются N-магниевые соли.
N-Замещённые пирролы реагируют с бутил- и фениллитием, металлируясь в α-положение.
Электрофильное замещение
[править | править код]Пиррол является электронообогащённой ароматической системой (π-избыточным гетероциклом), в которой ароматический секстет электронов распределяется по пяти атомам цикла. Вследствие этого проявляет сильные нуклеофильные свойства: для него характерны реакции электрофильного замещения, идущие преимущественно по α-положениям. Пиррол чувствителен к сильным кислотам: его протонирование ведёт к потере ароматичности, образующийся при этом протонированный катион атакует нейтральные молекулы пиррола, что ведёт к полимеризации с образованием смолистых продуктов, окрашенных в красный цвет (т. н. пиррол-красный).
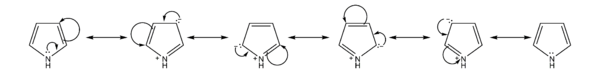
Нитрование и сульфирование вследствие чувствительности пиррола к кислотам проводят нейтральными агентами — ацетилнитратом (образуется преимущественно 2-нитропиррол с примесью 3-нитропроизводного) и комплексом серный ангидрид-пиридин (образуется 2-пирролсульфокислота).
Пиррол галогенируется в мягких условиях, образуя тертрагалогенпирролы и вступает с солями диазония в реакцию азосочетания, образуя в слабокислой и нейтральной среде 2-азопроизводные, а в щелочной — бис-2,5-диазопроизводные.
Незамещённый пиррол реагирует с углеродными электрофилами, образуя продукты замещения.
Так, пиррол ацилируется уксусным ангидридом при 100 °C, образуя смесь 2-ацетил- и 2,5-диацетилпирролов; формилируется по положению 2 по Вильсмейеру-Хааку (диметилформамид и POCl3) и Раймеру-Тиману (хлороформ и NaOH); в реакции Манниха (формальдегид и диалкиламины) образует 2-(диалкиламинометил)пирролы; реагирует с активированными карбонильной или нитрильной группой алкенами (акрилаты, малеиновый ангидрид, акрилонитрил) по типу присоединения по Михаэлю, образуя продукты алкилирования по α-положениям.
Активированными алкилгалогениды (аллил- и бензилгалогениды) в присутствии слабых оснований пиррол алкилируется по α-положениям, йодистым метилом в жестких условиях 100—150°C — также и в положения 3 и 4. Кроме того существует еще и реакция полного йодирования пиррола.
Пиррол является настолько сильным нуклеофилом, что реагирует даже с таким слабым электрофилом, как CO2, карбоксилируясь при нагревании под давлением с водным раствором карбоната аммония с образованием аммониевой соли пиррол-2-карбоновой кислоты.
Методы синтеза
[править | править код]Замещённые пирролы синтезируются по Паалю—Кнорру[англ.] реакцией 1,4-дикетонов с аммиаком или первичными аминами[9].
Исторически наиболее значимый лабораторный синтез пиррола — пиролиз аммониевой соли слизевой кислоты (легко получаемой окислением галактозы), этот синтез представляет собой вариант синтеза Пааля—Кнорра[10]:
Примечания
[править | править код]- ↑ 1 2 CRC Handbook of Chemistry and Physics (англ.) / W. M. Haynes — 97 — Boca Raton: 2016. — P. 15—19. — ISBN 978-1-4987-5428-6
- ↑ 1 2 CRC Handbook of Chemistry and Physics (англ.) / W. M. Haynes — 97 — Boca Raton: 2016. — P. 16—29. — ISBN 978-1-4987-5428-6
- ↑ 1 2 3 CRC Handbook of Chemistry and Physics (англ.) / W. M. Haynes — 97 — Boca Raton: 2016. — P. 6—193. — ISBN 978-1-4987-5428-6
- ↑ 1 2 3 4 CRC Handbook of Chemistry and Physics (англ.) / W. M. Haynes — 97 — Boca Raton: 2016. — P. 6—246. — ISBN 978-1-4987-5428-6
- ↑ David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ CRC Handbook of Chemistry and Physics (англ.) / W. M. Haynes — 97 — Boca Raton: 2016. — P. 5—96. — ISBN 978-1-4987-5428-6
- ↑ CRC Handbook of Chemistry and Physics (англ.) / W. M. Haynes — 97 — Boca Raton: 2016. — P. 3—478. — ISBN 978-1-4987-5428-6
- ↑ CRC Handbook of Chemistry and Physics (англ.) / W. M. Haynes — 97 — Boca Raton: 2016. — P. 9—65. — ISBN 978-1-4987-5428-6
- ↑ Paal—Knorr Pyrrole Synthesis. Архивировано 7 февраля 2008 года.
- ↑ McElvain S. M., Bolliger K. M. Pyrrole // Organic Syntheses. — 1929. — Vol. 9. — P. 78. — doi:10.15227/orgsyn.009.0078.
Литература
[править | править код]Эльдерфилд Р. (ред.) Гетероциклические соединения // М. — ГИзИЛ 1953 том 1 сс. 219—269