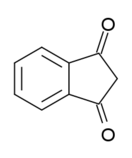
Индандион (Nu;gu;nku)
| Индан-1,3-дион | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование |
Индан-1,3-дион 1,3-индандион |
||
| Традиционные названия |
Индандион 1,3-дикетогидринден |
||
| Хим. формула | C9H6O2 | ||
| Физические свойства | |||
| Состояние | бесцветное или желтоватое твёрдое | ||
| Молярная масса | 146.14 г/моль | ||
| Плотность | 1,37 [1] | ||
| Термические свойства | |||
| Температура | |||
| • плавления | 129—130 (или 132[2]) | ||
| Энтальпия | |||
| • образования | (для газа) -165,0 ± 2,6 кДж/моль | ||
| Удельная теплота испарения | (пересчитано из значения ниже) 0,497 Дж/кг | ||
| Удельная теплота плавления | 17,2 кДж/моль[3] | ||
| Давление пара | |||
| Химические свойства | |||
| Константа диссоциации кислоты | 7,4 | ||
| Растворимость | |||
| • в воде | небольшая | ||
| Классификация | |||
| Рег. номер CAS | 606-23-5 | ||
| PubChem | 11815 | ||
| Рег. номер EINECS | 210-109-7 | ||
| SMILES | |||
| InChI | |||
| ChEBI | 78877 | ||
| ChemSpider | 11322 | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Индан-1,3-дион — органическое вещество, представитель ненасыщенных транс-фиксированных β-дикетонов. В кристаллическом виде бесцветное или желтоватое и существует в форме именно дикетона. В водном же растворе частично енолизирован. Значительный вклад в развитие химии индандиона и его производных внёс профессор РТУ Г. Я. Ванаг — основатель рижской школы химиков-органиков.
Особенности строения
[править | править код]Енольная форма характеризуется сопряжением связей и отрицательным частичным зарядом на 2-м атоме углерода и том атоме кислорода, который не связан с водородом (то есть, любой из двух). Анион же индандиона — это сопряжённая 6π-электронная система, отрицательный заряд делокализирован. Согласно приблизительным расчётам по методу МО Хюккеля (для такой системы транс-фиксированного дикетона вообще) наибольшая электронная плотность после обоих атомов кислорода находится опять-таки на 2-м атоме углерода. Это обуславливает многие его химические свойства.
Получение
[править | править код]Индандион получают кислым гидролизом и одновременным декарбоксилированием натриевой соли 2-алкоксикарбонилиндан-1,3-диона (обычно этокси-) при повышенной температуре.
Саму же соль получают сложноэфирной конденсацией алкилацетата и диалкилфталата (обычно этилацетата и диэтил- или диметилфталата).
При окислении же индана такими реагентами, как пероксид водорода или трет-бутилгидропероксид, в качестве основного продукта получают индан-1-он, индандион получается лишь как примесь.[4]
Химические свойства
[править | править код]Индан-1,3-дион является очень сильным C-нуклеофилом.
Специфические реакции
[править | править код]- Самоконденсация происходит весьма легко с образованием биндона — специфического реагента на первичные амины.

Общие для дикетонов свойства
[править | править код]- Енолизация — в воде pKE = 5,6, это соответствует двум процентам енола. Надо помнить, что в разных растворителях KE может быть разная ввиду различных эффектов сольватирования для OH- и CH-кислот. Как обычно, транс-фиксированные дикетоны с пятичленным циклом менее енолизированны, чем подобные соединения с шестичленным циклом.
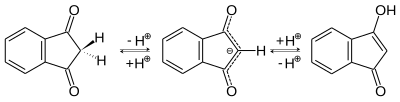
- Электрофильное присоединение — получаются продукты как C-, так и O-присоединения. Это, однако, зависит также от растворителя и концентрации веществ. Реакция происходит с енольной формой или анионом. Например, при бромировании можно получить в зависимости от стехиометрии 2-броминдан-1,3-дион или 2,2-диброминдан-1,3-дион.[5]

- Очень характерна реакция нитрования — проходит легко с образованием 2-нитроиндандиона — сильной кислоты. C-электрофилы обычно реагируют с анионом дикетона. Продукты реакции с альдегидами — обычно бис-продукты.
- В качестве примера ацилирования можно привести реакцию с 1,1-дифенилацетоном, которой можно получить родентицид 2-дифенилацетилиндан-1,3-дион (дифацинон или дифенадион).[6]

- В качестве других электрофильных реакций присоединения можно упомянуть галогенирование другими реагентами, сульфирование, азосочетание, нитрозирование.
Этот раздел не завершён. |
- Восстановление амальгамой цинка по Клемменсену приводит к индану, побочным же продуктом является инден.[7]

- Равно и каталитическое ионное гидрирование (триэтилсиланом и трифторуксусной кислотой) приводит к индану.[8]
- Зато, восстанавливая селективным восстановителем боргидридом натрия (в присутствии палладиевого катализатора), получают 3-гидрокси-1-инданон; при дальнейшем восстановлении — соответственно, индан-1,3-диол.[9]

- Сходным образом и цинковая пыль в ледяной уксусной кислоте реагирует с образованием 3-гидрокси-1-инданона.[10]
- Гомолитические реакции — при взаимодействии индандиона с активными свободными радикалами, а также при окислении анионов образуются стабилизированные делокализацией радикалы, тут же вступающие в дальнейшие реакции, как, например, с алкадиенами, алкинами и друг с другом (димеризация). Особенно стабильны радикалы 2-арилпроизводных индандиона.
- Частным случаем является окисление индандиона в нингидрин с помощью NBS и диметилсульфоксида. Те же реагенты помогают получить нингидрин из 1-инданона и 2-инданона.[11]

Применение
[править | править код]Производные индандиона — биндон, 2-нитроиндандион, нингидрин — используют в аналитической химии. Есть производные, которые, возможно, будут использоваться в фотонике (ведутся исследования).[12] Некоторые производные являются препаратами, понижающими свёртываемость крови (антикоагулянты). В медицине, в частности, применяют арилпроизводные (фенилин — 2-фенилиндан-1,3-дион и омефин — 2-гидроксиметил-2-фенилиндан-1,3-дион). В качестве родентицида (крысиного яда) применяют ратиндан (2-дифенилацетилиндан-1,3-дион); нужно, однако, помнить, что этот способ травли крыс весьма жесток — крыса, ввиду своего образа жизни часто получающая небольшие царапины, истекает кровью и погибает от её потери.
Литература
[править | править код]- Нейланд О. Я. Органическая химия: Учеб. для хим. спец. вузов. Москва: Высшая школа, 1990.— с. 481—490.
- Valters, Raimonds. Organiskā ķīmija (speckurss). Lekciju konspekts. Rīga: RTU izdevniecība, 2009.— 114 lpp. (латыш.)
Примечания
[править | править код]- ↑ (англ.) 1,3-Indandione (TCI America) (недоступная ссылка)
- ↑ Sigma-Aldrich|ALDRICH|I2002|Время=20 октября 2010
- ↑ 1 2 3 4 (англ.) M. A. Matos, M. S. Miranda, M. J. Monte, L. M. Santos, V. M. Morais, J. S. Chickos, P. Umnahanant, J. F. Liebman: "Calorimetric and computational study of indanones" in J. Phys. Chem. A 2007, 111(43),S. 11153-9. Полный текст Архивная копия от 6 июня 2010 на Wayback Machine
- ↑ (англ.) J. Muzart: "Homogeneous CrVI-Catalyzed Benzylic, Allylic and Propargylic Oxidations by tert-Butyl Hydroperoxide" in Mini-Reviews in Organic Chemistry 2009, (6), S. 9-20. [www.bentham.org/mroc/sample/mroc6-1/002AK.pdf Volltext]
- ↑ (англ.) D. Nematollahi, N. Akaberi: "Electrochemical Study of Bromide in the Presence of 1,3-Indandione. Application to the Electrochemical Synthesis of Bromo Derivatives of 1,3-Indandione" in Molecules 2001, 6, S. 639-646.Полный текст Архивная копия от 31 января 2016 на Wayback Machine
- ↑ (англ.) Thomas A. Unger: "Pesticide Synthesis Handbook", Verlag William Andrew, 1996. ISBN 978-0-8155-1401-5. S. 900. (Google Книги|BookID=blYN-_pY9_IC|стр. 900)
- ↑ (англ.) S. A. Galton, M. Kalafer, F. M. Beringer: "Rearrangements in the Clemmensen reduction of 1-indanones and, 1,3-indandiones" in J. Org. Chem., 1970, 35(1), S.1–6. doi:10.1021/jo00826a001
- ↑ (англ.) O. K. Popova, Z. N. Parnes, M. I. Katinkin, S. M. Markosyan, N. I. Kopteva, L. P. Zalukaev, D. N. Kursanov: "Ionic hydrogenation of 1,3-indanedione derivatives" in Russian Chemical Bulletin, 1981, 30(9), S. 1709-1711. doi:10.1007/BF00949478
- ↑ (англ.) J. F. Neumer: "2,3-Disubstituted 1-Indanones", United States Patent 3992450. Полный текст Архивная копия от 29 января 2016 на Wayback Machine
- ↑ (англ.) S. M. Resnick, D. S. Torock, K. Lee, J. M. Brand, D. T. Gibson: "Regiospecific and Stereoselective Hydroxylation of 1-Indanone and 2-Indanone by Naphthalene Dioxygenase and Toluene Dioxygenase" in Applied and Environmental Microbiology 1994, 60(9), S. 3323-3328.Полный текст (недоступная ссылка)
- ↑ (англ.) J. L. Hallman: "Synthesis of Naphtho(f)ninhydrin and Synthesis of Polymer-supported Crown Ethers". Dissertation, 1991.Полный текст (недоступная ссылка)
- ↑ Nonlinear optical properties of some indandione-1,3 pyridinium betaine derivatives | Publications: SPIE