Илиды (Nln;d)
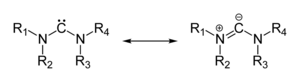
Илид — нейтральная биполярная молекула, имеющая формально отрицательно заряженный атом (обычно карбанион), непосредственно связанный с гетероатомом, который формально имеет положительный заряд (обычно азот — илиды аммониевых солей, фосфор или сера — илиды фосфония и сульфония), при этом оба атома имеют полные октеты электронов. В результате получается структура, в которой два соседних атома соединены одновременно ковалентной и ионной связями, и обычно записывается как X+–Y−. Поэтому илиды также называют 1,2-дипольными соединениями[англ.] и считают как подкласс цвиттер-ионов.[1] Илиды используются в органической химии как реагенты и интермедиаты.[2]
Название класса "илид" для химических соединений не следует путать с суффиксом принадлежности к классу "-илид".
Структура
[править | править код]Илиды аммония имеют полностью цвиттер-ионный характер с одинарной связью между атомами с различными зарядами, в случае илидов фосфония и сульфония вследствие участия d-орбиталей гетероатома связь принимает частично двойной характер и структура таких илидов описывается резонансом между иленовой и илидной формами:
Вклад каждой из резонансных структур зависит от вида ониевого центра (то есть от гетероатома) и структуры заместителей.
Илиды фосфония
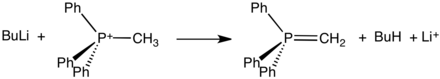
[править | править код]Илиды фосфония используются в реакции Виттига — превращении кетонов и особенно альдегидов в алкены. Атом фосфора в реактиве Виттига, имеющий три фенильных заместителя, несёт положительный заряд и соединён с карбанионом (несущим отрицательный заряд). Илиды бывают "стабилизированными" и "нестабилизированными".
Илид фосфония образуется из трифенилфосфина и алкилгалогенида по механизму, аналогичному
механизму SN2-замещения.
В процессе кватернизации образуется алкилтрифенилфосфониевая соль, которую далее выделяют или обрабатывают in situ сильным основанием (в данном случае бутиллитий):
Так как реакция протекает по механизму SN2, пространственно незатруднённые алкилгалогениды реагируют с трифенилфосфином более активно, чем стерически затруднённые (такие как трет-бутилбромид).
Илиды фосфора являются важными реагентами в органическом синтезе, особенно в синтезе природных продуктов с биологической и фармакологической активностью. Большой интерес к координационным свойствам α-кетостабилизированных илидов фосфора связан с их координационной универсальностью, которая обусловлена наличием различных функциональных групп в их молекулярной структуре.
Несимметричный илиды фосфора
[править | править код]α-Кетостабилизированные илиды, полученные из таких бифосфинов, как dppe[англ.], dppm[англ.] и т. д., а именно [Ph2PCH2PPh2]C(H)C(O)R и [Ph2PCH2CH2PPh2]C(H)C(O)R (R = Me, Ph или OMe), образуют важный класс гибридных лигандов, совмещающих функциональность фосфинов и илидов, и которые могут существовать в илидной и енолятной формах. Такие лиганды могут образовывать разныет виды связей с ионами металлов, такими как палладий и платина.[3]
Другие типы
[править | править код]На основе серы
[править | править код]Другими распространенными илидами являются илиды сульфония и илиды сульфоксония, например реактив Кори-Чайковского[англ.], используемый для получения эпоксидов и в перегруппировке Стивенса[англ.].
На основе кислорода
[править | править код]Илиды карбонила (RR'C=O+C−RR') могут образовываться в результате раскрытия цикла эпоксидов или реакцией карбонильных соединений c электрофильными карбенами,[4] которые обычно приготовляются из диазосоединений. Илиды оксония (RR'-O+-C−R'R) образуются в результате реакции между эфирами и электрофильными карбенами.
На основе азота
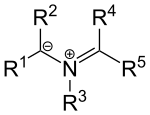
[править | править код]Существуют также илиды на основе азота, такие как азометиновые илиды[англ.] с общей структурой
Илиды азота можно представить как катионы иминия[англ.], расположенные по соседству с карбанионом. Заместители R1, R2 электроноакцепторные. Такие илиды могут быть получены конденсацией α-аминокислот и альдегидов или же раскрытием N-замещённого азиридинового кольца под действием температуры.
Другая экзотическая группы диазотсодержащих илидов — изодиазины[англ.]: R1R2N+=N–, разлагающиеся с выделением азота.
Вклад илидов в резонансную структуру также имеется у cтабильных карбенов:
Другие типы
[править | править код]Илиды галония можно приготовить из аллилгалогенов и металлических карбеноидов[англ.]. После [2,3]-перегруппировки образуется гомоаллилгалоген.
Активной формой реагент Теббе часто считается илид титана. Как и в реактиве Виттига, здесь возможно замещение атома кислорода в карбонильной группе метиленовой группой. Однако, по сравнении с ним реагент Теббе имеет меньше стерических затруднений.
Реакции
[править | править код]Важной реакцией илидов является реакция Виттига (для илидов фосфора), но имеются и многие другие.
Диполярное циклоприсоединение
[править | править код]Некоторые илиды являются 1,3-диполями[англ.] и участвуют в 1,3-диполярном циклоприсоединении[англ.]. Например, азометиновый илид является диполем в реакции Прато c фулеренами.
Отщепление водорода под действием силанов
[править | править код]В присутствии гомолигандных комплексов элементов 3-й группы (в англоязычной литературе они называются homoleptic) Y[N(SiMe3)2]3, метилид трифенилфосфония может реагировать с фенилсиланом[англ.].[5] В ходе этой реакции выделяется H2 и образуется кремний-стабилизированный илид.
Сигматропные перегруппировки
[править | править код]Большинство илидов участвуют в реакциях сигматропной перегруппировки.[6] Перегруппировка Соммле-Хаузера является примером [2,3]-сигматропной реакции. Перегруппировка Стивенса[англ.] — примером [1,2]-перегруппировки.
[3,3]-Сигматропная реакция в некоторых фосфониевых илидах[7][8]:
Аллильная перегруппировка
[править | править код]Было обнаружено, что реагенты Виттига реагируют как нуклеофилы в SN2'-замещении[англ.]:[9]
После присоединения следует реакция отщепления (элиминирования).
См. также
[править | править код]- Бетаин: нейтральная молекула с ониевым-катионом и отрицательным зарядом
- Цвиттер-ион: нейтральная молекула с одной или несколькими парами положительных и отрицательных зарядов
Примечания
[править | править код]- ↑ IUPAC Gold Book internet edition: «ylides».
- ↑ McMurry, John. Organic Chemistry, 7th Ed (неопр.). — Thomson Brooks/Cole, 2008. — С. 720—722. — ISBN 978-0-495-11258-7.
- ↑ Sabouncheia, Seyyed Javad; Ahmadi, Mohsen; Nasri, Zahra; Shams, Esmaeil; Salehzadeh, Sadegh; Gholiee, Yasin; Karamian, Roya; Asadbegy, Mostafa; Samiee, Sepideh. Synthesis, characterization, thermal, electrochemical, and DFT studies of mononuclear cyclopalladated complexes containing bidentate phosphine ligands and their biological evaluation as antioxidant and antibacterial agents (англ.) // Comptes Rendus Chimie[англ.] : journal. — 2013. — Vol. 16, no. 2. — P. 159—175. — doi:10.1016/j.crci.2012.10.006.
- ↑ Padwa, Albert. Catalytic Decomposition of Diazo Compounds as a Method for Generating Carbonyl‐Ylide Dipoles (англ.) // Helvetica Chimica Acta[англ.] : journal. — 2005. — Vol. 88, no. 6. — P. 1357—1374. — doi:10.1002/hlca.200590109.
- ↑ Nako, Adi E.; White, Andrew J. P.; Crimmin, Mark R. A metal–amide dependent, catalytic C–H functionalisation of triphenylphosphonium methylide (англ.) // Chemistry : journal. — 2013. — Vol. 4. — P. 691—695. — doi:10.1039/C2SC21123H.
- ↑ Sweeney, J. B. Sigmatropic rearrangements of ‘onium’ ylides (англ.) // Chemical Society Reviews[англ.] : journal. — 2009. — Vol. 38. — P. 1027—1038. — doi:10.1039/b604828p. — PMID 19421580.
- ↑ Ferguson, Marcelle L.; Senecal, Todd D.; Groendyke, Todd M.; Mapp, Anna K. [3,3]-Rearrangements of Phosphonium Ylides (англ.) // J. Am. Chem. Soc.[англ.] : journal. — 2006. — Vol. 128, no. 14. — P. 4576—4577. — doi:10.1021/ja058746q. — PMID 16594686.
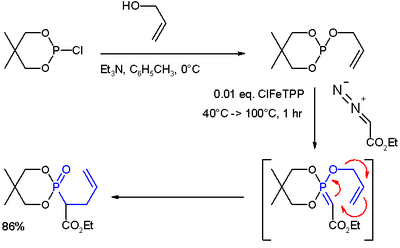
- ↑ (i) Reaction of allyl alcohol with 2-chloro-5,5-dimethyl-1,3,2-dioxaphosphorinane forms a phosphite ester. (ii) Metal carbene addition (from ethyl diazoacetate and ClFeTPP) forms an ylide. (iii) A rearrangement reaction (in blue) yields a phosphonate.
- ↑ Patel, Ramesh M.; Argade, Narshinha P. Facile SN2' Coupling Reactions of Wittig Reagents with Dimethyl Bromomethylfumarate: Synthesis of Enes, Dienes, and Related Natural Products (англ.) // J. Org. Chem.[англ.] : journal. — 2007. — Vol. 72, no. 13. — P. 4900—4904. — doi:10.1021/jo070728z. — PMID 17539690.