Дифторхлорметан (:nsmkj]lkjbymgu)
| Дифторхлорметан | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
Дифторхлорметан |
| Сокращения | R22 |
| Традиционные названия | дифторхлорметан, Arcton 4; фреон 22, хладон 22 |
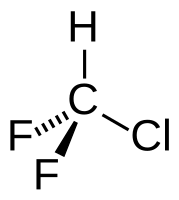
| Хим. формула | CHClF2 |
| Рац. формула | CHClF2 |
| Физические свойства | |
| Состояние | бесцветный, малотоксичный газ со специфическим запахом хлороформа |
| Молярная масса | 86,47 г/моль |
| Энергия ионизации | 12,45 ± 0,01 эВ[4] и 12,2 °C[5] |
| Термические свойства | |
| Температура | |
| • плавления | −175,42 °C |
| • кипения | −40,7 °C |
| Критическая точка | |
| • температура | 96 °C |
| • давление | 50,4 атм |
| Удельная теплота испарения | 233500 Дж/кг |
| Давление пара | 9,4 ± 0,1 атм[4] |
| Структура | |
| Дипольный момент | 4,7E−30 Кл·м[5] |
| Классификация | |
| Рег. номер CAS | 75-45-6 |
| PubChem | 6372 |
| Рег. номер EINECS | 200-871-9 |
| SMILES | |
| InChI | |
| RTECS | PA6390000 |
| ChEBI | 82417 |
| ChemSpider | 6132 |
| Безопасность | |
| Предельная концентрация | 3000 мг/м³[1] |
| ЛД50 | 5470 мг/кг (крысы, внутривенно)[2] |
| Токсичность | Оказывает наркотическое, слабо выраженное общетоксичное действие. Зарегистрированные препараты дифторхлорметана относятся к 4-му классу опасности[3] для человека. |
| Фразы риска (R) | R59 |
| Фразы безопасности (S) | S23 S24 S25 S59 |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Дифторхлормета́н (также фрео́н R-22, хла̀даге́нт R-22, хладо́н-22)[6] — органическое вещество, трижды замещённый галогеналкан, производное метана, фреон, химическая формула CHClF2. Бесцветный газ со слабым запахом хлороформа. Более ядовит, чем дифтордихлорметан, не взрывоопасен и не горюч. По сравнению с дифтордихлорметаном, дифторхлорметан хуже растворяется в масле, но легко проникает через неплотности и нейтрален к металлам. При температуре выше 330 °C в присутствии металлов разлагается с выделением токсичных веществ.
Дифторхлорметан широко используется в качестве хладагента, так как его озоноразрушающий потенциал примерно в 20 раз ниже, чем у фреонов R-11 (трихлорфторметан и R-12 (дифтордихлорметан). Однако он всё же разрушает озоновый слой, поэтому его применение ограничено Монреальским протоколом. В 2020 году от него планируется полностью отказаться, заменив безопасными для озона фреонами, такими как тетрафторэтан (R-134A), R-410A (азеотропная смесь дифторметана R-32 и пентафторэтана R-125), R407C или R422D.
Как и все фторсодержащие фреоны, дифторхлорметан в природе не встречается.
Основной метод синтеза — взаимодействие хлороформа с фтороводородом в присутствии пентафторида сурьмы (реакция Свартса):
Дифторхлорметан в основном используется для получения тетрафторэтилена (идущего для производства политетрафторэтилена)[7], реакция идет через образование дифторкарбена, образующегося при пиролизе дифторхлорметана (при 550—750 °С):
Дифторкарбен также образуется при отщеплении хлороводорода от дифторхлорметана действием оснований, при наличии в реакционной среде нуклеофилов дифторкарбен присоединяется к ним in situ с образованием дифторметильных производных:
Физические свойства
[править | править код]| Свойство | Значение |
|---|---|
| Плотность при температуре кипения (жидкость/газ) | 1413/4,706 кг/м³ |
| Критическая плотность (ρc) | 525 кг/м3 |
| Коэффициент возможности истощения озонового слоя (ODP) | 0,055 (CCl3F = 1) |
| Потенциал глобального потепления (GWP) | 1810 (CO2 = 1) |
Примечания
[править | править код]- ↑ name=https://docs.cntd.ru_Difluorochloromethane (недоступная ссылка)
- ↑ name=https://docs.cntd.ru_ГОСТ (недоступная ссылка) 12.1.007-76. ССБТ. Вредные вещества. Классификация и общие требования
- ↑ name=https://docs.cntd.ru_ГОСТ (недоступная ссылка) 12.1.005-76. Воздух рабочей зоны. Общие санитарно-гигиенические требования
- ↑ 1 2 http://www.cdc.gov/niosh/npg/npgd0124.html
- ↑ 1 2 David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ Фреон R22 - описание и свойства. Дата обращения: 5 января 2012. Архивировано 26 сентября 2020 года.
- ↑ Промышленные фторорганические продукты: спр. издание / Максимов Б. Н., Барабанов В. Г., Серушкин И. Л.. — 2-е изд., пер. и доп. — СПб.: Химия, 1996. — 544 с. — ISBN 5-7245-1043-X.





