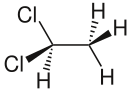
1,1-Дихлорэтан (1,1-:n]lkjzmgu)
| 1,1-Дихлорэтан | |||
|---|---|---|---|
 | |||
| Общие | |||
| Систематическое наименование |
1,1-дихлорэтан | ||
| Хим. формула | Cl2C2H4 | ||
| Рац. формула | C2H4Cl2 | ||
| Физические свойства | |||
| Состояние | жидкость | ||
| Молярная масса | 98,96 г/моль | ||
| Плотность | 1,1757 г/см³ | ||
| Энергия ионизации | 11,06 ± 0,01 эВ[1][2] | ||
| Термические свойства | |||
| Температура | |||
| • плавления | −96,6 °C | ||
| • кипения | 57 °C | ||
| • вспышки | 2 ± 1 ℉[1] | ||
| Пределы взрываемости | 5,4 ± 0,1 об.%[1] | ||
| Критическая точка | 261,5 °C, 5,07 МПа | ||
| Мол. теплоёмк. | 111,3 Дж/(моль·К) | ||
| Удельная теплота испарения | 31 870 Дж/кг | ||
| Давление пара | 100 мм Hg (7,2 °C) 400 мм Hg (39,8 °C) | ||
| Химические свойства | |||
| Растворимость | |||
| • в воде | 0,55 г/100 мл | ||
| Оптические свойства | |||
| Показатель преломления | 1,4164 | ||
| Структура | |||
| Дипольный момент | 2,06 Д | ||
| Классификация | |||
| Рег. номер CAS | 75-34-3 | ||
| PubChem | 6365 | ||
| Рег. номер EINECS | 200-863-5 | ||
| SMILES | |||
| InChI | |||
| RTECS | KI0175000 | ||
| ChEBI | 81599 | ||
| ChemSpider | 6125 | ||
| Безопасность | |||
| Токсичность | токсично | ||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
1,1-дихлорэта́н — хлорорганическое соединение, прозрачная бесцветная жидкость с запахом хлороформа, плохо растворимая в воде, хорошо растворимая в органических растворителях. Легко испаряется.
Промышленно производится в больших объёмах для нужд химического синтеза.
Получение[править | править код]
Основной способ промышленного получения — хлорирование хлористого этила:
- .
Лабораторный способ получения:
- .
Применение[править | править код]
- 1,1-дихлорэтан используют как промежуточное соединение в синтезе 1,1,1-трихлорэтана и ряда других органических химических продуктов;
- как растворитель для пластмасс, жиров, масел, как обезжиривающий агент, как экстрагент;
- для отверждения каучуков;
- в качестве фумиганта в инсектицидных аэрозолях;
- 1,1-дихлорэтан применялся в хирургии как ингаляционный анестетик;
- для флотации руды;
- применяется для повышения активности катализатора риформинга бензинов[3].
Безопасность[править | править код]
В статье не хватает ссылок на источники (см. рекомендации по поиску). |
- Пары дихлорэтана тяжелее воздуха и могут стелиться по земле; возможно воспламенение на расстоянии от открытого огня. Температура вспышки: −6 °C, температура самовоспламенения: 458 °C. Пределы воспламенения в воздухе 6,20—16,90 об.%.
- При нагреве и при сжигании образуются токсичные и едкие пары, в том числе фосген и хлороводород. Бурно реагирует с сильными окислителями, щелочными и щёлочноземельными металлами, порошками металлов с опасностью пожара и взрыва. Агрессивен в отношении алюминия, железа и полиэтилена. Контакт с сильными щелочами вызывает образование огнеопасного и токсичного ацетальдегида.
- Нормативы для рабочей зоны: предельная концентрация 405 мг/м³.
- Предположительно, канцерогенен. Включен в список известных канцерогенов[4].
- Поражает почки и сердце.
- В атмосфере период полуразложения около 62 дней, в основном в реакциях с гидроксильными радикалами образующимися в воздухе в процессе фотолиза солнечным излучением паров воды. В воде и почве не накапливается из-за высокой летучести.
Метаболизм[править | править код]
Токсическое действие 1,1-дихлорэтана примерно в 5 раз слабее, чем у 1,2-дихлорэтана. Продуктами метаболизма 1,2-дихлорэтана в организме являются монохлоруксусная и щавелевая кислоты (метаболизм 1,1-дихлорэтана проходит через стадию образования уксусной кислоты, токсичность которой в эксперименте на животных в 40 раз меньше токсичности монохлоруксусной кислоты, что, по-видимому, объясняет значительно меньшую токсичность 1,1-дихлорэтана). При попадании в организм в небольших количествах, при питье хлорированной воды, выводится из организма в основном в неизменном виде с дыханием в течение 2-х дней. Метаболизм практически не изучен, так как при попадании в организм животных в больших количествах (16000 ppm) вызывает отравление с последующим летальным исходом. Другие исследования показывают, что продолжительные воздействия высоких концентраций 1,1-дихлорэтана вызывают заболевания почек.
Примечания[править | править код]
- ↑ 1 2 3 http://www.cdc.gov/niosh/npg/npgd0194.html
- ↑ David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ Каталитический риформинг. Производство компонентов бензина. Дата обращения: 4 декабря 2020. Архивировано 25 сентября 2020 года.
- ↑ 1,1-Dichloroethane. California Office of Environmental Health Hazard Assessment. Дата обращения: 28 февраля 2021.
Литература[править | править код]
- Рабинович В. А., Хавин З. Я. Краткий химический справочник. — Л.: Химия, 1977.
- Ошин Л. А.,. Промышленные хлорорганические продукты. Справочник. — М.: Химия, 1978.