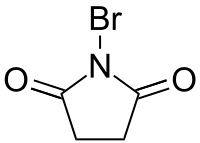
N-Бромсукцинимид (N->jkbvrtenunbn;)
| N-Бромсукцинимид | |
|---|---|
 | |
 | |
| Общие | |
| Систематическое наименование |
1-бромпирролидин-2,5-дион |
| Сокращения | NBS |
| Традиционные названия | N-бромсукцинимид |
| Хим. формула | C4H4BrNO2 |
| Физические свойства | |
| Состояние | твёрдое |
| Примеси | сукцинимид |
| Молярная масса | 177,98 г/моль |
| Плотность | 2,098 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 175 — 178 (разл) |
| • кипения | разл °C |
| Химические свойства | |
| Растворимость | |
| • в воде | 1,47 г/100 мл |
| • в ацетон, тетрагидрофуран, диметилформамид, диметилсульфоксид, ацетонитрил | смешивается |
| Классификация | |
| Рег. номер CAS | 128-08-5 |
| PubChem | 67184 |
| Рег. номер EINECS | 204-877-2 |
| SMILES | |
| InChI | |
| ChEBI | 53174 |
| ChemSpider | 60528 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
N-Бромсукцинимид (БСИ, NBS) — N-бромимид янтарной кислоты. Бесцветные кристаллы, нерастворимые в воде. Растворим в полярных апротонных растворителях. Широко применяется в синтетической органической химии в качестве бромирующего агента, в кислой среде является источником катионов брома.
Физические свойства
[править | править код]Плотный белый порошок или кристаллы со слабым запахом брома. Со временем приобретает светло-оранжевый цвет, а запах брома усиливается, ввиду постепенного разложения. Слабо растворим в воде, уксусной кислоте. Растворяется в ацетоне, тетрагидрофуране, диметилформамиде, диметилсульфоксиде, ацетонитриле. Нерастворим в диэтиловом эфире, гексане, четырёххлористом углероде.
Реакционная способность и применение
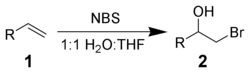
[править | править код]NBS реагирует с алкенами 1 в водной среде, давая бромгидрин 2. Чаще всего реакцию осуществляют по частям, присыпая навеску NBS в раствор алкена в 50 % водном DMSO, DME, THF или трет-бутаноле при 0 °C. Образование бромоний-иона и атака интермедиата водой даёт присоединение строго по Марковникову и имеет анти-стереохимическую селективность.
Побочные реакции, включающие образование α-бромо-кетонов и дибромзамещённых соединений, могут быть устранены использованием свежеперекристаллизованного NBS. Используя другие нуклеофилы вместо воды, можно получить другие бифункциональные алканы.
Аллильное и бензильное бромирование
[править | править код]Стандартные условия использования NBS в аллильном и/или бензильном бромировании включают кипячение с обратным холодильником в безводной среде четырёххлористого углерода, бензола и т. п. с радикальным инициатором — обычно бис-изобутиронитрил или перекисью бензоила при облучении — оба способа сразу приводят к образованию радикала[1]. Аллильные и бензильные интермедиаты образующиеся в ходе реакции, более стабильны, чем другие углеродные радикалы и основными продуктами являются аллил- или бензилбромиды. Как, например, в реакции Воля-Циглера:
Четырёххлористый углерод должен быть сухим на протяжении реакции, так как присутствие воды может гидролизовать необходимый продукт. Для поддержания сухости и нейтральной кислотности часто добавляют карбонат бария. В вышеприведенной реакции при возможности образования аллильного или метилзамещённого, образуется аллильный продукт замещённый в 4-е положение.
Бромирование карбонильных производных
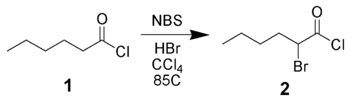
[править | править код]NBS может ввести атом брома в α-положение карбонильного соединения как по радикальному механизму, так и с помощью кислотного катализа. Например, гексаноилхлорид 1 может быть бромирован в α-положение NBS при кислотном катализе[2].
Реакция енолятов, енольных эфиров или енолацетатов с NBS — предпочтительный метод для α-бромирования из-за высоких выходов и малого количества побочных продуктов[3][4].
Бромирование ароматических соединений
[править | править код]Активированные электродонорными заместителями ароматические соединения (например фенолы, анилины и гетероциклы) могут быть[5] бромированы при использовании NBS[6][7]. Использование DMF как растворителя обеспечивает селективное бромирование по пара-положению[8].
Перегруппировка Гоффмана
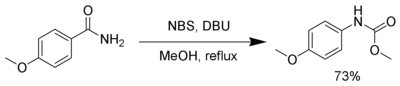
[править | править код]NBS в присутствии сильных оснований, таких как DBU (Диазабициклоундецен), реагирует образуя карбаматы через перегруппировку Гоффмана[9].
Селективное окисление спиртов
[править | править код]В некоторых случаях N-бромсукцинимид способен окислять спирты[10]. Кори обнаружил случай селективного окисления вторичной спиртовой группы в присутствии первичной, используя NBS в водном диметоксиэтане (диглиме)[11].
Методы синтеза и очистки
[править | править код]N-Бромсукцинимид синтезируют бромированием сукцинимида, при этом бромирование может производиться как действием брома на сукцинимид в присутствии щелочи (лабораторный метод)[12]:
так и бромированием сукцинимида в разбавленной серной кислоте в присутствии бромида натрия (промышленный метод).
N-Бромсукцинимид также может быть синтезирован электролизом водного раствора сукцинимида и NaBr[13].
Хранение
[править | править код]При хранении NBS постепенно выделяется бром, что приводит к неожиданным результатам реакций. Реактив очищают обычно перекристаллизацией из воды при 75-80 °C (200 грамм NBS на 2,5 литра воды) или уксусной кислоты; из нитрометана он кристаллизуется без разложения. Хранят NBS в холодильнике в отсутствие воды. Его преимущество перед бромом в безопасности хранения, тем не менее, все операции с ним проводятся в вытяжном шкафу из-за опасности отравления бромом.
Примечания
[править | править код]- ↑ E. Campaigne and B. F. Tullar. 3-Thenyl bromide (Thiophene, 3-bromomethyl- Архивная копия от 2 июня 2018 на Wayback Machine). Org. Synth. 1953, 33, 96] DOI: 10.15227/orgsyn.033.0096
- ↑ Harpp, D. N.; Bao, L. Q.; Coyle, C.; Gleason, J. G.; Horovitch, S. (1988), «2-Bromohexanoyl chloride», Org. Synth.; Coll. Vol. 6: 190,
- ↑ Stotter, P. L.; Hill, K. A. (1973). «α-Halocarbonyl compounds. II. Position-specific preparation of α-bromoketones by bromination of lithium enolates. Position-specific introduction of α,β-unsaturation into unsymmetrical ketones». J. Org. Chem. 38: 2576. doi:10.1021/jo00954a045.
- ↑ Lichtenthaler, JM; O’dea, DJ; Shapiro, GC; Patel, MB; Mcintyre, JT; Gewitz, MH; Hoegler, CT; Shapiro, JT et al. (1992). «Various Glycosyl Donors with a Ketone or Oxime Function next to the Anomeric Centre: Facile Preparation and Evaluation of their Selectivities in Glycosidations». Synthesis 1992 (9): 179. doi:10.1055/s-1992-34167. PMID 1839242.
- ↑ Amat, M.; Hadida, S.; Sathyanarayana, S.; Bosch, J. (1998), «Regioselective synthesis of 3-substituted indoles», Org. Synth.; Coll. Vol. 9: 417
- ↑ Gilow, H. W.; Burton, D. E. (1981). «Bromination and chlorination of pyrrole and some reactive 1-substituted pyrroles». J. Org. Chem. 46: 2221. doi:10.1021/jo00324a005.
- ↑ Brown. W. D.; Gouliaev, A. H. (2005), «Synthesis of 5-bromoisoquinoline and 5-bromo-8-nitroisoquinoline», Org. Synth. 81: 98
- ↑ Mitchell, R. H.; Lai, Y.H.; Williams, R. V. (1979). «N-Bromosuccinimide-dimethylformamide: a mild, selective nuclear monobromination reagent for reactive aromatic compounds». J. Org. Chem. 44: 4733. doi:10.1021/jo00393a066.
- ↑ Keillor, J. W.; Huang, X. (2004), «Methyl carbamate formation via modified Hofmann rearrangement reactions», Org. Synth.; Coll. Vol. 10: 549
- ↑ J. Am. Chem. Soc. 1950, 72, 12, 5530–5536
- ↑ Corey, E. J.; Ishiguro, M (1979). «Total synthesis of (±)-2-isocyanopupukeanane». Tetrahedron Lett. 20: 2745—2748. doi:10.1016/S0040-4039(01)86404-2.
- ↑ Реакции и методы исследования органических соединений т. 6 М., ГНТИХЛ., 1957, с. 99
- ↑ Реакции и методы исследования органических соединений т. 9 М., ГНТИХЛ., 1959, с. 306
В статье не хватает ссылок на источники (см. рекомендации по поиску). |