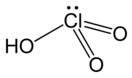
Хлорноватая кислота (}lkjukfgmgx tnvlkmg)
| Хлорноватая кислота | |||
|---|---|---|---|
 | |||
| Общие | |||
| Систематическое наименование |
Хлорноватая кислота | ||
| Хим. формула | HClO3 | ||
| Физические свойства | |||
| Состояние | Бесцветный раствор | ||
| Молярная масса | 84.46 г/моль | ||
| Плотность | 1,282 г/мл | ||
| Химические свойства | |||
| Константа диссоциации кислоты | ~ −1 | ||
| Растворимость | |||
| • в воде | >40 (20 °C) | ||
| Классификация | |||
| Рег. номер CAS | [7790-93-4] | ||
| PubChem | 19654 | ||
| Рег. номер EINECS | 232-233-0 | ||
| SMILES | |||
| InChI | |||
| RTECS | CN9750000 | ||
| ChEBI | 17322 | ||
| ChemSpider | 18513 | ||
| Безопасность | |||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Хлорноватая кислота (лат. Acidum chloricum, HClO3) — сильная одноосновная кислота, в которой хлор имеет степень окисления +5. В свободном виде не получена; в водных растворах при концентрации ниже 30 % на холоде довольно устойчива; в более концентрированных растворах распадается:
Разложение при хранении:
Химические свойства
[править | править код]Хлорноватая кислота — сильный окислитель; окислительная способность увеличивается с возрастанием концентрации и температуры. HClO3 легко восстанавливается до соляной кислоты:
В слабокислой среде HClO3 восстанавливается сернистой кислотой H2SO3 до Cl−, но при пропускании смеси SO2 и воздуха сквозь сильнокислый раствор, образуется диоксид хлора:
В 40%-ной хлорноватой кислоте воспламеняется бумага.
В концентрированном растворе разлагается, продукты разложения зависят от температуры процесса[1]:
Получение
[править | править код]Хлорноватая кислота образуется при разложении хлорноватистой кислоты, при электролизе растворов хлоридов; в лабораторных условиях получают при взаимодействии хлората бария с разбавленной серной кислотой:
Хлораты
[править | править код]Хлорноватой кислоте соответствуют соли — хлораты; из них наибольшее значение имеют хлораты натрия, калия, кальция и магния.
Соли хлорноватой кислоты (хлораты) — сильные окислители, в смеси с восстановителями взрывоопасны.
Многие хлораты ядовиты.
Примечания
[править | править код]- ↑ Лидин, 2000, с. 259.
Литература
[править | править код]- Зефиров Н.С. и др. т.5 Три-Ятр // Химическая энциклопедия. — М.: Большая Российская Энциклопедия, 1998. — 783 с. — ISBN 5-85270-310-9.
- Лидин Р. А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.