Теория кристаллического поля (Mykjnx tjnvmgllncyvtkik hklx)
Теория кристаллического поля — квантовохимическая модель, в которой электронная конфигурация соединений переходных металлов описывается как состояние иона либо атома, находящегося в электростатическом поле, создаваемым окружающими его ионами, атомами или молекулами. Концепция кристаллического поля была предложена Беккерелем для описания состояния атомов в кристаллах и затем развита Хансом Бете и Джоном Ван Флеком для описания низших состояний катионов переходных металлов, окруженных лигандами — как анионами, так и нейтральными молекулами. Теория кристаллического поля была в дальнейшем объединена [и усовершенствована] с теорией (делокализованных) молекулярных орбиталей в более общую теорию поля лигандов, учитывающую частичную ковалентность связи металл-лиганд в координационных соединениях[1].
Теория кристаллического поля позволяет предсказать или интерпретировать оптические спектры поглощения и спектры электронного парамагнитного резонанса кристаллов и комплексных соединений, а также энтальпий гидратации и устойчивости в растворах комплексов переходных металлов.
Обзор теории кристаллического поля
[править | править код]Согласно ТКП, взаимодействие между переходным металлом и лигандами возникает вследствие притяжения между положительно заряженным катионом металла и отрицательным зарядом электронов на несвязывающих орбиталях лиганда. Теория рассматривает изменение энергии пяти вырожденных d-орбиталей в окружении точечных зарядов лигандов. По мере приближения лиганда к иону металла, электроны лиганда становятся ближе к некоторым d-орбиталям, чем к другим, вызывая потерю вырожденности. Электроны d-орбиталей и лигандов отталкиваются друг от друга как заряды с одинаковым знаком. Таким образом, энергия тех d-электронов, которые ближе к лигандам, становится выше, чем тех, которые дальше, что приводит к расщеплению уровней энергии d-орбиталей.
На расщепление влияют следующие факторы:
- Природа иона металла.
- Степень окисления металла. Чем выше степень окисления, тем выше энергия расщепления.
- Расположение лигандов вокруг иона металла.
- Природа лигандов, окружающих ион металла. Чем сильнее эффект от лигандов, тем больше разность между высоким и низким уровнем энергии.
Самый распространённый вид координации лигандов — октаэдрическая, при которой шесть лигандов создают кристаллическое поле октаэдрической симметрии вокруг иона металла. При октаэдрическом окружении иона металла с одним электроном на внешней оболочке d-орбитали разделяются на две группы с разностью энергетических уровней Δокт (энергия расщепления), при этом энергия у орбиталей dxy, dxz и dyz будет ниже, чем у dz2 и dx2-y2, так как орбитали первой группы находятся дальше от лигандов и испытывают меньшее отталкивание. Три орбитали с низкой энергией обозначаются как t2g, а две с высокой — как eg.
Следующими по распространённости являются тетраэдрические комплексы, в которых четыре лиганда образуют тетраэдр вокруг иона металла. В этом случае d-орбитали также разделяются на две группы с разностью энергетических уровней Δтетр. В отличие от октаэдрической координации, низкой энергией будут обладать орбитали dz2 и dx2-y2, а высокой — dxy, dxz и dyz. Кроме того, так как электроны лигандов не находятся непосредственно в направлении d-орбиталей, энергия расщепления будет ниже, чем при октаэдрической координации. С помощью ТКП также можно описать плоскоквадратную и другие геометрии комплексов.
Разность энергетических уровней Δ между двумя или более группами орбиталей зависит также от природы лигандов. Некоторые лиганды вызывают меньшее расщепление, чем другие, причины чего объясняет теория поля лигандов. Спектрохимический ряд — полученный опытным путём список лигандов, упорядоченных в порядке возрастания Δ:[2]
I− < Br− < S2− < SCN− < Cl− < NO3− < N3− < F− < OH− < C2O42− < H2O < NCS− < CH3CN < py < NH3 < en < bipy < phen < NO2− < PPh3 < CN− < CO
Степень окисления металла также влияет на Δ. Металл с более высокой степенью окисления ближе притягивает лиганды за счёт большей разности зарядов. Лиганды, находящиеся ближе к иону металла, вызывают большее расщепление.
Низко- и высокоспиновые комплексы
[править | править код]
Лиганды, вызывающие большое расщепление d-уровней, например CN− и CO, называются лигандами сильного поля. В комплексах с такими лигандами электронам невыгодно занимать орбитали с высокой энергией. Следовательно, орбитали с низкой энергией полностью заполняются до того, как начинается заполнение орбиталей с высокой энергией. Такие комплексы называются низкоспиновыми. Например, NO2− — лиганд сильного поля, создающий большое расщепление. Все 5 d-электронов октаэдрического иона [Fe(NO2)6]3− будут располагаться на нижнем уровне t2g.

Напротив, лиганды, вызывающие малое расщепление, например I− и Br−, называются лигандами слабого поля. В этом случае легче поместить электроны в орбитали с высокой энергией, чем расположить два электрона в одной орбитали с низкой энергией, потому что два электрона в одной орбитали отталкивают друг друга, и затраты энергии на размещение второго электрона в орбитали выше, чем Δ. Таким образом, прежде чем появятся парные электроны, в каждую из пяти d-орбиталей должно быть помещёно по одному электрону в соответствии с правилом Хунда. Такие комплексы называются высокоспиновыми. Например, Br− — лиганд слабого поля, вызывающий малое расщепление. Все 5 d-орбиталей иона [FeBr6]3−, у которого тоже 5 d-электронов, будут заняты одним электроном.
Энергия расщепления для тетраэдрических комплексов Δтетр примерно равна 4/9Δокт (для одинаковых металла и лигандов). В результате этого разность энергетических уровней d-орбиталей обычно ниже энергии спаривания электронов, и тетраэдрические комплексы обычно высокоспиновые.
Диаграммы распределения d-электронов позволяют предсказать магнитные свойства координационных соединений. Комплексы с непарными электронами являются парамагнитными и притягиваются магнитным полем, а без — диамагнитными и слабо отталкиваются.
Энергия стабилизации кристаллическим полем
[править | править код]Энергия стабилизации кристаллическим полем (ЭСКП) — энергия электронной конфигурации иона переходного металла относительно средней энергии орбиталей. Стабилизация возникает вследствие того, что в поле лигандов энергетический уровень некоторых орбиталей ниже, чем в гипотетическом сферическом поле, в котором на все пять d-орбиталей действует одинаковая сила отталкивания, и все d-орбитали вырождены. Например, в октаэдрическом случае уровень t2g ниже, чем средний уровень в сферическом поле. Следовательно, если в данных орбиталях находятся электроны, то ион металла более стабилен в поле лигандов относительно сферического поля. Наоборот, энергетический уровень орбиталей eg выше среднего, и электроны, находящиеся в них, уменьшают стабилизацию.

В октаэдрическом поле три орбитали t2g стабилизированы относительно среднего энергетического уровня на 2/5 Δокт, а две орбитали eg дестабилизированы на 3/5 Δокт. Выше были приведены примеры двух электронных конфигураций d5. В первом примере — низкоспиновый комплекс [Fe(NO2)6]3− с пятью электронами в t2g. Его ЭСКП составляет 5 × 2/5 Δокт = 2Δокт. Во втором примере — высокоспиновый комплекс [FeBr6]3− с ЭСКП (3 × 2/5 Δокт) − (2 × 3/5 Δокт) = 0. В этом случае стабилизирующий эффект электронов в низкоуровневых орбиталях нейтрализуется дестабилизирующим эффектом электронов в высокоуровневых орбиталях.
Диаграммы расщепления d-уровня кристаллическим полем
[править | править код]| октаэдрическая | пентагонально-бипирамидальная | квадратно-антипризматическая |
|---|---|---|
 |
 |
 |
 |
 |
 |
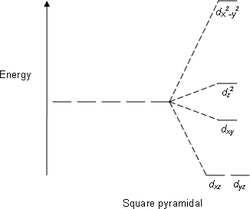
| плоскоквадратная | квадратно-пирамидальная | тетраэдрическая |
 |
 |
 |
 |
 |
 |
| тригонально-бипирамидальная | ||
 | ||
 |
Примечания
[править | править код]- ↑ crystal field // IUPAC Gold Book. Дата обращения: 10 октября 2011. Архивировано 12 сентября 2011 года.
- ↑ Д. Шрайвер, П. Эткинс. Теория кристаллического поля // Неорганическая химия = Inorganic Chemistry. — М.: Мир, 2004. — Т. 1. — С. 359. — 679 с. — ISBN 5-03-003628-8.