Сукцинилхолин (Vrtenunl]klnu)
| Сукцинилхолин | |
|---|---|
| Succinylcholine | |
 | |
| Химическое соединение | |
| ИЮПАК |
2,2'-[(1,4-диоксибутан-1,4-диил)бис(окси)]бис г(N,N,N-триметилэтанаминий) |
| Брутто-формула | C14H30N2O4²⁺ |
| Молярная масса | 290.399 г/моль |
| CAS | 306-40-1 |
| PubChem | 22475 |
| DrugBank | DB00202 |
| Состав | |
| Классификация | |
| Фармакол. группа | н-Холинолитики (миорелаксанты) |
| АТХ | M03AB01 |
| МКБ-10 | Z100 |
| Фармакокинетика | |
| Метаболизм | Псевдохолинэстеразой до сукцинилмонохолина и холина |
| Экскреция | почками (10 %) |
| Лекарственные формы | |
| Раствор для внутривенного и внутримышечного введения | |
| Способы введения | |
| внутривенно, внутримышечно | |
| Другие названия | |
| Суксаметония хлорид, Суксаметония йодид, Суксаметония бромид, Дитилин, Листенон | |
Сукцинилхолин (Суксаметониум, Диацетилхолин) — лекарственное средство, деполяризующий миорелаксант
История
[править | править код]Был синтезирован Бове (Bovet) в 1949 году и разрешён к применению в клинической практике в 1951 году.
Строение и свойства
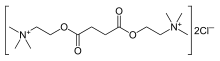
[править | править код]По химическому строению сукцинилхолин — две молекулы ацетилхолина, соединённых между собой (диацетилхолин)[1].
Белый мелкокристаллический порошок. Как и все миорелаксанты, является четвертичным аммониевым соединением. Легко растворим в воде, очень мало — в спирте.
Фармакодинамика
[править | править код]При внутривенном введении сукцинилхолин связывается с постсинаптическими никотиновыми рецепторами и оказывает ацетилхолин-подобное действие, то есть вызывает деполяризацию мембран[2]. Этот процесс сопровождается мышечными сокращениями, которые клинически проявляются фасцикуляциями (мышечные подёргивания). Этот период характеризуют как I (первая) фаза нейромышечного блока. Таким образом нарушается проведение нервно-мышечного возбуждения и возникает расслабление скелетных мышц[3]. При высоких или повторных дозах сукцинилхолина наступает II фаза (недеполяризующий блок), механизм которого не ясен[2]. Препарат также связывается с Н-холинорецепторами других органов и тканей, что объясняет его побочные эффекты.
Фармакокинетика
[править | править код]Для сукцинилхолина характерно быстрое начало действия (30-60 с) и кратковременный эффект (обычно <10 мин)[4][5]. Поступая в кровоток, сукцинилхолин разрушается путём гидролиза псевдохолинэстеразой и распадается на сукцинилмонохолин и холин, причём настолько быстро, что только примерно 10 % препарата попадает в нервно-мышечный синапс[6]. Затем концентрация препарата в сыворотке крови снижается и молекулы сукцинилхолина начинают диффундировать из комплекса с холинорецепторами в кровоток и нервно-мышечная проводимость восстанавливается. Период полувыведения сукцинилхолина составляет примерно 47 секунд[7].
Сукцинилхолин действует дольше при увеличении дозы, а также нарушении метаболизма — при гипотермии (замедляет гидролиз), низкой концентрации или наследственном дефекте псевдохолинэстеразы[8]. Концентрация псевдохолинэстеразы в сыворотке крови может снижаться при беременности, заболеваниях печени и при воздействии некоторых лекарственных средств[9]. У 2 % больных один аллель гена псевдохолинэстеразы нормальный, второй — патологический (гетерозиготный дефект гена псевдохолинэстеразы), что удлиняет действие препарата до 20-30 мин. У 1 больного из 3000 оба аллеля гена псевдохолинэстеразы патологические (гомозиготный дефект гена псевдохолинэстеразы), в результате чего активность псевдохолинэстеразы значительно снижается, при этом нервно-мышечный блок после введения сукцинилхолина длится около 4-8 ч[1].
Дибукаин — местный анестетик, который ингибирует активность нормальной псевдохолинэстеразы на 80 %, активность псевдохолинэстеразы при гетерозиготном дефекте на 60 %, при гомозиготном дефекте — на 20 %. Процент угнетения активности псевдохолинэстеразы называют дибукаиновым числом. Дибукаиновое число прямо пропорционально функциональной активности псевдохолинэстеразы и не зависит от её концентрации. Поэтому для определения активности псевдохолинэстеразы при лабораторном исследовании измеряют концентрацию фермента в ед/л (второстепенный фактор, определяющий активность) и определяют его качественную полноценность — дибукаиновое число (главный фактор, определяющий активность). При длительном параличе скелетных мышц, который возникает после введения сукцинилхолина больным с патологической псевдохолинэстеразой (синоним — атипичная псевдохолинэстераза), осуществляют ИВЛ до тех пор, пока нервно-мышечная проводимость не восстановится. В некоторых странах (но не в США) применяют термически обработанные препараты холинэстеразы человеческой плазмы. Хотя можно использовать свежезамороженную плазму, риск инфекции обычно превышает пользу от трансфузии.
Показания
[править | править код]Сукцинилхолин считают миорелаксантом выбора для стандартной интубации трахеи у взрослых благодаря быстрому началу и короткой продолжительности действия[10]. Хотя рокуроний начинает действовать практически так же быстро, как и сукцинилхолин, он вызывает более длительный блок[11]. Так-же использовался при эндоскопических процедурах (бронхо- и эзофагоскопия, цистоскопия и др.), кратко- временных операциях
Противопоказания
[править | править код]Сукцинилхолин противопоказан при миопатиях из-за риска злокачественной гипертермии, должен с осторожностью применяться у детей до 8 лет из-за высокого риска недиагностированной миопатии Дюшена, при гиперкалиемии, повышении внутриглазного давления, при открытой травме глаза, обширных ожогах(спустя 72 часа после травмы) и параличе.
Режим дозирования
[править | править код]У взрослых доза сукцинилхолина для интубации трахеи составляет 1-1,5 мг/кг внутривенно. Дробное введение сукцинилхолина в низких дозах (10 мг) или длительное капельное введение (1 г на 500—1000 мл раствора), титруемое по эффекту, применяют при некоторых хирургических вмешательствах, требующих кратковременной, но выраженной миорелаксации (например, при эндоскопии ЛОР-органов). К раствору сукцинилхолина часто добавляют метиленовый синий, чтобы не спутать его с другими жидкостями для инфузий. Для предотвращения передозировки препарата и развития II фазы деполяризующего блока следует проводить постоянный мониторинг нервно-мышечной проводимости с помощью стимуляции периферического нерва. Для поддержания миорелаксации более популярен мивакурий — недеполяризующий миорелаксант короткого действия.
Так как сукцинилхолин не растворяется в жирах, его распределение ограничено внеклеточным пространством. Доля внеклеточного пространства на килограмм массы тела у новорождённых и грудных детей больше, чем у взрослых. Следовательно, доза сукцинилхолина у детей выше по сравнению с таковой у взрослых. При в/м введении сукцинилхолина у детей даже доза 4-5 мг/кг не всегда позволяет добиться полной миорелаксации.
Побочные эффекты
[править | править код]Сукцинилхолин имеет многочисленные побочные эффекты. Относительно безопасное его применение возможно только при чётком понимании природы этих явлений.
Сердечно-сосудистая система
[править | править код]Сукцинилхолин, имея схожую структуру с ацетилхолином, взаимодействует также с холинорецепторами и вне нервно-мышечного синапса. Стимуляция H-холинорецепторов парасимпатических и симпатических ганглиев, а также M-холинорецепторов синоатриального узла в сердце приводит к увеличению или уменьшению артериального давления и частоты сердечных сокращений.
Метаболит сукцинилхолина стимулирует м-холинорецепторы синоатриального узла, что вызывает брадикардию. Хотя к этому эффекту особенно чувствительны дети, после второй дозы сукцинилхолина брадикардия развивается и у взрослых. Для профилактики брадикардии вводят атропин: во всех возрастных группах обязательно перед инъекцией второй дозы сукцинилхолина, а у детей часто и перед первой инъекцией. Дозы атропина: у детей — 0,02 мг/кг в/в, у взрослых — 0,4 мг в/в. Иногда сукцинилхолин вызывает узловую брадикардию и желудочковые эктопические ритмы.
Фасцикуляции
[править | править код]При введении сукцинилхолина о начале миорелаксации сигнализируют видимые глазом сокращения моторных единиц, которые называются фасцикуляциями. Фасцикуляции можно предотвратить предварительным введением недеполяризующего миорелаксанта в низкой дозе (прекураризация). Так как это взаимодействие препятствует развитию I фазы деполяризующего блока, требуются высокие дозы сукцинилхолина (1,5 мг/кг).
Гиперкалиемия
[править | править код]При введении сукцинилхолина деполяризация приводит к тому, что из здоровых мышц выделяется калий с увеличением его концентрации в сыворотке крови до 0,5 ммоль/л. При нормальной концентрации калия этот феномен не имеет клинического значения, но при некоторых состояниях (обширные ожоги, травмы, некоторые неврологические заболевания) возникающая гиперкалиемия может привести к нарушению ритма и даже к остановке сердца, которая часто бывает рефрактерна (устойчива) к стандартным реанимационным мероприятиям: для снижения концентрации калия и устранения метаболического ацидоза требуются кальций, инсулин и глюкоза, бикарбонат, катионо-обменная смола, дантролен и даже искусственное кровообращение.
К состоянием высокого риска относят обширные ожоги и травмы, тяжёлую внутрибрюшную инфекцию, травму спинного мозга, энцефалит, инсульт, синдром Гийена-Барре, Тяжёлые формы болезни Паркинсона, столбняк, длительную неподвижность, полинейропатии и миопатии, разрыв артериальной аневризмы головного мозга, закрытые черепно-мозговые травмы, утопление, геморрагический шок с метаболическим ацидозом.
Если травма вызывает денервацию (например, при полном поперечном разрыве спинного мозга денервации подвергаются многие группы мышц), то холинорецепторы формируются на мембранах мышц вне нервно-мышечного синапса, что при введении сукцинилхолина вызывает всеохватывающую деполяризацию мышц и мощный выброс калия в кровоток[12]. Предварительное введение недеполяризующего миорелаксанта не вызывает достоверного предотвращения высвобождения калия и не устраняет угрозы опасных для жизни осложнений. Риск гиперкалиемии достигает максимума на 7-10-й день после травмы, но точные временные параметры периода риска неизвестны[1].
Боль в мышцах
[править | править код]При введении сукцинилхолина часто возникают миалгии (боли в мышцах) в послеоперационном периоде, что связано с фасцикуляциями и микротравмой мышц вследствие них. На миалгию чаще всего жалуются молодые люди (чаще женщины) после амбулаторных хирургических вмешательств[13]. При беременности, а также в детском и преклонном возрасте риск миалгии уменьшается[14][15][16].
Некоторые исследования говорят о том, что предварительное введение недеполяризующего миорелаксанта или лидокаина (1-1,5 мг/кг) уменьшает вероятность возникновения миалгии[1][13]. Нестероидные противовоспалительные препараты эффективны при лечении миалгии[17].
Повышение давления в полости желудка
[править | править код]Фасцикуляции мышц брюшной стенки увеличивают давление в просвете желудка, что в свою очередь приводит к повышению тонуса нижнего пищеводного сфинктера. Следовательно, эти два эффекта взаимопоглощаются, и сукцинилхолин, вероятнее всего, не увеличивает риск возникновения желудочного рефлюкса и лёгочной аспирации. Предварительное введение недеполяризующего миорелаксанта предотвращает как увеличение давления в просвете желудка, так и компенсаторное повышение тонуса нижнего пищеводного сфинктера.
Однако следует соблюдать настороженность к желудочной регургитации и профилактировать её с помощью возвышенного положения головного конца тела и приёма Селика.
Повышение внутриглазного давления
[править | править код]Сукцинилхолин повышает внутриглазное давление, что связано с сокращением мышц глазного яблока. При этом у пациентов с травмой глаза увеличивается риск повреждения, в частности при проникающим ранением глаза теоретически существует опасность вытекания стекловидного тела[9]. Некоторые авторы оспаривают это утверждение[18][19]. Предварительное введение недеполяризующего миорелаксанта не всегда предотвращает увеличение внутриглазного давления.
Злокачественная гипертермия
[править | править код]Сукцинилхолин — мощный провоцирующий фактор злокачественной гипертермии. Ранним симптомом злокачественной гипертермии часто служит парадоксальное сокращение челюстных мышц после введения сукцинилхолина.
Генерализованные сокращения
[править | править код]При миотонии введение сукцинилхолина может вызывать миоклонус.
Длительный паралич скелетной мускулатуры
[править | править код]Как уже отмечалось ранее, при низкой концентрации нормальной псевдохолинэстеразы введение сукцинилхолина вызывает умеренное удлинение деполяризующего блока. После введения сукцинилхолина больным с патологической псевдохолинэстеразой возникает длительный паралич скелетных мышц. В отсутствие адекватной респираторной поддержки это осложнение представляет серьёзную опасность.
Повышение внутричерепного давления
[править | править код]Сукцинилхолин может увеличивать мозговой кровоток и внутричерепное давление[20]. Это также можно предотвратить с помощью прекураризации и инъекции лидокаина (1,5-2 мг/кг) за 2-3 мин до интубации, а также предварительной ИВЛ в режиме гипервентиляции. Интубация трахеи с неадекватной анестезией и миорелаксацией увеличивает внутричерепное давление значительно сильнее, чем сукцинилхолин[21].
Хранение
[править | править код]Хранение: список А. В защищённом от света месте (в холодильнике) при температуре от +2 °C до +8 °C (для предупреждения спонтанного гидролиза).
Примечания
[править | править код]- ↑ 1 2 3 4 Морган-мл. Дж. Э., Мэгид С. М., перевод Бунятин А. А., Клиническая анестезиология: книга первая, Изд. Москва, Бином, 2008
- ↑ 1 2 Богданов А. А., врач анестезиолог, Wexham Park and Heatherwood Hospitals, Berkshire, UK. Сукцинилхолин – друг или враг? Дата обращения: 1 декабря 2011. Архивировано 13 октября 2012 года.
- ↑ Cahalan, Michael D.; Barash, Paul G.; Cullen, Bruce F.; Stoelting, Robert K. Handbook of Clinical Anesthesia. — Hagerstwon, MD: Lippincott Williams & Wilkins[англ.], 2009. — С. 143—144. — ISBN 0-7817-8948-6.
- ↑ Curran M.J., Donati F., Bevan D.R. Onset and recovery of atracurium and suxamethonium-induced neuromuscular blockade with simultaneous train-of-four and single twitch stimulation (англ.) // Br J Anaesth[англ.] : journal. — 1987. — August (vol. 59, no. 8). — P. 989—994. — PMID 3651281.
- ↑ Viby-Mogensen J. Correlation of succinylcholine duration of action with plasma cholinesterase activity in subjects with the genotypically normal enzyme (англ.) // Anesthesiology[англ.] : journal. — Lippincott Williams & Wilkins[англ.], 1980. — December (vol. 53, no. 6). — P. 517—520. — PMID 7457973. (недоступная ссылка)
- ↑ Gissen A.J., Katz R.L., Karis J.H., Papper E.M. Neuromuscular block in man during prolonged arterial infusion with succinylcholine (англ.) // Anesthesiology[англ.] : journal. — Lippincott Williams & Wilkins[англ.], 1966. — Vol. 27, no. 3. — P. 242—249. — PMID 5937158.
- ↑ Torda T.A., Graham G.G., Warwick N.R., Donohue P. Pharmacokinetics and pharmacodynamics of suxamethonium (англ.) // Anaesth Intensive Care : journal. — 1997. — June (vol. 25, no. 3). — P. 272—278. — PMID 9209610.
- ↑ Mikhail, Maged S.; Murray, Michael P. Morgan's Clinical anesthesiology. — New York: Lange Medical Books/McGraw Hill Medical Pub. Division, 2006. — ISBN 0-07-110515-8.
- ↑ 1 2 Бунятян А.А. Рациональная фармакотерапия в анестезиологии. — Литерра, 2006. — С. 181—183. — 800 с. — ISBN 5-98216-040-7.
- ↑ Miller R. Will succinylcholine ever disappear? (англ.) // Anesth. Analg.[англ.] : journal. — 2004. — June (vol. 98, no. 6). — P. 1674—1675. — PMID 15155326.
- ↑ Perry J.J., Lee J.S., Sillberg V.A., Wells G.A. Rocuronium versus succinylcholine for rapid sequence induction intubation (англ.) // Cochrane Database of Systematic Reviews : journal. — 2008. — No. 2. — P. CD002788. — doi:10.1002/14651858.CD002788.pub2. — PMID 18425883.
- ↑ Martyn J.A., Richtsfeld M. Succinylcholine-induced hyperkalemia in acquired pathologic states: etiologic factors and molecular mechanisms (англ.) // Anesthesiology[англ.] : journal. — Lippincott Williams & Wilkins[англ.], 2006. — January (vol. 104, no. 1). — P. 158—169. — PMID 16394702. Архивировано 28 августа 2014 года.
- ↑ 1 2 Wong S.F., Chung F. Succinylcholine-associated postoperative myalgia (англ.) // Anaesthesia[англ.]. — Wiley-Blackwell, 2000. — February (vol. 55, no. 2). — P. 144—152. — PMID 10651675.
- ↑ Thind G.S., Bryson T.H. Single dose suxamethonium and muscle pain in pregnancy (англ.) // Br J Anaesth[англ.] : journal. — 1983. — August (vol. 55, no. 8). — P. 743—745. — PMID 6882612.
- ↑ BUSH G.H., ROTH F. Muscle pains after suxamethonium chloride in children (англ.) // Br J Anaesth[англ.] : journal. — 1961. — March (vol. 33). — P. 151—155. — PMID 13689350.
- ↑ FOSTER C.A. Muscle pains that follow administration of suxamethonium (англ.) // Br Med J : journal. — 1960. — July (vol. 2, no. 5191). — P. 24—5. — PMID 13824106. — PMC 2096870.
- ↑ Schreiber J.U., Lysakowski C., Fuchs-Buder T., Tramèr M.R. Prevention of succinylcholine-induced fasciculation and myalgia: a meta-analysis of randomized trials (англ.) // Anesthesiology[англ.] : journal. — Lippincott Williams & Wilkins[англ.], 2005. — October (vol. 103, no. 4). — P. 877—884. — PMID 16192781. Архивировано 7 июля 2012 года.
- ↑ Vachon C.A., Warner D.O., Bacon D.R. Succinylcholine and the open globe. Tracing the teaching (англ.) // Anesthesiology[англ.] : journal. — Lippincott Williams & Wilkins[англ.], 2003. — July (vol. 99, no. 1). — P. 220—223. — PMID 12826863. (недоступная ссылка)
- ↑ Libonati M.M., Leahy J.J., Ellison N. The use of succinylcholine in open eye surgery (англ.) // Anesthesiology[англ.]. — Lippincott Williams & Wilkins[англ.], 1985. — May (vol. 62, no. 5). — P. 637—640. — PMID 3994030.
- ↑ Minton M.D., Grosslight K., Stirt J.A., Bedford R.F. Increases in intracranial pressure from succinylcholine: prevention by prior nondepolarizing blockade (англ.) // Anesthesiology[англ.]. — Lippincott Williams & Wilkins[англ.], 1986. — August (vol. 65, no. 2). — P. 165—169. — PMID 2874752.
- ↑ Cahalan, Michael D.; Barash, Paul G.; Cullen, Bruce F.; Stoelting, Robert K. Clinical anesthesia. — Philadelphia: Wolters Kluwer Health/Lippincott Williams & Wilkins, 2009. — С. 427—429. — ISBN 0-7817-8763-7.
Для улучшения этой статьи по фармакологии желательно:
|