Ранняя болезнь Альцгеймера (Jguuxx Qkly[u, Gl,eiywbyjg)
Ранняя болезнь Альцгеймера (англ. Early-onset Alzheimer's disease, EOAD), также болезнь Альцгеймера с ранним началом (англ. Younger-onset Alzheimer's disease, YOAD)[1] — болезнь Альцгеймера, диагностируемая в возрасте до 65 лет. Это необычная форма болезни, на которую приходится всего 5—10 % всех случаев заболеваний. Около 60 % имеют положительный семейный анамнез болезни Альцгеймера, и 13 % из них наследуются по аутосомно-доминантному типу. Большинство случаев болезни Альцгеймера с ранним началом имеет те же черты, что и обычная форма, и не вызвано известными генетическими мутациями.
Болезнь может развиться у людей в возрасте 30—40 лет, хотя и крайне редко[2], в основном страдают люди в возрасте 50—60 лет.
Семейная и несемейная болезнь Альцгеймера
[править | править код]Болезнь Альцгеймера (БА) является нейродегенеративным заболеванием и наиболее частой причиной деменции; обычно начинается в пожилом возрасте. Семейная болезнь Альцгеймера является наследственной и редкой формой БА. Семейная БА обычно проявляется в более раннем возрасте — до 65 лет — и подразумевает наличие нескольких больных в одном или нескольких поколениях. Несемейные случаи БА называются «спорадической» БА, когда генетические факторы риска незначительны или неясны[3]. Семейная болезнь Альцгеймера составляет 10—15 % всех случаев EOAD.
Признаки и симптомы
[править | править код]EOAD поражает обычно между 30 и 60 годами. Ранние признаки AD включают необычную потерю памяти, особенно при запоминании недавних событий и имён людей и вещей (логопеническая первичная прогрессирующая афазия). По мере прогрессирования заболевания у пациента появляются более серьёзные проблемы, он становится подвержен перепадам настроения и не может выполнять сложные действия, такие как вождение автомобиля. Другие распространённые признаки включают спутанность сознания, неверные суждения, нарушение речи, возбуждение, абстиненцию, галлюцинации, судороги, синдром Паркинсона, повышенный мышечный тонус, миоклонус, недержание мочи, недержание кала и мутизм. На более поздних стадиях EOAD больные забывают, как выполнять простые действия, и требуют постоянного ухода.
Причины
[править | править код]Семейная БА наследуется по аутосомно-доминантному типу, определяется генетикой и другими характеристиками, такими как возраст начала заболевания.
Генетика
[править | править код]
Семейная болезнь Альцгеймера вызывается мутацией по меньшей мере в одном из трех генов, которые кодируют пресенилин 1, пресенилин 2 и АРР[4].
PSEN1 — Пресенилин 1
[править | править код]Ген пресенилина 1 (PSEN1, расположенный на хромосоме 14) был идентифицирован Шеррингтоном (1995)[5], и были идентифицированы множественные мутации. Мутации в этом гене с уверенностью вызывают семейную болезнь Альцгеймера 3 типа обычно в возрасте до 50 лет. На этот тип приходится 30-70 % EOFAD. Этот белок был идентифицирован как часть ферментативного комплекса, который отщепляет бета-амилоидный пептид от АРР[a]
Ген содержит 14 экзонов, а кодирующая часть оценивается в 60 т.п.н., как сообщают Rogaev (1997)[7] и Del-Favero (1999)[8]. Белок, кодируемый геном (PS1), является интегральным мембранным белком. Как утверждает Ikeuchi (2002)[9], он расщепляет белок Notch1, поэтому Koizumi (2001)[10] считает, что он играет роль в сомитогенезе у эмбриона. Он также оказывает действие на белок-предшественник амилоида, что указывает на вероятную роль в патогенезе БАД. Гомологи PS1 обнаружены у растений, беспозвоночных и других позвоночных.
Некоторые из мутаций в гене, из которых известно более 90, включают: His163Arg, Ala246Glu, Leu286Val и Cys410Tyr. Большинство из них демонстрирует полную пенетрантность, но распространенной мутацией является Glu318Gly, и это предрасполагает людей к семейной БА, при этом исследование Taddei (2002)[11] выявило заболеваемость 8,7 % у пациентов с семейной БА.
PSEN2 — Пресенилин 2
[править | править код]Ген пресенилина 2 (PSEN2) очень похож по структуре и функциям на PSEN1 . Он расположен на хромосоме 1 (1q31-q42), и мутации в этом гене вызывают БАД 4 типа. На этот тип приходится менее 5 % всех случаев EOFAD. Ген был идентифицирован Рудольфом Танзи и Джерри Шелленбергом в 1995 году[12]. Последующее исследование Kovacs (1996)[13] показало, что белки PS1 и PS2 обнаруживаются в одинаковых количествах и в одних и тех же органеллах в нервных клетках млекопитающих. Levy-Lahad (1996)[14] определил, что PSEN2 содержит 12 экзонов, 10 из которых являются кодирующими экзонами, и что первичный транскрипт кодирует полипептид из 448 аминокислот с гомологией PS1 на 67 %. Этот белок был идентифицирован как часть ферментативного комплекса, который отщепляет бета-амилоидный пептид от АРР (см. ниже).
Мутации не так хорошо изучены, как PSEN1, но были идентифицированы различные аллельные варианты. К ним относится Asn141Ile, впервые идентифицированный Рудольфом Танци и Джерри Шелленбергом в семьях поволжских немцев с семейной болезнью Альцгеймера (Levy-Lahad et al. Природа, 1995). Одно из этих исследований, проведенное Nochlin (1998), выявило тяжелую амилоидную ангиопатию у больных членов семьи. Этот фенотип может быть объяснен исследованием Tomita (1997)[15], предполагающим, что мутация Asn141Ile изменяет метаболизм АРР, вызывая повышенную скорость отложения белка в бляшках.
Другими аллельными вариантами являются Met239Val, который был идентифицирован в итальянской родословной Рогаевым (1995)[16], который также ранее предположил, что ген может быть подобен PSEN1, и мутация Asp439Ala в экзоне 12 гена, предложенная Lleo (2001)[17] для изменения эндопротеолитического процессинга ФС2.
APP — белок-предшественник бета-амилоида (A4)
[править | править код]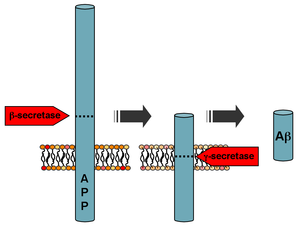
Мутации в белке-предшественнике бета-амилоида А4 (APP), расположенном на длинном плече хромосомы 21 (21q21.3), вызывают семейную болезнь Альцгеймера[18]. На этот тип приходится не более 10-15 % EOFAD.
Три из различных мутаций АРР идентифицированы и охарактеризованы: шведская мутация[19], лондонская мутация (АРР V717I)[20][21] и арктическая мутация[22]. Функциональный анализ этих мутаций значительно расширил понимание патогенеза заболевания. В то время как шведская мутация, расположенная в сайте расщепления β-секретазы, приводит к общему более высокому продуцированию пептидов Aβ за счет увеличения β-секреторного расщепления[23], мутация London, а также другие мутации в кодоне 717 АРР, сдвигает соотношение токсичных видов Aβ к более склонному к агрегации пептиду длиной 42 аминокислоты[24], в то время как мутация Arctic приводит к изменению конформации пептида Aβ и увеличению образования токсичных протофибрилл Aβ[25].
Механизм
[править | править код]Гистологически семейная БА практически неотличима от других форм заболевания. Отложения амилоида можно увидеть в срезах ткани головного мозга . Этот амилоидный белок образует бляшки и нейрофибриллярные клубки, которые продвигаются по мозгу. Очень редко бляшка может быть уникальной или нехарактерной для БА; это может произойти, когда в одном из генов происходит мутация, которая создает функциональный, но деформированный белок вместо неэффективных генных продуктов, которые обычно возникают в результате мутаций.
Нейробиология этого заболевания только недавно начинает пониматься. Исследователи работали над картированием путей воспаления, связанных с развитием, прогрессированием и дегенеративными свойствами БА. Основные молекулы, участвующие в этих путях, включают глиальные клетки (особенно астроциты и микроглию), бета-амилоид и провоспалительные соединения. Когда нейроны по всему мозгу повреждаются и умирают, связи между сетями нейронов могут нарушаться, и многие области мозга начинают сжиматься. На последних стадиях болезни Альцгеймера этот процесс, называемый атрофией головного мозга, широко распространен, вызывая значительную потерю объёма мозга. Эта потеря объёма мозга влияет на способность жить и нормально функционировать, что в конечном итоге приводит к летальному исходу[26].
Бета-амилоид представляет собой небольшую часть более крупного белка, называемого белком-предшественником амилоида (АРР). Как только APP активируется, он разрезается на более мелкие участки других белков. Одним из фрагментов, образующихся в этом процессе разрезания, является β-амилоид. β-амилоид более «липкий», чем любой другой фрагмент, полученный из разрезаемого АРР, поэтому он запускает процесс накопления в головном мозге, что обусловлено различными генетическими и биохимическими аномалиями. В конце концов фрагменты образуют олигомеры, затем фибриллы, бета-слои и, наконец, бляшки. Присутствие β-амилоидных бляшек в головном мозге заставляет организм активировать клетки микроглии и астроциты[27].
После расщепления β-секретазой АРР расщепляется мембраносвязанным белковым комплексом, называемым γ-секретазой, с образованием Aβ[28]. Пресенилины 1 и 2 являются ферментативными центрами этого комплекса наряду с никастрином, Aph1 и PEN-2. Расщепление АРР альфа-секретазой, которое препятствует продукции Aβ, является наиболее распространенным событием процессинга АРР. В гене APP обнаружена 21 аллельная мутация. Они гарантируют начало семейной болезни Альцгеймера с ранним началом, и все они происходят в области гена АРР, который кодирует домен Aβ.
Генетическое тестирование
[править | править код]Генетическое тестирование доступно для лиц с симптомами и бессимптомных родственников[29]. Среди семей с EOFAD 40-80 % будут иметь обнаруживаемую мутацию в гене APP, PSEN1 или PSEN2. Следовательно, в некоторых семьях с EOFAD не будет идентифицируемой мутации при тестировании.
История
[править | править код]Симптомы болезни Альцгеймера как отдельной нозологической единицы были впервые выявлены Эмилем Крепелином, работавшим в лаборатории Альцгеймера, а характерная нейропатология впервые наблюдалась Алоизом Альцгеймером в 1906 году. Из-за огромного значения, которое Крепелин придавал поиску невропатологической основы психических расстройств, он принял решение, что болезнь будет носить имя Альцгеймера[30].
Направления исследований
[править | править код]В то время как семейная AD с ранним началом, по оценкам, составляет только 1 % от общего числа случаев болезни Альцгеймера[2], она представляет собой полезную модель для изучения различных аспектов этого расстройства. В настоящее время мутации гена семейной БА с ранним началом определяют подавляющее большинство терапевтических открытий и разработок на основе животных моделей для БА[31].
Примечания
[править | править код]Комментарии
- ↑ Ген на хромосоме 21, который тоже вызывает раннюю болезнь Альцгеймера. Этот ген помогает понять, почему у людей с синдромом Дауна, у которых есть лишняя хромосома 21, если они проживают больше 40–50 лет, всегда развивается болезнь Альцгеймера[6].
Источники
- ↑ Younger/ Early-onset Alzheimer's (англ.). Alzheimer's Association. Дата обращения: 9 июля 2020. Архивировано 29 июня 2020 года.
- ↑ 1 2 "The prevalence and causes of dementia in people under the age of 65 years". Journal of Neurology, Neurosurgery, and Psychiatry. 74 (9): 1206—1209. September 2003. doi:10.1136/jnnp.74.9.1206. PMID 12933919.
- ↑ Piaceri, Irene (2013). "Genetics of familial and sporadic Alzheimer s disease". Frontiers in Bioscience. E5 (1): 167—177. doi:10.2741/E605. ISSN 1945-0494. PMID 23276979. Архивировано 2 декабря 2021. Дата обращения: 23 марта 2023.
- ↑ "Thirty years of Alzheimer's disease genetics: the implications of systematic meta-analyses". Nature Reviews. Neuroscience. 9 (10): 768—778. October 2008. doi:10.1038/nrn2494. PMID 18802446.
- ↑ "Cloning of a gene bearing missense mutations in early-onset familial Alzheimer's disease". Nature. 375 (6534): 754—760. June 1995. Bibcode:1995Natur.375..754S. doi:10.1038/375754a0. PMID 7596406.
- ↑ Пескин, 2023, с. 58.
- ↑ "Analysis of the 5' sequence, genomic structure, and alternative splicing of the presenilin-1 gene (PSEN1) associated with early onset Alzheimer disease". Genomics. 40 (3): 415—424. March 1997. doi:10.1006/geno.1996.4523. PMID 9073509.
- ↑ "YAC fragmentation with repetitive and single-copy sequences: detailed physical mapping of the presenilin 1 gene on chromosome 14". Gene. 229 (1—2): 193—201. March 1999. doi:10.1016/S0378-1119(99)00023-2. PMID 10095119.
- ↑ "Cell-free generation of the notch1 intracellular domain (NICD) and APP-CTfgamma: evidence for distinct intramembranous "gamma-secretase" activities". Neuromolecular Medicine. 1 (1): 43—54. 2002. doi:10.1385/NMM:1:1:43. PMID 12025815.
- ↑ "The role of presenilin 1 during somite segmentation". Development. 128 (8): 1391—1402. April 2001. doi:10.1242/dev.128.8.1391. PMID 11262239.
- ↑ "Association between presenilin-1 Glu318Gly mutation and familial Alzheimer's disease in the Australian population". Molecular Psychiatry. 7 (7): 776—781. 2002. doi:10.1038/sj.mp.4001072. PMID 12192622.
- ↑ "Candidate gene for the chromosome 1 familial Alzheimer's disease locus". Science. 269 (5226): 973—977. August 1995. Bibcode:1995Sci...269..973L. doi:10.1126/science.7638622. PMID 7638622.
- ↑ "Alzheimer-associated presenilins 1 and 2: neuronal expression in brain and localization to intracellular membranes in mammalian cells". Nature Medicine. 2 (2): 224—229. February 1996. doi:10.1038/nm0296-224. PMID 8574969.
- ↑ "Genomic structure and expression of STM2, the chromosome 1 familial Alzheimer disease gene". Genomics. 34 (2): 198—204. June 1996. doi:10.1006/geno.1996.0266. PMID 8661049.
- ↑ "The presenilin 2 mutation (N141I) linked to familial Alzheimer disease (Volga German families) increases the secretion of amyloid beta protein ending at the 42nd (or 43rd) residue". Proceedings of the National Academy of Sciences of the United States of America. 94 (5): 2025—2030. March 1997. Bibcode:1997PNAS...94.2025T. doi:10.1073/pnas.94.5.2025. PMID 9050898.
- ↑ "Familial Alzheimer's disease in kindreds with missense mutations in a gene on chromosome 1 related to the Alzheimer's disease type 3 gene". Nature. 376 (6543): 775—778. August 1995. Bibcode:1995Natur.376..775R. doi:10.1038/376775a0. PMID 7651536.
- ↑ "A novel presenilin 2 gene mutation (D439A) in a patient with early-onset Alzheimer's disease". Neurology. 57 (10): 1926—1928. November 2001. doi:10.1212/WNL.57.10.1926. PMID 11723295.
- ↑ "Genetics of Alzheimer's disease: a centennial review". Neurologic Clinics. 25 (3): 611—667, v. August 2007. doi:10.1016/j.ncl.2007.03.009. PMID 17659183.
- ↑ "A pathogenic mutation for probable Alzheimer's disease in the APP gene at the N-terminus of beta-amyloid". Nature Genetics. 1 (5): 345—347. August 1992. doi:10.1038/ng0892-345. PMID 1302033.
- ↑ Goate, Alison (February 1991). "Segregation of a missense mutation in the amyloid precursor protein gene with familial Alzheimer's disease". Nature. 349 (6311): 704—706. Bibcode:1991Natur.349..704G. doi:10.1038/349704a0. PMID 1671712.
- ↑ Lloyd, Grace M. (December 2020). "Prominent amyloid plaque pathology and cerebral amyloid angiopathy in APP V717I (London) carrier – phenotypic variability in autosomal dominant Alzheimer's disease". Acta Neuropathologica Communications. 8 (1): 31. doi:10.1186/s40478-020-0891-3. PMID 32164763.
{{cite journal}}: Википедия:Обслуживание CS1 (не помеченный открытым DOI) (ссылка) - ↑ "The 'Arctic' APP mutation (E693G) causes Alzheimer's disease by enhanced Abeta protofibril formation" (PDF). Nature Neuroscience. 4 (9): 887—893. September 2001. doi:10.1038/nn0901-887. PMID 11528419. Архивировано (PDF) 24 февраля 2022. Дата обращения: 23 марта 2023.
- ↑ "Increased beta-amyloid release and levels of amyloid precursor protein (APP) in fibroblast cell lines from family members with the Swedish Alzheimer's disease APP670/671 mutation". FEBS Letters. 354 (3): 274—278. November 1994. doi:10.1016/0014-5793(94)01137-0. PMID 7957938.
- ↑ De Jonghe, C. (1 August 2001). "Pathogenic APP mutations near the gamma-secretase cleavage site differentially affect Abeta secretion and APP C-terminal fragment stability". Human Molecular Genetics. 10 (16): 1665—1671. doi:10.1093/hmg/10.16.1665. PMID 11487570.
- ↑ "Physiochemical characterization of the Alzheimer's disease-related peptides A beta 1-42Arctic and A beta 1-42wt". The FEBS Journal. 273 (12): 2618—2630. June 2006. doi:10.1111/j.1742-4658.2006.05263.x. PMID 16817891.
- ↑ What Happens to the Brain in Alzheimer's Disease? (англ.). National Institute on Aging. Дата обращения: 7 мая 2020. Архивировано 11 мая 2020 года.
- ↑ Singh, Deepali (2022-08-17). "Astrocytic and microglial cells as the modulators of neuroinflammation in Alzheimer's disease". Journal of Neuroinflammation. 19 (1): 206. doi:10.1186/s12974-022-02565-0. ISSN 1742-2094. PMID 35978311. Архивировано 25 февраля 2023. Дата обращения: 23 марта 2023.
{{cite journal}}: Википедия:Обслуживание CS1 (не помеченный открытым DOI) (ссылка) - ↑ "An overview of APP processing enzymes and products". Neuromolecular Medicine. 12 (1): 1—12. March 2010. doi:10.1007/s12017-009-8104-z. PMID 20232515.
- ↑ "Genetic aspects of Alzheimer disease". The Neurologist. 15 (2): 80—86. March 2009. doi:10.1097/NRL.0b013e318187e76b. PMID 19276785.
- ↑ "Aloys Alzheimer, a coworker of Emil Kraepelin". Journal of Psychiatric Research. 31 (6): 635—643. 1997. doi:10.1016/S0022-3956(97)00035-6. PMID 9447568.
- ↑ Elsheikh, SS (January 2020). "Genome-wide association study of brain connectivity changes for Alzheimer's disease". Scientific Reports. 10 (1). Bibcode:2020NatSR..10.1433E. doi:10.1038/s41598-020-58291-1. PMID 31996736.
Литература
[править | править код]- Сара Мэннинг Пескин. В молекуле от безумия. Истории о том, как ломается мозг = Sara Manning Peskin. A Molecule Away from Madness: Tales of the Hijacked Brain. — М.: Альпина Паблишер, 2023. — С. 224. — ISBN 978-5-9614-7697-2.