Нитрофенолы (Unmjksyukld)
Перейти к навигации
Перейти к поиску
Нитрофенолы (гидроксинитробензолы) — органические соединения, нитропроизводные фенола, с общей формулой HOC6H5-n(NO2)n.
Номенклатура
[править | править код]- Мононитрофенолы — три изомера по положению заместителя — нитрогруппы:
-
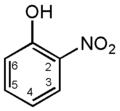
2-нитрофенол
(о-нитрофенол) -
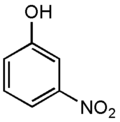
3-нитрофенол
(м-нитрофенол) -
4-нитрофенол
(п-нитрофенол)
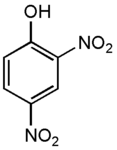
- Динитрофенолы — шесть изомеров по положению заместителей — нитрогрупп:
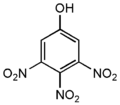
- Тринитрофенолы — шесть изомеров по положению заместителей — нитрогрупп:
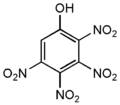
- Тетранитрофенолы — три изомера по положению заместителей — нитрогрупп:
- Пентанитрофенол:
Получение
[править | править код]- Из мононитрофенолов практическое значение имеют 2- и 4-нитрофенолы. В промышленности их получают нагреванием соответствующих 2- и 4-нитрохлорбензолов с 10-15%-ным водным раствором NaOH при 150—190 °С и давлении 0,2-0,6 МПа, а также нитрованием фенола разбавленной азотной кислотой (катализатор — NaNO2) с последующим фракционированием смеси. 3-Нитрофенол получают диазотированием 3-нитроанилина с последующим замещением диазогруппы на гидроксигруппу.
- Динитрофенолы в промышленности обычно получают нитрованием фенолов или мононитрофенолов. 2,4-динитрофенол синтезируют также щелочным гидролизом 2,4-динитрохлорбензола.
- Тринитрофенол получают нитрованием фенолдисульфокислоты смесью азотной и серной кислот; из динитрохлорбензола через гидролиз до динитрофенола с последующим нитрованием; из бензола действием азотной кислоты в присутствии Hg(NO3)2.
Физические свойства
[править | править код]| Изомер | Молекулярная масса, г/моль |
Внешний вид | Тплав. °С |
Ткип. °С |
Плотность, г/см³ |
Растворимость, г/100 г р-рителя |
|---|---|---|---|---|---|---|
| 2-нитрофенол | 139,12 | бледно-жёлтые многогранные иглы | 45; 45,3-46,0 | 214,5;217,25; 216 | 1,294240°С | в воде 0,21; в этаноле 46 |
| 3-нитрофенол | бесцветные многогранные кристаллы | 96; 97 | 19470 мм Hg | 1,485 | в воде 1,35: в этаноле 195 | |
| 4-нитрофенол | жёлтые многогранные призмы | 114; 114-114,6 | 279разл. | 1,479 | в воде 1,6: в этаноле 189,5 | |
| 2,3-динитрофенол | 184,11 | жёлтые многогранные иглы | 144 | 1,681 | трудно растворим в воде, легко — в этаноле и эфире | |
| 2,4-динитрофенол | жёлтые ромбические пластинки | 111,6; 114; 115-116возг. | 1,683 | в воде 0,56, в этаноле 3,9 | ||
| 2,5-динитрофенол | жёлтые иглы | 108 | трудно растворим в воде, легко в этаноле и эфире | |||
| 2,6-динитрофенол | бледно-жёлтые ромбические иглы | 63-64 | трудно растворим в воде, легко — в этаноле и эфире | |||
| 3,4-динитрофенол | бесцветные триклинные иглы | 134 | 1,672 | растворим в этаноле и эфире | ||
| 3,5-динитрофенол | многогранные пластины | 122; 123; 126,1 | 1,702 | не растворим в воде, легко — в этаноле и эфире | ||
| 2,3,6-тринитрофенол | 229,11 | иглы | 118 | трудно растворим в воде, легко — в этаноле и эфире | ||
| 2,4,5-тринитрофенол | иглы | 96 | трудно растворим в воде, легко — в этаноле и эфире | |||
| 2,4,6-тринитрофенол | бесцветные многогранники | 80,7 | 1952 мм Hg >300взрыв. | 1,763 | в воде 1,4; в этаноле 4,91; в эфире 1,43 | |
| 2,3,4,6-тетранитрофенол | 274,12 | жёлтые иглы | 140разл. | взрывается | легко растворим в воде | |
| 2,3,4,5,6-пентанитрофенол | 319,12 | 190разл. |
Химические свойства
[править | править код]- о- и п-Нитрофенолы являются таутомерами соответствующих α- и γ-кетонитроновых кислот:
- На таутомерное равновесие влияет кислотность среды, а таутомерные формы имеют разную окраску, что позволяет использовать их как кислотно-основные индикаторы. Параметры перехода приведены в таблице:
| Изомер | p H перехода | цвет |
|---|---|---|
| 2-нитрофенол | 5,0-7,0 | жёлтый |
| 3-нитрофенол | 7,8-8,6 | оранжевый |
| 4-нитрофенол | 5,6-7,6 | жёлтый |
| 2,4-динитрофенол | 2,0-4,7 | жёлтый |
| 2,5-динитрофенол | 4,0-5,8 | жёлтый |
| 2,6-динитрофенол | 1,7-4,4 | жёлтый |
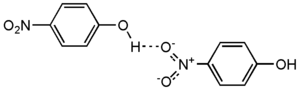
- Нитрофенолы сильно ассоциированы за счёт образования водородных связей между гидроксильными и нитрогруппами:
- Особняком стоит о -нитрофенол в котором образуется внутримолекулярная водородная связь:
- Это обусловливает более низкую температуру плавления о -нитрофенола.
- Введение нитрогруппы в фенол значительно увеличивает константу диссоциации, особенно при орто- и пара-заместителях:
| Изомер | p Кα |
|---|---|
| фенол | 9,89 |
| 2-нитрофенол | 7,23 |
| 3-нитрофенол | 8,35 |
| 4-нитрофенол | 7,15 |
| 2,3-динитрофенол | 4,89 |
| 2,4-динитрофенол | 4,08 |
| 2,5-динитрофенол | 5,15 |
| 2,6-динитрофенол | 4,15 |
| 3,4-динитрофенол | 5,37 |
| 3,5-динитрофенол | 6,68 |
| 2,4,6-тринитрофенол | 0,8 |
- Хоть кислотные свойства нитрофенолов усиливаются, но в щелочной среде, вследствие таутомерии, образуются не феноляты, а соли кетонитроновых кислот:
- Нитрофенолы восстанавливаются (например, железом в кислой среде) до соответствующих аминофенолов.
- Электрофильное замещение (сульфирование, бромирование, нитрование и т. п.) для 4-нитрофенола происходит по положению 2, а для 3-нитрофенола — по положениям 4 и 6.
Применение
[править | править код]- Мононитрофенолы — промежуточные продукты в синтезе аминофенолов и сернистых красителей, кислотно-основные индикаторы.
- 4-Нитрофенол — фунгицид, используемый, например, при обработке кож.
- 2,4-Динитрофенол применяют для получения 2,4-диаминофенола, 2-амино-4-нитрофенола и 2,4,6-тринитрофенола, в производстве сернистых красителей, антисептических средств для пропитки дерева (например, триолита, содержащего 80 % NaF, 15 % 2,4-динитрофенола и 5 % Na2Cr2O7).
- 2,4,6-Тринитрофенол (пикриновая кислота) длительное время использовался в качестве жёлтого красителя для шерсти, шелка, кожи, волос. С конца XIX века — взрывчатое вещество (ВВ) для снаряжения гранат, детонаторов, в сплавах с другими ВВ (главным образом динитронафталинами) — для снаряжения мин, авиабомб, разрывных дымообразующих снарядов.
Токсичность
[править | править код]- Мононитрофенолы поражают центральную нервную систему, печень, почки; ПДК 1 мг/м³.
- Динитрофенолы взрывоопасны, ядовиты, сильно раздражают кожу, слизистые оболочки, вызывают дерматиты; ПДК 0,02 — 0,05 мг/м³.
- Тринитрофенол раздражает кожу, вызывает отравления; ПДК 0,1 мг/м³ (США).
- Описаны подострые отравления нитрофенолами, в клинической картине которых выделяются астеновегетативная реакция, повышенная жажда, тахикардия, головные боли, отсутствие аппетита, диарея, желтушность склер, везикулярный дерматит с переходом в хроническую форму, при этом особенно ранимы подмышечные и паховые области.
Литература
[править | править код]- Нитрофенолы // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- Химическая энциклопедия / Редкол.: Кнунянц И. Л. и др. — М.: Советская энциклопедия, 1992. — Т. 3. — 639 с. — ISBN 5-82270-039-8.
- Справочник химика / Редкол.: Никольский Б. П. и др. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Несмеянов А. Н., Несмеянов Н. А. Начала органической химии. В 2-х томах. — М.: «Химия», 1970. — Т. 2. — 824 с.
- Общая органическая химия / Под ред. Бартон Д. — М.: «Химия», 1982. — Т. 3. — 738 с.
- Орлова Е. Ю. Химия и технология бризантных взрывчатых веществ. — Изд. второе, перер. и доп. — Л.: «Химия», 1972. — 688 с.