Карбонат бериллия (TgjQkugm Qyjnllnx)
| Карбонат бериллия | |
|---|---|
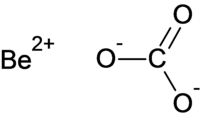 | |
| Общие | |
| Хим. формула | BeCO3 |
| Физические свойства | |
| Молярная масса | 69.0211 г/моль |
| Химические свойства | |
| Растворимость | |
| • в воде | 0,36 г/100 мл |
| Классификация | |
| Рег. номер CAS | 13106-47-3 |
| PubChem | 61577 |
| Рег. номер EINECS | 236-030-8 |
| SMILES | |
| InChI | |
| RTECS | DS2350000 |
| ChemSpider | 55490 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Карбонат бериллия — химическое соединение бериллия с химической формулой ВеСО3. Представляет собой бесцветное кристаллическое вещество (в порошке - белое).[1] Карбонат бериллия не имеет запаха, но, как все соединения бериллия, обладает сладковатым вкусом.[2]
Формы соединения
[править | править код]Карбонат бериллия существует в трех формах:
- средний карбонат (ВеСО3) — при нормальных условиях неустойчив, разлагается на ВеО и углекислый газ, поэтому требует хранения в атмосфере СО2.[2][3];
- тетрагидрат основного карбоната (ВеСО3•4Н2О) — при нормальных условиях сравнительно неустойчив, при нагревании разлагается.[1]
- основной карбонат ([BeОН]2CO3) — сравнительно устойчив на воздухе, при температуре выше 100°С быстро разлагается на ВеО, углекислый газ и воду.[1] В воде плохорастворим.
Известны также гидратированные основные карбонаты переменного состава (ВеСО3•nВе(OH)2•nН2O, где n = 2, 3, 4, 5, 7; m = 1, 2, 3), выделяющиеся в виде плотного осадка из кипящих растворов.[2]
Получение
[править | править код]- ВеСО3 получают взаимодействием оксида бериллия и углекислого газа (при повышенном давлении):[2]
- ВеСО3•4Н2О образуется при пропускании большого избытка СО2 через раствор Ве(ОН)2 (полученный осадок фильтруют и высушивают в атмосфере СО2):
- [BeОН]2CO3 может быть получен при взаимодействии растворимых солей бериллия (например, сульфата или хлорида бериллия) и карбонатов щелочных металлов или аммония:
Химические свойства
[править | править код]- Все формы карбоната бериллия растворяются в избытке карбонатов щелочных металлов и аммония с образованием растворимых комплексных соединений. Например, возможны реакции:
Эти реакции представляют большой интерес в связи с возможностью их использования в аналитической химии для отделения бериллия от алюминия и железа, гидроксиды которых малорастворимы в карбонате аммония и практически нерастворимы в карбонатах щелочных металлов.
- При температуре выше 100 °C карбонат бериллия разлагается:
Примечания
[править | править код]- ↑ 1 2 3 Рабинович В.А., Хавин З.Я. Краткий химический справочник. - Л.: Химия, 1977. - С.56
- ↑ 1 2 3 4 Химия и технология редких и рассеянных элементов: Учеб. пособие для вузов: Ч. I / Под ред. К. А. Большакова. - 2-е изд., перераб. и доп.- М.: Высшая школа, 1976. - С.176.
- ↑ Egon Wiberg, Arnold Frederick Holleman Inorganic Chemistry. - Elsevier, 2001. - ISBN 0-12-352651-5
Это заготовка статьи о неорганическом веществе. Помогите Википедии, дополнив её. |

![{\displaystyle {\mathsf {Be(OH)_{2}+CO_{2}+3H_{2}O\longrightarrow [BeCO_{3}\cdot 4H_{2}O]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2784ba3d585857265f7b2a8119ff9bf38b8f2b4a)
![{\displaystyle {\mathsf {2BeCl_{2}+2Na_{2}CO_{3}+H_{2}O\longrightarrow [BeOH]_{2}CO_{3}+4NaCl+CO_{2}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/43229728382fd72b0c35d38ac7c062c7d07c9c44)
![{\displaystyle {\mathsf {BeCO_{3}+(NH_{4})_{2}CO_{3}\longrightarrow (NH_{4})_{2}[Be(CO_{3})_{2}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f844fafdb64b5d42497d0ad4774bdedf9af5a296)
![{\displaystyle {\mathsf {[BeOH]_{2}CO_{3}+3Na_{2}CO_{3}\longrightarrow 2Na_{2}[Be(CO_{3})_{2}]+2NaOH}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f523e654878d84d962d65df07e40628ec777e07c)

![{\displaystyle {\mathsf {[BeOH]_{2}CO_{3}+2H_{2}SO_{4}\longrightarrow 2BeSO_{4}+3H_{2}O+CO_{2}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/299d0d7c31780a056d09386c6ad96a7c67877b4c)

![{\displaystyle {\mathsf {[BeOH]_{2}CO_{3}\longrightarrow 2BeO+H_{2}O+CO_{2}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a2d921d7dd423917527710e0a1079a5397f0556f)