Жгутик ("irmnt)

Жгу́тик (англ. Flagellum) — поверхностная структура, присутствующая у многих прокариотических (бактерий и архей) и эукариотических клеток и служащая для их движения в жидкой среде или по поверхности твёрдых сред.
Жгутики прокариот и эукариот принципиально различаются и по структуре, и по источнику энергии для движения и по механизму движения. Жгутики могут присутствовать на клетках по одному или во множестве, они имеются у многих протистов, зооспор и гамет. Эукариотический жгутик представляет собой вырост клетки, окружённый мембраной, с элементами цитоскелета внутри, который осуществляет биения за счёт энергии гидролиза АТФ. Бактериальный жгутик, как и жгутик архей, вмонтирован в оболочку клетки и вращается за счёт энергии трансмембранного градиента протонов или ионов натрия.
Помимо плавания, жгутики играют важную роль и в других процессах в жизни бактерий. Они участвуют в образовании биоплёнок, обеспечивают контакт клеток с субстратом, облегчают колонизацию хозяина симбиотическими бактериями[англ.], служат одним из факторов вирулентности, запускают иммунный ответ организма хозяина.
Жгутики эукариот
[править | править код]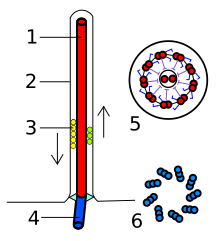
1 — аксонема
2 — цитоплазматическая мембрана
3 — транспорт веществ внутри жгутика
4 — базальное тело
5 — срез жгутика в ундулиподии
6 — срез жгутика в кинетосоме

Жгутик эукариот представляет собой тонкий вырост на поверхности клетки, покрытый клеточной мембраной и содержащий аксонему — сложный структурный элемент, представляющий собой систему микротрубочек. Жгутиками снабжены гаметы у многих организмов, зооспоры и клетки многих протистов. Жгутик осуществляет волнообразные или воронкообразные движения, совершая 10—40 оборотов в секунду. Энергия для движения эукариотического жгутика добывается при гидролизе АТФ. Внешнюю, внеклеточную часть жгутика называют ундулиподией[1].
Ундулиподия обычно имеет одинаковую толщину по всей длине, которая составляет от 200 до 250 нм. Почти у всех свободноживущих протистов ундулиподии несут чешуйки или мастигонемы (нитевидные структуры, отходящие от поверхности жгутика)[2]. Структурная основа ундулиподии представлена аксонемой, которая состоит из 9 пар периферических микротрубочек (дублетов) и двух центральных микротрубочек. Эта формула (9 × 2 + 2) характерна для всех эукариот, хотя известны и исключения (чаще всего редуцируется центральная пара микротрубочек, но иногда в аксонеме появляются дополнительные микротрубочки). Компоненты аксонемы имеют сложный состав и образованы более чем 250 белками. Две центральные микротрубочки имеют диаметр 25 нм и располагаются на расстоянии 30 нм друг от друга[1], они одеты общим чехлом из тонкого материала. При помощи радиальных спиц чехол соединяется с периферическими дублетами микротрубочек. Каждый дуплет образован микротрубочками A и B, причём радиальные спицы крепятся к A-микротрубочкам. От A-микротрубочек также отходят динеиновые ручки и нексиновые[англ.] мостики. Динеиновые ручки направлены к соседнему дублету и обусловливают изгибание аксонемы, обеспечивая скольжение дублетов относительно друг друга. Нексиновые мостики нужны для прочной связки соседних дублетов в переходной зоне аксонемы, которая не подвергается изгибаниям. Иногда жгутики эукариот несут дополнительные структурные элементы, например, параксиальный тяж, имеющийся у некоторых протистов (динофлагеллят, эвгленовых и других). Параксиальный тяж состоит из микрофиламентов и идёт вдоль аксонемы[3].
На уровне выхода жгутика из клетки находится так называемая переходная зона аксонемы. Аксонема крепится к кинетосоме, или базальному телу, располагающемуся под клеточной мембраной. Кинетосома представляет собой полый цилиндр, стенка которого состоит из 9 триплетов микротрубочек, соединённых, как правило, фибриллярными мостиками. В состав триплета, помимо аксонемных A- и B-микротрубочек, входит дополнительная C-микротрубочка, прилегающая к B-микротрубочке. В центре проксимальной части кинетосомы находится ось со спицами, которая также имеется у центриолей[4].
От кинетосом непосредственно отходят так называемые корешки — фибриллярные или микротрубочковые структуры. Иногда они соединяются с кинетосомами короткими фибриллярными связками или начинаются в слое аморфного материала, окружающего кинетосому. Корешки обоих типов служат для закрепления жгутика в теле клетки[5].
Как правило, эукариотические клетки несут от 1 до 8 жгутиков, хотя среди протистов известно немало многожгутиковых форм. Жгутиконосных протистов подразделяют на четыре основные группы: изоконты несут одинаковые жгутики с одинаковым способом биения; анизоконты обладают жгутиками разной длины, но они также имеют одинаковый вид и способ биения; у гетероконтов имеется два разных по внешнему виду и расположению жгутика с разными способами биения; наконец, стефаноконтные формы имеют венчик из 30—40 жгутиков на переднем конце клетки[6].
Жгутики бактерий
[править | править код]
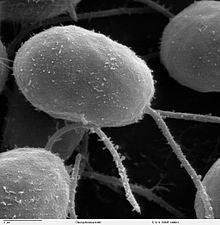
Жгутиками обладают до 80 % известных видов бактерий[7]. Количество и расположение жгутиков различно у разных видов. У некоторых бактерий есть всего один жгутик (монотрихи), у других два жгутика располагаются на двух противоположных концах клетки (амфитрихи), у третьих на полюсах клетки находятся пучки жгутиков (лофотрихи), а у четвёртых жгутики покрывают всю поверхность клетки (перитрихи). У спирохет жгутик находится в периплазматическом пространстве между двумя мембранами. Клетки спирохет имеют характерную извитую форму, которая меняется при движении[8].

Строение жгутика бактерий фундаментально отличается от строения жгутика эукариот. Если эукариотический жгутик представляет собой вырост клетки, окружённый мембраной, с элементами цитоскелета внутри, который движется за счёт энергии гидролиза АТФ, то бактериальный жгутик (как и жгутик архей) вмонтирован в оболочку клетки и вращается за счёт энергии трансмембранного градиента протонов или ионов натрия. Кроме того, в отличие от эукариотических жгутиков, основной тип движения которых — биение, жгутики бактерий вращаются[9]. Жгутики бактерий и архей состоят из двух независимых частей — ротора и статора[10].
Жгутик вращается попеременно по часовой стрелке и против неё. Частота вращения постоянна для конкретной клетки и составляет от 250 до 1700 Гц (то есть от 1,5⋅104 до 105 оборотов в минуту)[10].
Строение жгутика лучше всего изучено у кишечной палочки Escherichia coli и Salmonella enterica серотип Typhimurium. Гены, ответственные за движение у этих бактерий, подразделяют на три группы:
- fla-гены (от англ. flagellum) кодируют субъединицы жгутика и компоненты, необходимые для его биогенеза. В эту группу входит около 50 генов;
- mot-гены (от англ. motility — подвижность) отвечают за вращение мотора жгутика;
- che-гены (от англ. chemotaxis — хемотаксис) обеспечивают плавание как адаптивную реакцию[11].

К числу основных структурных компонентов бактериального жгутика относят:
- филамент (нить) — жёсткая нитевидная структура длиной до 15 мкм и диаметром около 20 нм, располагающаяся за пределами цитоплазматического компартмента;
- базальное тело — опорная структура, которая у грамотрицательных бактерий представлена муреиновым чехлом совместно с внешней мембраной, а у грамположительных она представлена только муреиновым чехлом. В состав базального тела входит система секреции III типа, которая служит для экспорта из клетки субъединиц жгутика, а также мотор жгутика.
- крюк длиной около 55 нм и диаметром около 30 нм, который представляет собой гибкое сочленение между филаментом и базальным телом[12].
Рабочей частью жгутика является филамент, или нить. Филамент представляет собой спирализованный цилиндр со внутренним каналом диаметром около 3 нм. Филамент состоит из около 20 тысяч идентичных субъединиц белка флагеллина (FliC). У некоторых бактерий, например, Helicobacter pylori, Caulobacter crescentus[англ.], Sinorhizobium meliloti[англ.] и Campylobacter coli[англ.] в состав филамента входят флагеллиновые субъединицы двух типов. У ряда бактерий флагеллиновые субъединицы гликозилированы. Флагеллиновые субъединицы в составе филамента уложены спирально, на один оборот спирали приходится 11 субъединиц, поэтому они образуют 11 параллельных протофиламентов, проходящих под небольшим углом к оси филамента. Форма филамента определяется аминокислотной последовательностью входящих в его состав флагеллинов, ионной силой и pH раствора, в котором перемещается клетка. Когда мотор вращается против часовой стрелки, филамент принимает форму левозакрученной спирали, а когда по часовой — правозакрученной. На дистальном конце филамента находится шапочка (кэп), который имеет форму диска и состоит из пяти субъединиц белка FliD. Через канал филамента и пять «окошек» в шапочке субъединицы флагеллина выходят наружу, причём шапочка обеспечивает их сворачивание[13].
Филамент соединяется с базальным телом посредством крюка, который образован субъединицами FlgE, вспомогательными белками FlgKL и кэпирующим белком FlgD, который удаляется при завершении сборки крюка. Крюк играет роль гибкого сочленения, благодаря которому жёсткая нить может менять своё положение по отношению к поверхности клетки[14].
Базальное тело встроено в клеточную стенку и у грамотрицательных бактерий состоит из следующих частей:
- оси (белки FlgBCFG и FliE), которая дистальной частью связана с крюком и нитью, а проксимальной частью — с MS-кольцом;
- L-кольца (белки FlgH), которое вставлено во внешнюю мембрану и функционирует как поддерживающая втулка для вращающейся оси;
- P-кольца (белки FlgI), интегрированного в муреиновый чехол и выполняющего роль поддерживающей втулки для оси;
- MS-кольца (26 субъединиц FliF), к которому причленяются проксимальные субъединицы оси (FliE), субъединицы ротора (FliG), переключатель направления вращения (состоит из 37 субъединиц FliM и 110 субъединиц FliN);
- ротора (44 субъединицы FliG), который залегает в основании MS-кольца;
- C-кольца (белки FliMN), связанного с ротором и задействованного в смене направления движения[15].
Так как биосинтез субъединиц жгутика требует много клеточных ресурсов, он регулируется специальным каскадом, в который у E. coli и Salmonella enterica серовар Typhimurium входят три класса генов. Аппарат для экспорта субъединиц жгутика состоит из субъединиц FlhAB, FliOPQR и FliHIJ, выступает в цитоплазму, проходит через центральное отверстие ротора и частично погружён в MS-кольцо[16].
Характер плавания бактериальной клетки зависит от количества и расположения жгутиков. У монотрихов, например, Pseudomonas aeruginosa, жгутик, вращающийся по часовой стрелке, толкает клетку вперёд, а против — тянет её за собой. У некоторых бактерий жгутик вращается только по часовой стрелке. У бактерий со множеством жгутиков (политрихов) при плавании жгутики сплетаются в жгут, вращающийся против часовой стрелки. При вращении по часовой стрелке жгут расплетается, и из-за независимого вращения отдельных жгутиков клетка начинает «кувыркаться» и непредсказуемо меняет направление движения[17].
Помимо плавания, жгутики играют важную роль и в других процессах в жизни бактерий. Они участвуют в образовании биоплёнок, обеспечивают контакт клеток с субстратом, облегчают колонизацию хозяина симбиотическими бактериями[англ.], а для патогенных бактерий жгутики служат одним из факторов вирулентности, так как облегчают проникновение в тело хозяина, перемещение в вязкой межклеточной среде, проникновение в щели между клетками эндотелия. Жгутики бактерий высоко иммуногенны и запускают иммунный ответ организма хозяина, поэтому компоненты жгутика используют для пассивной иммунизации[18].
У некоторых бактерий рода Vibrio (в частности, Vibrio parahaemolyticus[англ.][19]) и некоторых протеобактерий, таких как Aeromonas, имеются две различные жгутиковые системы, белковые компоненты которых кодируются различными наборами генов, а для вращения используются разные ионные градиенты. Полярные жгутики, относящиеся к первой жгутиковой системе, присутствуют постоянно и обеспечивают подвижность в потоке жидкости, а боковые жгутики, относящиеся ко второй жгутиковой системе, экспрессируются только тогда, когда сопротивление окружающей жидкости так велико, что полярные жгутики не могут вращаться. Благодаря этому бактерии могут скользить по различным поверхностям и в вязкой жидкости[20][21][22][23][24][25].
Жгутики архей
[править | править код]
Жгутик архей (археллум) служит, как и у других организмов, преимущественно для перемещения в жидкой среде. Структурно археллум схож с пилями IV типа[27]. Большинство генов, белковые продукты которых образуют археллум, образуют единый оперон fla. Этот оперон содержит от 7 до 13 генов, продукты которых участвуют в сборке и работе археллума[28]. Структурные компоненты археллума называют археллинами, эти белки кодируются генами flaA и flaB; моторные компоненты кодируются генами flaI, flaJ и flaH. В этом опероне также закодированы вспомогательные белки FlaG, FlaF и FlaX, а также сигнальные белки FlaC, FlaD и FlaE. Генетический анализ различных видов архей показал, что все перечисленные белки необходимы для сборки археллума[29][30][31][32][33]. У эвриархеот имеется почти полный набор генов fla, а у представителей типа кренархеот один или два из них могут отсутствовать. Для созревания археллинов необходима пептидаза препилин[англ.] (у эвриархеот она известна как PibD, у кренархеот — FlaK), однако она не входит в состав fla-оперона[34].
Хотя археллум во многих отношениях значительно отличается от жгутика бактерий, основная его функция та же — перемещение клетки в жидкой среде[33][35][36] или на влажных поверхностях[37][38]. Подобно бактериальному жгутику[39][40], археллум участвует в прикреплении клеток к субстрату и межклеточной коммуникации[41][42], однако, в отличие от жгутиков бактерий, не задействован в образовании биоплёнок[43].
Примечания
[править | править код]- ↑ 1 2 Ченцов Ю. С. Введение в клеточную биологию: Учебник для вузов. — 4-е изд., перераб. и доп.. — ИКЦ "Академкнига", 2004. — С. 418. — 495 с. — ISBN 5-94628-105-4.
- ↑ Карпов, 2001, с. 148—149.
- ↑ Карпов, 2001, с. 157—159.
- ↑ Карпов, 2001, с. 159—160.
- ↑ Карпов, 2001, с. 162—163.
- ↑ Карпов, 2001, с. 146—147.
- ↑ Пиневич, 2006, с. 325.
- ↑ Bardy S. L., Ng S. Y., Jarrell K. F. Prokaryotic motility structures. (англ.) // Microbiology (Reading, England). — 2003. — February (vol. 149, no. Pt 2). — P. 295—304. — doi:10.1099/mic.0.25948-0. — PMID 12624192.
- ↑ Streif S., Staudinger W. F., Marwan W., Oesterhelt D. Flagellar rotation in the archaeon Halobacterium salinarum depends on ATP. (англ.) // Journal Of Molecular Biology. — 2008. — 5 December (vol. 384, no. 1). — P. 1—8. — doi:10.1016/j.jmb.2008.08.057. — PMID 18786541.
- ↑ 1 2 Пиневич, 2006, с. 326.
- ↑ Пиневич, 2006, с. 326—327.
- ↑ Пиневич, 2006, с. 327.
- ↑ Пиневич, 2006, с. 328—329.
- ↑ Пиневич, 2006, с. 329.
- ↑ Пиневич, 2006, с. 329—330.
- ↑ Пиневич, 2006, с. 330—331.
- ↑ Пиневич, 2006, с. 332.
- ↑ Пиневич, 2006, с. 325—326, 333.
- ↑ Kim Y. K., McCarter L. L. Analysis of the polar flagellar gene system of Vibrio parahaemolyticus. (англ.) // Journal Of Bacteriology. — 2000. — July (vol. 182, no. 13). — P. 3693—3704. — PMID 10850984.
- ↑ Atsumi T., Maekawa Y., Yamada T., Kawagishi I., Imae Y., Homma M. Effect of viscosity on swimming by the lateral and polar flagella of Vibrio alginolyticus. (англ.) // Journal Of Bacteriology. — 1996. — August (vol. 178, no. 16). — P. 5024—5026. — PMID 8759871.
- ↑ McCarter L. L. Dual flagellar systems enable motility under different circumstances. (англ.) // Journal Of Molecular Microbiology And Biotechnology. — 2004. — Vol. 7, no. 1-2. — P. 18—29. — doi:10.1159/000077866. — PMID 15170400.
- ↑ Merino S., Shaw J. G., Tomás J. M. Bacterial lateral flagella: an inducible flagella system. (англ.) // FEMS Microbiology Letters. — 2006. — October (vol. 263, no. 2). — P. 127—135. — doi:10.1111/j.1574-6968.2006.00403.x. — PMID 16978346.
- ↑ Belas R., Simon M., Silverman M. Regulation of lateral flagella gene transcription in Vibrio parahaemolyticus. (англ.) // Journal Of Bacteriology. — 1986. — July (vol. 167, no. 1). — P. 210—218. — PMID 3013835.
- ↑ Canals R., Altarriba M., Vilches S., Horsburgh G., Shaw J. G., Tomás J. M., Merino S. Analysis of the lateral flagellar gene system of Aeromonas hydrophila AH-3. (англ.) // Journal Of Bacteriology. — 2006. — February (vol. 188, no. 3). — P. 852—862. — doi:10.1128/JB.188.3.852-862.2006. — PMID 16428388.
- ↑ Canals R., Ramirez S., Vilches S., Horsburgh G., Shaw J. G., Tomás J. M., Merino S. Polar flagellum biogenesis in Aeromonas hydrophila. (англ.) // Journal Of Bacteriology. — 2006. — January (vol. 188, no. 2). — P. 542—555. — doi:10.1128/JB.188.2.542-555.2006. — PMID 16385045.
- ↑ Albers S. V., Jarrell K. F. The Archaellum: An Update on the Unique Archaeal Motility Structure. (англ.) // Trends In Microbiology. — 2018. — April (vol. 26, no. 4). — P. 351—362. — doi:10.1016/j.tim.2018.01.004. — PMID 29452953.
- ↑ Albers Sonja-Verena, Jarrell Ken F. The archaellum: how archaea swim (англ.) // Frontiers in Microbiology. — 2015. — 27 January (vol. 6). — ISSN 1664-302X. — doi:10.3389/fmicb.2015.00023.
- ↑ Ghosh A., Albers S. V. Assembly and function of the archaeal flagellum. (англ.) // Biochemical Society Transactions. — 2011. — January (vol. 39, no. 1). — P. 64—69. — doi:10.1042/BST0390064. — PMID 21265748.
- ↑ Patenge N., Berendes A., Engelhardt H., Schuster S. C., Oesterhelt D. The fla gene cluster is involved in the biogenesis of flagella in Halobacterium salinarum. (англ.) // Molecular Microbiology. — 2001. — August (vol. 41, no. 3). — P. 653—663. — PMID 11532133.
- ↑ Thomas N. A., Bardy S. L., Jarrell K. F. The archaeal flagellum: a different kind of prokaryotic motility structure. (англ.) // FEMS Microbiology Reviews. — 2001. — April (vol. 25, no. 2). — P. 147—174. — doi:10.1111/j.1574-6976.2001.tb00575.x. — PMID 11250034.
- ↑ Thomas N. A., Mueller S., Klein A., Jarrell K. F. Mutants in flaI and flaJ of the archaeon Methanococcus voltae are deficient in flagellum assembly. (англ.) // Molecular Microbiology. — 2002. — November (vol. 46, no. 3). — P. 879—887. — PMID 12410843.
- ↑ Chaban B., Ng S. Y., Kanbe M., Saltzman I., Nimmo G., Aizawa S., Jarrell K. F. Systematic deletion analyses of the fla genes in the flagella operon identify several genes essential for proper assembly and function of flagella in the archaeon, Methanococcus maripaludis. (англ.) // Molecular Microbiology. — 2007. — November (vol. 66, no. 3). — P. 596—609. — doi:10.1111/j.1365-2958.2007.05913.x. — PMID 17887963.
- ↑ 1 2 Lassak K., Neiner T., Ghosh A., Klingl A., Wirth R., Albers S. V. Molecular analysis of the crenarchaeal flagellum. (англ.) // Molecular Microbiology. — 2012. — January (vol. 83, no. 1). — P. 110—124. — doi:10.1111/j.1365-2958.2011.07916.x. — PMID 22081969.
- ↑ Bardy S. L., Jarrell K. F. Cleavage of preflagellins by an aspartic acid signal peptidase is essential for flagellation in the archaeon Methanococcus voltae. (англ.) // Molecular Microbiology. — 2003. — November (vol. 50, no. 4). — P. 1339—1347. — PMID 14622420.
- ↑ Alam M., Claviez M., Oesterhelt D., Kessel M. Flagella and motility behaviour of square bacteria. (англ.) // The EMBO Journal. — 1984. — 1 December (vol. 3, no. 12). — P. 2899—2903. — PMID 6526006.
- ↑ Herzog B., Wirth R. Swimming behavior of selected species of Archaea. (англ.) // Applied And Environmental Microbiology. — 2012. — March (vol. 78, no. 6). — P. 1670—1674. — doi:10.1128/AEM.06723-11. — PMID 22247169.
- ↑ Szabó Z., Sani M., Groeneveld M., Zolghadr B., Schelert J., Albers S. V., Blum P., Boekema E. J., Driessen A. J. Flagellar motility and structure in the hyperthermoacidophilic archaeon Sulfolobus solfataricus. (англ.) // Journal Of Bacteriology. — 2007. — June (vol. 189, no. 11). — P. 4305—4309. — doi:10.1128/JB.00042-07. — PMID 17416662.
- ↑ Jarrell K. F., Bayley D. P., Florian V., Klein A. Isolation and characterization of insertional mutations in flagellin genes in the archaeon Methanococcus voltae. (англ.) // Molecular Microbiology. — 1996. — May (vol. 20, no. 3). — P. 657—666. — PMID 8736544.
- ↑ Henrichsen J. Bacterial surface translocation: a survey and a classification. (англ.) // Bacteriological Reviews. — 1972. — December (vol. 36, no. 4). — P. 478—503. — PMID 4631369.
- ↑ Jarrell K. F., McBride M. J. The surprisingly diverse ways that prokaryotes move. (англ.) // Nature Reviews. Microbiology. — 2008. — June (vol. 6, no. 6). — P. 466—476. — doi:10.1038/nrmicro1900. — PMID 18461074.
- ↑ Näther D. J., Rachel R., Wanner G., Wirth R. Flagella of Pyrococcus furiosus: multifunctional organelles, made for swimming, adhesion to various surfaces, and cell-cell contacts. (англ.) // Journal Of Bacteriology. — 2006. — October (vol. 188, no. 19). — P. 6915—6923. — doi:10.1128/JB.00527-06. — PMID 16980494.
- ↑ Zolghadr B., Klingl A., Koerdt A., Driessen A. J., Rachel R., Albers S. V. Appendage-mediated surface adherence of Sulfolobus solfataricus. (англ.) // Journal Of Bacteriology. — 2010. — January (vol. 192, no. 1). — P. 104—110. — doi:10.1128/JB.01061-09. — PMID 19854908.
- ↑ Koerdt A., Gödeke J., Berger J., Thormann K. M., Albers S. V. Crenarchaeal biofilm formation under extreme conditions. (англ.) // PloS One. — 2010. — 24 November (vol. 5, no. 11). — P. e14104—14104. — doi:10.1371/journal.pone.0014104. — PMID 21124788.
Литература
[править | править код]- Пиневич А. В. Микробиология. Биология прокариотов: в 3 т. — СПб.: Издательство С.-Петербургского университета, 2006. — Т. 1. — 352 с. — ISBN 5-288-04057-5.
- Карпов С. А. Строение клетки протистов. — СПб.: ТЕССА, 2001. — 384 с. — ISBN 5-94086-010-9.
Эта статья входит в число хороших статей русскоязычного раздела Википедии. |