Эндомембранная система (|u;kbybQjguugx vnvmybg)

Эндомембра́нная систе́ма — система разнообразных мембран, располагающихся в цитоплазме эукариотической клетки (исключая мембраны митохондрий, пероксисом и хлоропластов). Эти мембраны делят клетку на функциональные компартменты, или органеллы. К компонентам эндомембранной системы относят ядерную оболочку, эндоплазматический ретикулум, аппарат Гольджи, лизосомы, везикулы, вакуоли и клеточную мембрану. Мембраны эндомембранной системы составляют единую функциональную единицу и либо непосредственно соединяются друг с другом, либо обмениваются материалом посредством везикулярного транспорта[1]. В эндомембранную систему не входят мембраны митохондрий, пероксисом и хлоропластов, хотя, возможно, она произошла от митохондриальных мембран.
Ядерная оболочка состоит из двух липидных бислоёв, в которые заключён весь ядерный материал[2]. Эндоплазматический ретикулум — органелла транспорта и синтеза, которая разветвляется в цитоплазме животных и растительных клеток[3]. Аппарат Гольджи состоит из набора множества компартментов, в которых молекулы упаковываются для доставки в другие части клетки или секреции[4]. Вакуоли имеются и в растительных, и в животных клетках (хотя в растительных клетках они крупнее), и поддерживают форму и структуру клетки, а также накапливают запасные вещества и продукты обмена[5]. Лизосомы разрушают проникнувшие в клетку вещества и старые органеллы. Везикулы — относительно небольшие мембраносвязанные пузырьки, в которых вещества накапливаются или транспортируются. Клеточная мембрана играет роль защитного барьера, который регулирует транспорт веществ из клетки и внутрь неё[6]. У грибов есть особая мембранная органелла — апикальное тельце, или Spitzenkörper, которая участвует в росте концов гиф[7].
У прокариот внутренние мембраны редки, хотя у многих фотосинтезирующих бактерий плазматическая мембрана образует множество складок, и нередко большая часть клетки заполнена светособирающими мембранами[8]. Светособирающие структуры могут быть даже замкнуты в органеллы, например, хлоросомы зелёных серных бактерий[9].
Органеллы эндомембранной системы связаны друг с другом или непосредственным контактом, или через перенос мембранных пузырьков — везикул. Несмотря на эту общность, различные мембраны отличаются по структуре и функциям. Толщина, молекулярный состав и метаболическое поведение мембраны не фиксированы, и они могут изменяться несколько раз в течение жизни мембраны. Единственной общей характеристикой мембран является наличие липидного бислоя, который пронизан белками насквозь или белки прикрепляются к одной из его сторон[10].
История изучения
[править | править код]Первое предположение о том, что мембраны внутри клетки формируют единую систему, компоненты которой обмениваются веществами друг с другом, было сформулировано Morré и Mollenhauer в 1974 году[11]. Оно было выдвинуто для объяснения того, как внутри клетки собираются различные липидные мембраны, причём мембраны собираются из липидов в ходе липидного тока (англ. lipid flow) из мест биосинтеза липидов[12]. Идея липидного тока через непрерывную систему мембран и везикул отлична от предположения о том, что различные мембраны представляют собой несвязанные сущности, которые формируются благодаря транспорту свободных компонентов липидов, таких как свободные жирные кислоты и стеролы, через цитозоль. Транспорт липидов по цитозолю и липидный ток через непрерывную эндомембранную систему не являются взаимноисключающими и могут оба иметь место в клетках[13].
Компоненты системы
[править | править код]Ядерная оболочка
[править | править код]
Ядерная оболочка окружает ядро и отделяет его от цитоплазмы. Она включает две мембраны, каждая из которых представлена липидным бислоем с ассоциированными белками[14]. Наружная мембрана продолжается в шероховатый эндоплазматический ретикулум (ЭПР) и, как и он, несёт рибосомы, прикреплённые к поверхности. Наружная ядерная мембрана, кроме того, продолжается во внутреннюю ядерную мембрану в области многочисленных маленьких отверстий, называемых ядерными порами, которые пронзают ядерную оболочку. Эти поры достигают 120 нм в диаметре и регулируют транспорт молекул между ядром и цитоплазмой, позволяя некоторым проходить сквозь оболочку, а другим — нет[15]. Ядерные поры играют существенную роль в метаболизме клеток, поскольку располагаются в области очень активного транспорта веществ. Пространство между наружной и внутренней ядерной мембраной называется околоядерным, или перинуклеарным пространством и соединено с внутренним пространством (люменом) ЭПР.
Форма ядерной оболочки определяется сетью промежуточных филаментов, похожей на арматуру, которая называется ядерная ламина. Она связывается с хроматином, интегральными мембранными белками и другими компонентами ядра, располагающимися вблизи внутренней ядерной мембраны. Считается, что ядерная ламина помогает веществам внутри ядра достичь ядерных пор, а также участвует в разборке ядерной оболочки при митозе и её сборке в конце митоза[2].
Ядерные поры чрезвычайно эффективно осуществляют селективный транспорт веществ внутрь и из ядра. Из ядра в цитоплазму постоянно перемещаются РНК и рибосомные субъединицы. Гистоны, белки, регулирующие экспрессию генов, ДНК- и РНК-полимеразы и другие молекулы, необходимые для функционирования ядра, импортируются в ядро из цитоплазмы. Ядерная оболочка типичной клетки млекопитающего содержит от 3000 до 4000 ядерных пор. Когда клетка синтезирует ДНК, ей нужно транспортировать в ядро через каждый ядерный поровый комплекс около 100 молекул гистонов каждую минуту. Если клетка быстро растёт, то каждая ядерная пора должна переносить около 6 свежесобранных больших и малых субъединиц рибосом в минуту из ядра в цитозоль, где они используются для синтеза белков[16].
Эндоплазматический ретикулум
[править | править код]
Эндоплазматический ретикулум (ЭПР) — мембранная органелла синтеза и транспорта, которая является продолжением наружной ядерной мембраны. Более чем половина мембран эукариотической клетки приходится на ЭПР. ЭПР состоит из уплощённых мешочков и ветвящихся трубочек, которые, как считают, связаны друг с другом, так что мембрана ЭПР представляет собой непрерывный замкнутый слой, заключающий сильно разветвлённое внутреннее пространство (люмен). На люмен приходится около десяти процентов объёма клетки. Мембрана ЭПР позволяет протекать эффективному селективному транспорту веществ между люменом и цитоплазмой и, поскольку она соединена с наружной ядерной мембраной, она формирует канал между ядром и цитоплазмой[17].
ЭПР играет ключевую роль в образовании, модификации и транспорте биохимических соединений для внутреннего и внешнего использования клеткой. Его мембрана служит местом образования всех трансмембранных белков и почти всех липидов для клеточных органелл, в том числе и для самого себя, а также для аппарата Гольджи, лизосом, эндосом, митохондрий, пероксисом, секреторных везикул и плазматической мембраны. Более того, бо́льшая часть белков, выделяемых клеткой наружу, а также белки, предназначенные для люмена ЭПР, аппарата Гольджи и лизосом, первоначально проходят через люмен ЭПР. Поэтому многие белки, обнаруживаемые в люмене ЭПР, находятся там только временно и впоследствии доставляются в другие места. Некоторые белки постоянно находятся в люмене и называются резидентными белками ЭПР. Эти особые белки содержат специальный сигнал удержания, представляющей собой особую последовательность аминокислот, которая заставляет органеллу удерживать их внутри. Примером резидентных белков ЭПР может служить белковый шаперон, известный как BiP[англ.], который определяет другие белки, неправильно уложенные или процессированные, и препятствует их доставке к конечным пунктам назначения[18].
Существует два различных, хотя и соединённых друг с другом, отдела ЭПР, имеющих разные структуру и функции: гладкий (агранулярный) ЭПР и шероховатый (гранулярный) ЭПР. Шероховатый эндоплазматический ретикулум получил своё название за то, что его обращённая к цитоплазме сторона покрыта рибосомами, которые придают ему шероховатый облик при рассматривании под электронным микроскопом. Гладкий ЭПР же выглядит гладким, так как он не несёт рибосом[19].
Гладкий эндоплазматический ретикулум
[править | править код]В подавляющем большинстве клеток участки гладкого ЭПР малочисленны и часто частично являются гладкими, а частично шероховатыми. Их иногда называют переходным ЭПР, потому что в них находятся места выхода из ЭПР, от которых отпочковываются везикулы, несущие новосинтезированные белки и липиды к аппарату Гольджи. В некоторых специализированных клетках, впрочем, гладкий ЭПР обилен и имеет некоторые специфические функции. В этих клетках гладкий ЭПР может служить местом синтеза липидов, некоторых этапов метаболизма углеводов, детоксикации лекарств и ядов[17][19].
Ферменты гладкого ЭПР необходимы для синтеза липидов, в том числе масел, фосфолипидов и стероидов. Половые гормоны позвоночных и стероидные гормоны, секретируемые надпочечниками, входят в число стероидов, синтезируемых гладким ЭПР животных клеток. В клетках, синтезирующих эти гормоны, очень хорошо развит гладкий ЭПР[17][19].
Клетки печени являются другим примером клеток, у которых хорошо развит гладкий ЭПР. В этих клетках можно наблюдать участие гладкого ЭПР в метаболизме углеводов. Клетки печени запасают углеводы в форме гликогена. Распад гликогена приводит к высвобождению из клеток печени глюкозы, которая важна для регуляции уровня сахара в крови. Однако первичным продуктом распада гликогена является глюкозо-1-фосфат. Он превращается в глюкозо-6-фосфат, а далее фермент, локализованный в гладком ЭПР клеток печени, удаляет фосфат от глюкозы, после чего она может выйти из клетки[17][19].
Ферменты гладкого ЭПР также могут служить для детоксикации лекарств и ядов. Детоксикация, как правило, включает добавление гидроксильной группы к препарату, что делает его более растворимым и способным выйти из организма. Одна хорошо изученная реакция осуществляется цитохромом P450[17][19].
В мышечных клетках гладкий ЭПР также выполняет особые функции. Белки, локализованные в мембране ЭПР, накачивают ионы кальция из цитозоля в люмен. Когда мышечная клетка стимулируется нервным импульсом, кальций возвращается в цитозоль через мембрану ЭПР и вызывает сокращение[17][19].
Шероховатый эндоплазматический ретикулум
[править | править код]Клетки многих типов образуют белки, которые синтезируются рибосомами, прикреплёнными к шероховатому ЭПР. Рибосомы собирают белки из аминокислот, и белки проникают в ЭПР для дальнейшей модификации. Такие белки могут быть трансмембранными белками, которые пронизывают мембрану ЭПР, или водорастворимыми белками, которые проходят из мембраны в люмен. Белки, проникающие внутрь ЭПР, укладываются в правильную трёхмерную структуру. К ним присоединяются углеводные остатки, и далее готовые белки либо транспортируются дальше из ЭПР (секретируемые белки) в те участки клетки, где они нужны, либо отправляются в аппарат Гольджи, где подвергаются дальнейшей модификации[17][19].
Как только секретируемый белок образовался, он оказывается отделённым мембраной ЭПР от цитозольных белков. Секретируемые белки отделяются от ЭПР, упакованные в везикулы, которые отпочковываются, как пузырьки, от мембраны ЭПР. Везикулы, которые доставляют свой груз к другим частям клетки, называются транспортными везикулами[17][19]. Другой механизм для транспорта белков и липидов из ЭПР в прочие органеллы заключается в их переносе через особые транспортные мембранные белки, расположенные в сайте контакта мембран, где ЭПР близко и стабильно связан с другими органеллами, такими как плазматическая мембрана, аппарат Гольджи или лизосомы[20].
Кроме образования секретируемых белков, шероховатый ЭПР принимает участие в росте мембраны за счёт добавления белков и фосфолипидов. Когда мембранный белок синтезируется рибосомой, сидящей на ЭПР, он сам вставляется в мембрану ЭПР и остаётся заякоренным в мембране своим гидрофобным участком. Шероховатый ЭПР также образует свои собственные мембранные фосфолипиды; ферменты, встроенные в мембрану ЭПР, участвуют в их синтезе. Мембрана ЭПР увеличивается в размерах, и её фрагменты могут быть перенесены транспортными везикулами в другие компоненты эндомембранной системы[17][19].
Аппарат Гольджи
[править | править код]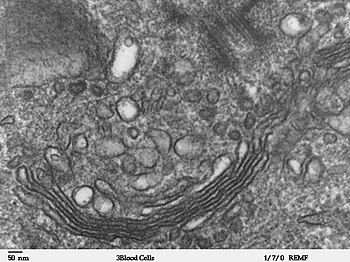
Аппарат Гольджи состоит из соединённых между собой мешочков, называемых цистернами. По виду он напоминает стопку оладий. Количество цистерн варьирует в зависимости от специфических функций клетки. Аппарат Гольджи служит для дальнейшей модификации белков клетки, доставленных в него из ЭПР. Часть аппарата Гольджи, которая получает мешочки с белками от ЭПР, называется цис-Гольджи и обычно располагается вблизи ЭПР, а противоположная его сторона называется транс-Гольджи, от неё мешочки с модифицированными белками отделяются для дальнейшего транспорта. Транс-Гольджи, как правило, находится рядом с плазматической мембраной, потому что бо́льшая часть молекул, отщепляющихся от аппарата Гольджи, предназначена для плазматической мембраны[21].
Везикулы, отправляемые из ЭПР в аппарат Гольджи, подвергаются там дальнейшей модификации и далее посылаются к другим частям клетки или к плазматической мембране для секреции. По мере продвижения по изобилующему ферментами внутреннему пространству аппарата с белками могут происходить различные превращения. Часто на них навешиваются и модифицируются углеводные хвосты, и в результате образуются гликопротеины. В аппарате Гольджи происходит отрезание и замещение моносахаридов, в результате чего получаются разнообразные олигосахариды. Аппарат Гольджи не только модифицирует белки, но также может производить сам некоторые вещества. Например, в растительной клетке в нём синтезируются пектины и другие структурные полисахариды[22].
Когда модификация белков завершается, аппарат Гольджи сортирует продукты превращений и отсылает их к различным частям клетки. Этому способствуют разнообразные метки, пришиваемые к белкам ферментами аппарата Гольджи. Полностью готовые белки отпочковываются в везикулах от транс-Гольджи и направляются к местам назначения[23].
Везикулы
[править | править код]Везикулы — это маленькие мембраносвязанные транспортные единицы, которые могут переносить молекулы между различными компартментами. Большинство везикул переносят мембраны, собранные в ЭПР, в аппарат Гольджи, а от аппарата Гольджи — в различные места клетки[24].
Существует несколько типов везикул, различающихся покрывающими их белками. Бо́льшая часть везикул образуется в специальных участках мембраны. Когда везикула отпочковывается от мембраны, её обращённая к цитозолю поверхность несёт специальные белки. Каждая мембрана, к которой движется везикула, несёт особые маркеры на своей цитоплазматической стороне. Маркер соответствует белкам, которыми окружена везикула. Когда везикула находит свою мембрану, они сливаются[25].
Известно три хорошо изученных типа везикул: клатрин-окаймлённые везикулы, COPI[англ.]-окаймлённые везикулы и COPII[англ.]-окаймлённые везикулы. Каждый тип выполняет определённые функции внутри клетки. Например, клатрин-окаймлённые везикулы переносят вещества между аппаратом Гольджи и плазматической мембраной. COPI- и COPII-окаймлённые везикулы часто используются для транспорта веществ между аппаратом Гольджи и ЭПР[25].
Вакуоли
[править | править код]Вакуоли, как и везикулы, представляют собой мембраносвязанные внутриклеточные мешочки. Они крупнее везикул и могут иметь различные специфические функции. Функции вакуолей в растительных и животных клетках различаются. В растительных клетках объём вакуолей составляет от 30 % до 90 % всего объёма клетки[26]. В большинстве зрелых растительных клеток имеется одна крупная центральная вакуоль, окружённая мембраной, называемой тонопластом. В растительных клетках вакуоли служат местом хранения запасных питательных веществ и отходов метаболизма. Раствор, в котором находятся все эти соединения внутри вакуоли, называется клеточным соком. Иногда в клеточном соке находятся пигменты, окрашивающие клетку. Вакуоли могут увеличивать размер клетки, наполняясь водой, и регулируют тургорное давление. Как и в лизосомах животных клеток, внутри вакуолей растительных клеток поддерживается кислая среда и имеется много гидролитических ферментов. pH вакуолей позволяет им поддерживать гомеостаз клетки. Например, когда рН во внеклеточной среде падает, протоны, плавающие в цитозоле, могут быть накачаны в вакуоли, чтобы поддерживать цитозольный рН постоянным[27].
У животных вакуоли участвуют в процессах экзоцитоза и эндоцитоза. Вещества, которые должны попасть из внеклеточной среды внутрь клетки, окружаются плазматической мембраной и переносятся в вакуоль. Существует два типа эндоцитоза: фагоцитоз (поглощение твёрдых частиц) и пиноцитоз (поглощение капель жидкости). При фагоцитозе клетка может поглощать и такие крупные частицы, как бактерии[28].
Лизосомы
[править | править код]Лизосомы — это органеллы, содержащие гидролитические ферменты для внутриклеточного пищеварения. Главной функцией лизосом является расщепление молекул, поглощённых клеткой, а также износившихся клеточных органелл. Ферменты лизосом — кислые гидролазы, для оптимальной их работы необходима кислая среда. Лизосомы обеспечивают такую среду, поддерживая внутри себя рН 5,0[29]. Если лизосома разрушится, то вышедшие из неё ферменты не будут очень активны из-за нейтрального рН цитозоля. Однако если в клетке одновременно разрушится много лизосом, то она может переварить сама себя.
Лизосомы осуществляют внутриклеточное пищеварение в ходе фагоцитоза, сливаясь с вакуолью и высвобождая в неё свои ферменты. В результате этого процесса сахара́, аминокислоты и другие мономеры выходят в цитозоль и становятся питательными веществами клетки. Лизосомы также используют свои ферменты для разрушения обветшавших органелл клетки в процессе аутофагии. Лизосомы заключают в себя износившуюся органеллу и подвергают её воздействию своих гидролитических ферментов. Образующиеся органические мономеры выходят в цитозоль для повторного использования. Наконец, последняя функция лизосом — участие в расщеплении клеткой самой себя в ходе автолиза[30].
Апикальное тельце
[править | править код]Апикальное тельце, или Spitzenkörper — компонент эндомембранной системы, встречающийся только у грибов, он участвует в росте концов грибных гиф. Это фазово-тёмное тельце, которое состоит из скопления мембраносвязанных везикул, содержащих компоненты клеточной стенки, и служит для высвобождения их между аппаратом Гольджи и плазматической мембраной. Апикальное тельце подвижно и при движении вперёд вызывает рост кончика гифы[7].
Плазматическая мембрана
[править | править код]
Плазматическая мембрана — это фосфолипидный бислой, отделяющий клетку от окружающей среды и регулирующий транспорт молекул и сигналов в клетку и из клетки. В плазматическую мембрану вставлены белки, выполняющие различные функции. Плазматическая мембрана — это не жёсткая структура, молекулы, её образующие, способы к латеральному перемещению (то есть перемещению в плоскости мембраны). Современная модель плазматической мембраны, в которой она состоит из разнообразных молекул, способных к латеральным перемещениям, называется жидкостно-мозаичной. Малые молекулы, такие как CO2, вода и кислород, могут проходить через мембрану за счёт свободной диффузии и осмоса. Крупные молекулы, необходимые клетке, доставляются внутрь специальными белками с помощью активного транспорта[31].
Плазматическая мембрана выполняет несколько функций. Среди них транспорт питательных веществ внутрь клетки, свободный выход отходов метаболизма, предотвращение попадания в клетку ненужных веществ, препятствие для выхода нужных молекул из клетки, поддержание рН цитозоля и его осмотического давления. Для выполнения этих функций используются транспортные белки, которые позволяют одним, но не другим молекулам проникать внутрь и вне клетки. Эти белки используют энергию гидролиза АТФ для накачивания веществ против их градиента концентрации[31].
Кроме вышеперечисленных общих функций, у многоклеточных организмов плазматическая мембрана может играть некоторые специфические роли. Гликопротеины мембраны участвуют в распознавании клетками друг друга для удаления метаболитов и организации тканей. Другие белки мембраны обеспечивают прикрепление к ней цитоскелета и межклеточного матрикса, благодаря чему клетка имеет определённую форму. В плазматической мембране также встречаются ферменты, катализирующие различные химические реакции. Белки-рецепторы мембраны имеют форму, подходящую для связывания с молекулой, передающей сигнал, что вызывает различные клеточные ответы[32].
Эволюция
[править | править код]Происхождение эндомембранной системы связано с происхождением эукариот как таковых и происхождению эукариот в связи с эндосимбиозом, положившим начало митохондриям[33]. Большинство современных гипотез утверждают, что эндомембранная система происходит из наружной мембраны везикул, отпочковывавшихся от эндосимбиотической митохондрии[34]. Эта модель происхождения эндомембранной системы требует минимального количества событий в происхождении эукариот и объясняет многие связи митохондрий с другими компартментами клетки[35].
Примечания
[править | править код]- ↑ Smith, A. L. Oxford dictionary of biochemistry and molecular biology (англ.). — Oxford [Oxfordshire]: Oxford University Press, 1997. — P. 206. — ISBN 0-19-854768-4.
- ↑ 1 2 Davidson, Michael The Nuclear Envelope. Molecular Expressions. Florida State University (2005). Дата обращения: 9 декабря 2008. Архивировано 16 мая 2019 года.
- ↑ Davidson, Michael The Endoplasmic Reticulum. Molecular Expressions. Florida State University (2005). Дата обращения: 9 декабря 2008. Архивировано 15 мая 2019 года.
- ↑ Graham, Todd R. Eurekah Bioscience Collection Cell Biology (англ.). — University of New South Wales and Landes Bioscience, 2000. — ISBN 0-7334-2108-3. Архивировано 20 июня 2021 года.
- ↑ Lodish, Harvey Section 5.4 Organelles of the Eukaryotic Cell. Molecular Cell Biology. W. H. Freeman and Company (2000). Дата обращения: 9 декабря 2008. Архивировано 20 июня 2021 года.
- ↑ Cooper, Geoffrey The Mechanism of Vesicular Transport. The Cell: A Molecular Approach. Sinauer Associates, Inc (2000). Дата обращения: 9 декабря 2008. Архивировано 20 июня 2021 года.
- ↑ 1 2 Steinberg G. Hyphal growth: a tale of motors, lipids, and the Spitzenkörper. (англ.) // Eukaryotic cell. — 2007. — Vol. 6, no. 3. — P. 351—360. — doi:10.1128/EC.00381-06. — PMID 17259546.
- ↑ Bryant D. A., Frigaard N. U. Prokaryotic photosynthesis and phototrophy illuminated. (англ.) // Trends in microbiology. — 2006. — Vol. 14, no. 11. — P. 488—496. — doi:10.1016/j.tim.2006.09.001. — PMID 16997562.
- ↑ Psencík J., Ikonen T. P., Laurinmäki P., Merckel M. C., Butcher S. J., Serimaa R. E., Tuma R. Lamellar organization of pigments in chlorosomes, the light harvesting complexes of green photosynthetic bacteria. (англ.) // Biophysical journal. — 2004. — Vol. 87, no. 2. — P. 1165—1172. — doi:10.1529/biophysj.104.040956. — PMID 15298919.
- ↑ Campbell Neil A., Jane B. Reece. Biology (неопр.). — 6th. — Benjamin Cummings[англ.], 2002. — ISBN 0-8053-6624-5.
- ↑ Morré DJ, Mollenhauer HH. The endomembrane concept: a functional integration of endoplasmic reticulum and Golgi apparatus. In Dynamic Aspects of Plant infrastructure / A. W. Robards. — London, New York: McGraw-Hill, 1974. — P. 84—137.
- ↑ Morre D J. Membrane Biogenesis // Annual Review of Plant Physiology. — 1975. — Июнь (т. 26, № 1). — С. 441—481. — ISSN 0066-4294. — doi:10.1146/annurev.pp.26.060175.002301.
- ↑ Voelker D. R. Organelle biogenesis and intracellular lipid transport in eukaryotes. (англ.) // Microbiological reviews. — 1991. — Vol. 55, no. 4. — P. 543—560. — PMID 1779926.
- ↑ Childs, Gwen V. Nuclear Envelope. UTMB (2003). Дата обращения: 28 сентября 2008. Архивировано 20 июня 2006 года.
- ↑ Cooper, Geoffrey The Nuclear Envelope and Traffic between the Nucleus and Cytoplasm. The Cell: A Molecular Approach. Sinauer Associates, Inc (2000). Дата обращения: 9 декабря 2008. Архивировано 20 июня 2021 года.
- ↑ Alberts, Walter Nuclear Pore Complexes Perforate the Nuclear Envelope. Molecular Biology of the Cell 4th edition. Garland Science (2002). Дата обращения: 9 декабря 2008. Архивировано 20 июня 2021 года.
- ↑ 1 2 3 4 5 6 7 8 9 Cooper, Geoffrey The Endoplasmic Reticulum. The Cell: A Molecular Approach. Sinauer Associates, Inc (2000). Дата обращения: 9 декабря 2008. Архивировано 20 июня 2021 года.
- ↑ Bertolotti A., Zhang Y., Hendershot L. M., Harding H. P., Ron D. Dynamic interaction of BiP and ER stress transducers in the unfolded-protein response. (англ.) // Nature cell biology. — 2000. — Vol. 2, no. 6. — P. 326—332. — doi:10.1038/35014014. — PMID 10854322.
- ↑ 1 2 3 4 5 6 7 8 9 Alberts, Walter Membrane-bound Ribosomes Define the Rough ER. Molecular Biology of the Cell 4th edition. Garland Science (2002). Дата обращения: 9 декабря 2008. Архивировано 20 июня 2021 года.
- ↑ Levine T., Loewen C. Inter-organelle membrane contact sites: through a glass, darkly. (англ.) // Current opinion in cell biology. — 2006. — Vol. 18, no. 4. — P. 371—378. — doi:10.1016/j.ceb.2006.06.011. — PMID 16806880.
- ↑ Rothman J. E. The golgi apparatus: two organelles in tandem. (англ.) // Science (New York, N.Y.). — 1981. — Vol. 213, no. 4513. — P. 1212—1219. — PMID 7268428.
- ↑ Alberts, Walter Transport from the ER through the Golgi Apparatus. Molecular Biology of the Cell 4th edition. Garland Science (2002). Дата обращения: 9 декабря 2008. Архивировано 20 июня 2021 года.
- ↑ Cooper, Geoffrey The Golgi Apparatus. The Cell: A Molecular Approach. Sinauer Associates, Inc (2000). Дата обращения: 9 декабря 2008. Архивировано 20 июня 2021 года.
- ↑ Lodish, Harvey Section 17.10 Molecular Mechanisms of Vesicular Traffic. Molecular Cell Biology. W. H. Freeman and Company (2000). Дата обращения: 9 декабря 2008. Архивировано 20 июня 2021 года.
- ↑ 1 2 Alberts, Walter The Molecular Mechanisms of Membrane Transport and the Maintenance of Compartmental Diversity. Molecular Biology of the Cell 4th edition. Garland Science (2002). Дата обращения: 9 декабря 2008. Архивировано 20 июня 2021 года.
- ↑ Alberts, Walter Plant and Fungal Vacuoles Are Remarkably Versatile Lysosomes. Molecular Biology of the Cell 4th edition. Garland Science (2002). Дата обращения: 9 декабря 2008. Архивировано 20 июня 2021 года.
- ↑ Lodish, Harvey Plant Vacuoles Store Small Molecules and Enable the Cell to Elongate Rapidly. Molecular Cell Biology. W. H. Freeman and Company (2000). Дата обращения: 9 декабря 2008. Архивировано 20 июня 2021 года.
- ↑ Cooper, Geoffrey Endocytosis. The Cell: A Molecular Approach. Sinauer Associates, Inc (2000). Дата обращения: 9 декабря 2008. Архивировано 20 июня 2021 года.
- ↑ Alberts, Walter Transport from the Trans Golgi Network to Lysosomes. Molecular Biology of the Cell 4th edition. Garland Science (2002). Дата обращения: 9 декабря 2008. Архивировано 10 апреля 2020 года.
- ↑ Cooper, Geoffrey Lysosomes. The Cell: A Molecular Approach. Sinauer Associates, Inc (2000). Дата обращения: 9 декабря 2008. Архивировано 20 июня 2021 года.
- ↑ 1 2 Cooper, Geoffrey Structure of the Plasma Membrane. The Cell: A Molecular Approach. Sinauer Associates, Inc (2000). Дата обращения: 9 декабря 2008. Архивировано 20 июня 2021 года.
- ↑ Lodish, Harvey Section 5.3. Biomembranes: Structural Organization and Basic Functions. Molecular Cell Biology. W. H. Freeman and Company (2000). Дата обращения: 9 декабря 2008.
- ↑ Martin W. F., Garg S., Zimorski V. Endosymbiotic theories for eukaryote origin. (англ.) // Philosophical transactions of the Royal Society of London. Series B, Biological sciences. — 2015. — Vol. 370, no. 1678. — P. 20140330. — doi:10.1098/rstb.2014.0330. — PMID 26323761.
- ↑ Gould S. B., Garg S. G., Martin W. F. Bacterial Vesicle Secretion and the Evolutionary Origin of the Eukaryotic Endomembrane System. (англ.) // Trends in microbiology. — 2016. — Vol. 24, no. 7. — P. 525—534. — doi:10.1016/j.tim.2016.03.005. — PMID 27040918.
- ↑ Murley A., Nunnari J. The Emerging Network of Mitochondria-Organelle Contacts. (англ.) // Molecular cell. — 2016. — Vol. 61, no. 5. — P. 648—653. — doi:10.1016/j.molcel.2016.01.031. — PMID 26942669.
Эта статья входит в число хороших статей русскоязычного раздела Википедии. |