ABC-модель развития цветка (ABC-bk;yl, jg[fnmnx efymtg)

Развитие цветка — это процесс, посредством которого цветковые растения запускают каскад экспрессии генов в меристеме, который приводит к образованию органа полового размножения — цветка. Чтобы это произошло, растение должно пройти три стадии развития и сопутствующие им физиологические изменения: во-первых, оно должно достичь половой зрелости и стать половозрелой особью (то есть, переход к цветению); во-вторых, должно произойти преобразование апикальной меристемы из вегетативной во флоральную меристему (то есть, должна произойти закладка цветка); и, наконец, рост и развитие индивидуальных органов цветка. Для объяснения механизма последней стадии была придумана модель ABC, которая пытается описать биологическую основу процесса с точки зрения молекулярной генетики и биологии развития.
Для запуска процесса цветения необходим внешний стимул, который мог бы запустить дифференцировку меристемы. Этот стимул запускает митотическое деление клеток меристемы, в особенности по бокам, где формируются зачатки цветков. Тот же стимул заставляет меристему включить генетическую программу развития, которая приведёт к росту флоральной меристемы. Главное различие между флоральной и вегетативной меристемами, кроме очевидного несоответствия между образуемыми органам, — это наличие у первой мутовчатого филлотаксиса, суть которого заключается в том, что образуется зародыш, между отдельными мутовками органов которого не происходит удлинения стебля. Эти мутовки претерпевают акропетальное развитие, давая начало чашелистикам, лепесткам, тычинкам и плодолистикам. Ещё одно отличие от вегетативных пазушных меристем — «детерминированность» флоральной меристемы: после дифференцировки её клетки больше не могут делиться[1].
Меристемы цветка можно подразделить на два типа: генеративные меристемы, из которых формируются соцветия, и которые дают начало цветковой меристеме, формирующей органы цветка. Цветковые меристемы дают начало четырём органам цветка: чашелистикам, лепесткам венчика, тычинкам и плодолистикам (пестику). Все органы цветка и соответствующие меристемы закладываются как мутовки, то есть расположены в виде концентрических кругов вокруг цветковой меристемы[2]. То, какой орган будет сформирован из четырёх мутовок цветка, определяется взаимодействием по крайней мере трёх классов генов, а точнее их продуктов, каждый из которых выполняет свою специфическую функцию. Согласно ABC-модели, функции генов класса A необходимы для закладки мутовок околоцветника, а гены класса C для закладки репродуктивных мутовок. Функции этих генов незаменимы, и отсутствие одной из них будет означать, что другая будет определять идентичность всех флоральных меристем. Функция генов класса B — образование лепестков из чашелистиков во второй мутовке, а также формирование тычинок из плодолистиков в четвёртой мутовке.
Считается, что все органы цветка являются видоизменёнными листьями или выростами стебля. Эту идею впервые высказал И. В. Гёте в XVIII веке. Впервые «цветковая теория» Гёте была опубликована в 1790 году в эссе «Опыт объяснения метаморфоза растений» (нем. Versuch die Metamorphose der Pflanzen zu erklaren)[3], где Гёте написал:
Ибо мы можем одинаково хорошо сказать, что тычинка является сжавшимся лепестком, и что лепесток — это тычинка в состоянии расширения; что чашелистик — это сжавшийся, приближающийся к известной степени утончённости стеблевой лист, и что последний — это под напором грубых соков расширившийся чашелистик.Goethe J.W. von Versuch die Metamorphose der Pflanzen zu erklaren. — Gotha, Ettlinger, 1790; paragraph 120.
Переход к цветению
[править | править код]При переходе к цветению в жизненном цикле растений происходят кардинальные изменения, возможно, даже самые важные из всех. Весь процесс должен пройти без ошибок, чтобы гарантировать растению возможность оставить после себя потомство. Переход начинается с закладки генеративной меристемы, которая даст начало соцветию или одному цветку. Это морфогенетическое изменение состоит из эндогенных и экзогенных элементов. Например, чтобы зацвести, у растения должно быть определённое количество листьев и определённое количество общей биомассы. Также необходимы подходящие внешние условия, такие как длина светового дня и температура. В этом процессе большую роль играют фитогормоны, в особенности гиббереллины, которые могут стимулировать переход к цветению[4].
Существует множество сигналов, которые регулируют зацветание на молекулярно-биологическом уровне. Основную роль у Arabidopsis thaliana играют следующие три гена: FLOWERING LOCUS T (FT), LEAFY (LFY), SUPPRESOR OF OVEREXPRESSION OF CONSTANS1 (SOC1, также называемый AGAMOUS-LIKE20)[5]. SOC1 кодирует MADS-box-белок, который интегрирует сигналы от других белков, реагирующих на длину светового дня, яровизацию, уровень сахарозы и гиббереллины[4]. SOC1, в свою очередь, активирует ген LEAFY, который кодирует трансфактор и запускает основной каскад генов, ведущий к образованию органов цветка. Продукт гена FT — это небольшой белок с массой 23 кДа, который по отношению к гену SOC1 является активатором более высокого порядка. Согласно современным представлениям, белок FT — это тот самый таинственный флориген, существование которого постулировал М. Х. Чайлахян. Под влиянием благоприятных условий, таких как качество света, длина светового дня и яровизация, в листьях растения происходит синтез белка FT, который с током соков флоэмы попадает в апикальную меристему, где взаимодействует с постоянно находящимся там белком FD, который представляет собой трансфактор типа цинкового пальца. Вместе эти два белка запускают трансформацию вегетативной меристемы во флоральную и активируют нижележащий ген SOC1.
Закладка флоральной меристемы
[править | править код]Меристему можно определить как ткань или группу клеток растения, состоящую из недифференцированных стволовых клеток, которые способны образовывать различные специализированные ткани. Их поддержание и развитие как в вегетативной, так и в генеративной меристеме контролируются генетическим механизмом детерминации и клеточной дифференцировки. Это означает, что ряд генов будут напрямую регулировать, например, поддержание стволовых клеток (ген WUSCHEL или WUS), а другие будут оказывать противоположное действие по механизму отрицательной обратной связи, ингибируя действие этого гена (например, ген CLAVATA или CLV). Оба эти механизма образуют петлю обратной связи, которая вместе с остальными элементами придаёт системе значительную устойчивость[6]. Ген WUS отвечает за поддержание клеточных делений клеток апикальной меристемы, а ген SHOOTMERISTEMLESS (STM) подавляет их дифференцировку, но всё же позволяет дочерним клеткам делиться. Если бы эти клетки могли пройти дифференцировку, то они дали бы начало новым органам растения[7].
Архитектура цветка
[править | править код]
Анатомия цветка, её чёткая организация, призвана способствовать половому размножению цветковых растений. Цветок создаётся благодаря активности трёх классов генов, которые регулируют его развитие[8]:
- Гены идентичности меристемы. Кодируют транскрипционные факторы, которые необходимы для превращения генеративной меристемы в цветковую. У мутантов по генам идентичности меристем развиваются побегоподобные структуры или цветки, похожие на побеги.
- Гены идентичности органов цветка. Напрямую контролируют процессы формирования органов цветка. Также кодируют транскрипционные факторы, которые влияют на экспрессию других генов, чьи продукты необходимы для образования и функционирования отдельных органов цветка.
- Кадастровые гены. Действуют как пространственные регуляторы для генов идентичности органов, определяя границы их экспрессии. Таким образом, они контролируют меру взаимодействия генов между собой, тем самым определяя, будут ли они экспрессироваться в одном месте и в одно время.
Модель ABC
[править | править код]
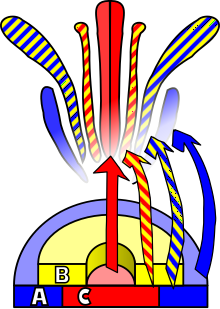
ABC-модель развития цветка впервые была сформулирована Джорджем Хоуном и Крисом Самерсвиллем в 1988 году[9]. Сначала она использовалась как модель для объяснения собрания множества генетических закономерностей и механизмов, выявленных при образовании цветка у подкласса розид на примере Arabidopsis thaliana, и у астерид на примере Antirrhinum majus. Оба вида имеют по четыре мутовки (чашелистики, лепестки, тычинки и плодолистики), образование которых определяется определённой экспрессией ряда гомеозисных генов в каждой из этих мутовок. Образование чашелистиков полностью определяется экспрессией генов A, а вот для образования лепестков необходима совместная экспрессия генов A и B. Гены B и C определяют идентичность тычинок, в для формирования плодолистиков нужны только гены C. Гены типа A и C являются взаимными антагонистами[10].
Тот факт, что эти гомеозисные гены определяют идентичность органа, становится очевидным, когда ген одного из этих классов, например ген A, не экспрессируется. У Arabidopsis такая потеря функции гена приводит к образованию цветка с одной мутовкой плодолистиков, одной из тычинок и одной дополнительной из плодолистиков[10]. Такой метод изучения функции генов использует обратную генетику, чтобы создавать трансгенные растения при помощи механизма сайленсинга посредством РНК-интерференции. В других исследованиях, использующих методы прямой генетики, такие как генетическое картирование, анализируется фенотип цветков со структурными аномалиями, из которых затем клонируется интересующий исследователей ген. У такого цветка может быть дисфункциональный или гиперактивный аллель ответственного за мутацию гена[11].
Помимо основных классов генов A, B и C, были обнаружены два дополнительных класса генов D и E. Гены D отвечают за образование семяпочки как за отдельный процесс, не связанный с образованием плодолистиков (пестика), который происходит уже после их закладки[12]. Действие генов E необходимо для всех четырёх мутовок, хотя изначально предполагалось, что они требуются только для развития трёх внутренних мутовок (функция генов E sensu stricto)[13]. Однако, в более широком смысле (sensu lato) они необходимы для всех четырёх мутовок[14]. Таким образом, при отключении генов D нарушается строение семяпочек, и они становятся похожими на листья, а при утрате функции генов E sensu stricto органы цветка трёх внутренних мутовок преобразуются в чашелистики[13]. Если же говорить sensu lato, то органы всех четырёх мутовок становятся листоподобными[14]. Белки, кодируемые этими генами, относятся к MADS-бокс-белкам[15].
Генетический анализ
[править | править код]


Методологически исследование развития цветка осуществлялось в два шага. Сначала точно идентифицировались гены, необходимые для закладки флоральной меристемы. У A. thaliana к этим генам относятся APETALA1 (AP1) и LEAFY (LFY). Затем осуществлялся генетический анализ аберрантных фенотипов по относительным характеристикам цветков, что позволяло охарактеризовать гомеозисные гены, вовлечённые в процесс.
Анализ мутаций
[править | править код]Обнаружено множество мутаций, влияющих на морфологию цветка, хотя систематический анализ соответствующих мутантов стал проводиться относительно недавно. Многие из них изменяют идентичность органов цветка, например, некоторые органы развиваются в том месте, где должны были бы развиваться другие. Это так называемые гомеозисные мутации, которые аналогичны мутациям HOX-генов, обнаруженных у Drosophila. У Arabidopsis и Antirrhinum, тех двух таксонов, на которых основана ABC-модель, эти мутации всегда затрагивают смежные мутовки. В соответствии с этим, все мутации можно подразделить на три класса в зависимости от того, на какие мутовки они влияют:
- Мутации в генах A: эти мутации затрагивают чашечку и венчик, то есть самые отстоящие от центра мутовки. У таких мутантов (APETALA2 у A. thaliana) вместо чашелистиков развиваются плодолистики, а вместо лепестков — тычинки. Проще говоря, мутовки околоцветника преобразуются в репродуктивные мутовки.
- Мутации в генах B: эти мутации затрагивают венчик и тычинки, то есть промежуточные мутовки. Среди образцов A. thaliana были обнаружены две мутации: APETALA3 и PISTILLATA. У таких мутантов вместо лепестков развиваются чашелистики, а вместо тычинок — плодолистики.
- Мутации в генах C: эти мутации затрагивают репродуктивные мутовки, а именно тычинки и плодолистики. У A. thaliana мутация такого типа называется AGAMOUS. Вместо тычинок развиваются лепестки, а вместо плодолистиков — чашелистики.
Техника анализа экспрессии генов
[править | править код]ДНК генов, ответственных за гомеозисные мутации в мутантах, упомянутых ранее, были клонированы, а их структура и продукты исследованы. В исследовании использовался серийный анализ экспрессии генов, чтобы определить характер экспрессии генов в разных тканях в течение всего времени развития цветка. Место и последовательность экспрессии в целом совпали с предсказанными ABC-моделью.
По своей природе белки, закодированные в этих генах, оказались транскрипционными факторами. Аналогичная группа факторов транскрипции, как и ожидалось, есть у дрожжей и животных. Эта группа называется MADS-белки; название — акроним из первых букв названий четырёх первых членов этого семейства. MADS-факторы были обнаружены у всех изученных видов растений, хотя нельзя исключать, что в регуляции экспрессии генов у них могут принимать участие и другие элементы[8].
Гены группы A
[править | править код]У A. thaliana класс A представлен двумя генами: APETALA1 (AP1) и APETALA2 (AP2)[16]. AP1 — это белок MADS-box, а AP2 относится к семейству генов CBF, кодирующих белки, у которых есть AP2-домен. Это семейство состоит из трёх транскрипционных факторов и встречается только у растений[17]. AP1 контролирует закладку чашелистиков и цветков, а также активен во флоральной меристеме. AP2 функционирует не только в первых двух мутовках (чашелистики и лепестки), но также и в двух внутренних мутовках, а также в развивающихся семяпочках и даже в листьях и побегах. Было также показано, что его экспрессия необходима для прорастания семян. Весьма вероятно, что существует некий механизм посттранскрипционной регуляции, который влияет на его способность выполнять A-функцию, или что у него есть функции в процессе дифференцировки органов, которые никак не связаны с формированием цветка[17].
У Antirrhinum ген, ортологичный AP1, называется SQUAMOSA (SQUA) и тоже влияет на флоральную меристему. AP2 гомологичны гены LIPLESS1 (LIP1) и LIPLESS2 (LIP2), которые обладают взаимозаменяемой функцией и участвуют в развитии чашелистиков, лепестков и семяпочек[18].
Из Petunia hybrida были выделены три гена, схожие с AP2: APETALA2A (PhAP2A), PhAP2B и PhAP2C. PhAP2A в значительной степени гомологичен гену AP2 Arabidopsis, как по первичной последовательности аминокислот, так и по характеру экспрессии, из чего можно сделать вывод, что эти два гена — ортологи. Белки PhAP2B и PhAP2C, напротив, несколько отличаются от AP2, хотя они и принадлежат к семейству транскрипционных факторов, схожему с семейством AP2. К тому же оба эти гена экспрессируются по-разному, хотя они и весьма схожи, если сравнивать их с PhAP2A . Фактически мутации в этих генах не дают обычного фенотипа, соответствующего нуль-аллелю A генов[19] На самом деле у петунии не было обнаружено настоящих генов, выполняющих A-функции; часть A-функций (ингибирование генов класса C в двух внешних мутовках) было в значительной степени обусловлено миРНК169 (в просторечии называемой BLIND).
Гены группы B
[править | править код]У A. thaliana к классу генов B относятся только два гена: APETALA3 (AP3) и PISTILLATA (PI), оба кодирующие MADS-белки. Мутация хотя бы в одном из этих генов вызывает гомеозисное преобразование лепестков в чашелистики, а тычинок в плодолистики[20]. То же самое происходит с ортологичными генами у A. majus: DEFICIENS (DEF) и GLOBOSA (GLO)[21]. У обоих видов эти белки функционируют как гетеродимеры: AP3 и PI или DEF и GLO. Только в такой форме они могут связываться с ДНК[22].
У петунии ген, эквивалентный GLO/PI, подвергся дупликации, в результате чего образовалось два гена: P. hybrida GLOBOSA1 (PhGLO1, также называемый FBP1) и PhGLO2 (называемый PMADS2 или FBP3). Что касается гена, эквивалентного по функции AP3/DEF, то у петунии есть ген с относительно схожей последовательностью, который называется PhDEF, и ещё один атипичный ген с B-функцией — PhTM6. Филогенетические исследования отнесли первые три гена к линии «euAP3», а ген PhTM6 был отнесён к более древней линии «paleoAP3»[23]. Следует обратить внимание, что с точки зрения эволюционной истории возникновение линии euAP3, по-видимому, связано с появлением двудольных, поскольку гены B из линии euAP3 в основном присутствуют у двудольных, а гены из линии paleoAP3 — у однодольных и палеодикот[24].

Как уже обсуждалось выше, органы цветка покрытосеменных эудикот распределены по 4 разным мутовкам, из которых возникают чашелистики, лепестки, тычинки и плодолистики. Модель ABC утверждает, что закладка этих органов определяется гомеозисными генами A, A+B, B+C и C. В отличие от чашелистиков и лепестков эудикот, околоцветник многих растений из семейства Liliaceae (Лилейные) состоит из двух практически идентичных лепесткообразных мутовок. Что объяснить морфологию цветка Liliaceae, в 1993 году ван Танен и др. предложили модифицированную модель ABC. Эта модель предполагает, что гены класса B экспрессируются не только в мутовках 2 и 3, но также в мутовке 1. Из этого следует, что органы мутовок 1 и 2 экспрессируют гены класса A и B и, таким образом, приобретают лепесткообразное строение. Модель была подтверждена экспериментально, когда из тюльпана Tulipa gesneriana удалось выделить и охарактеризовать гены, гомологичные генам GLOBOSA и DEFICIENS из львиного зева. Как оказалось, эти гены экспрессировались в трёх мутовках[25].
Гомологи GLOBOSA и DEFICIENS также были выделены из Agapanthus praecox ssp. orientalis (Агапантовые), который филогенетически далеко отстоит от модельных организмов. Гены получили название ApGLO и ApDEF. Оба обладают открытой рамкой считывания и кодируют белки длиной 210—214 аминокислотных остатков. Филогенетический анализ этих генов показал, что они принадлежат к семейству генов B однодольных растений. Методом гибридизации in situ было показано, что оба гена активны в мутовках 1, 2 и 3. Собранные вместе, эти наблюдения дают нам понять, что механизм развития цветка у Agapanthus следует модифицированной ABC-модели[26].
Гены группы C
[править | править код]У A. thaliana к генам класса C относится ген, кодирующий MADS-белок, AGAMOUS (AG), который участвует в образовании тычинок и плодолистиков, а также в закладке флоральной меристемы[16]. Мутанты по гену AG лишены андроцея и гинецея, вместо которых развиваются лепестки и чашелистики. Кроме этого, нарушается рост середины цветка, в результате чего лепестки и чашелистики растут повторяющимися мутовками.
Ген PLENA (PLE) представленный у A. majus вместо гена AG, не является его ортологом. Гомологом гена AG у A. majus служит другой ген — FARINELLI (FAR), который участвует в развитии пыльников и созревании пыльцы[27].
У петунии, львиного зева и кукурузы функцию генов C выполняет целый ряд генов, которые действуют по той же схеме. К ближайшим гомологам гена AG у Petunia можно отнести pMADS3 и floral-binding protein 6 (FBP6)[27].
Гены группы D и E
[править | править код]
Гены класса D были открыты в 1995 году. Они кодируют MADS-белки и обладают специфической функцией, отличающейся от всех описанных ранее, хотя и обладают определённой гомологией с генами класса C. К этим генам относятся FLORAL BINDING PROTEIN7 (FBP7) и FLORAL BINDING PROTEIN1L (FBP1l)[12]. Было обнаружено, что у петунии они участвуют в развитии семяпочек. Аналогичные гены были позже найдены у Arabidopsis[28], где они также контролируют развитие плодолистиков, семяпочек и даже некоторых структур, имеющих отношение к распространению семян. Эти гены носят название SHATTERPROOF 1, 2 (SHP) и SEEDSTICK (STK). Ген SHP представлен в геноме Arabidopsis двумя весьма схожими копиями, которые выполняют одинаковую функцию. Подобно тому, как это происходит у генов класса B, белки SHP и STK должны образовать гетеродимер, чтобы иметь возможность связываться с ДНК.
Во время исследования петунии и томатов методом РНК интерференции был получен интересный фенотип, результатом обнаружения которого явилось то, что в 1994 году была выделена новая функция в модели развития цветка и соответствующие ей гены. Изначально предполагалось, что гены класса E участвуют только в развитии трёх внутренних мутовок, но последующие работы выявили, что их экспрессия необходима для всех мутовок цветка[13]. У Arabidopsis было обнаружено четыре гена класса E, обозначаемые как SEPALLATA: SEP1, SEP2, SEP3 и SEP4. Все четыре гена выполняют одну функцию и дублируют друг друга, однако у мутанта, дефектного по всем четырём генам SEP, не происходит развития органов цветка, и весь цветок полностью состоит из чашелистиков (фактически из листьев).
Модель квартетов
[править | править код]ABC-модель принесла упорядоченность и дала существенный толчок исследованиям морфогенеза цветка, но она ничего не говорит о молекулярных механизмах, стоящих за этим процессом. В 2001 году Гюнтер Тайссен[29], основываясь на литературных данных и многочисленных наблюдениях, скопившихся к тому времени, предложил так называемую «модель квартетов». Было доподлинно известно, что MADS-белки взаимодействуют с ДНК, образуя димеры, как это происходит с генами класса B и C. Основываясь на том, что для развития цветка необходимы пять классов генов (A, B, C, D и E), Тайссен высказал предположение, что продукты генов идентичности органов цветка функционируют в виде гетеротетрамерных белковых комплексов. В последующих работах его гипотеза получила подтверждение и вскоре стала общепринятой. Такая модель позволила перейти от абстрактного взаимодействия генов к конкретным физическим объектам. Согласно модели квартетов продукты генов A+E необходимы для образования чашелистиков, A+B+E — лепестков, B+C+E — тычинок, C+E — плодолистиков и D+E — семяпочек. Каждая пара MADS-трансфакторов способна связываться с ДНК, в которой есть последовательность CC[A/T]6GG, коротко обозначаемая как CArG-box[30], поэтому предполагается, что квартет белков связывается сразу с двумя CArG-боксами на разных участках ДНК, заставляя его свернуться в петлю. Затем, в зависимости от состава квартета, он запускает или подавляет экспрессию генов с каждого из участков ДНК. Как полагают, гены класса E играют в этом процессе значительную роль, обеспечивая связывание двух димеров в тетрамер. Подобная система была, в конечном итоге, обнаружена у всех модельных растений. На данный момент модель квартетов является общепринятой моделью молекулярно-биологического развития цветка[31].
На данный момент, для A. thaliana выявлено пять белковых комплексов, отвечающих за развитие определённого органа цветка[32]:
- чашелистики (A+E) AP1/AP1/SEP/SEP
- лепестки (A+B+E) AP1/AP3/PI/SEP
- тычинки (B+C+E) PI/AP3/AG/SEP
- плодолистики (C+E) AG/AG/SEP/SEP
- семяпочки (C+D+E) AG/SHP/STK/SEP
См. также
[править | править код]Примечания
[править | править код]- ↑ Azcón-Bieto et al. Fundamentos de fisiología vegetal (исп.). — McGraw-Hill/Interamericana de España, SAU, 2000. — ISBN 84-486-0258-7.
- ↑ Медведев, 2013, с. 264.
- ↑ Dornelas Marcelo Carnier, Dornelas Odair. From leaf to flower: Revisiting Goethe's concepts on the ¨metamorphosis¨ of plants (англ.) // Plant Physiology : journal. — American Society of Plant Biologists, 2005. — Vol. 17, no. 4. — doi:10.1590/S1677-04202005000400001.
- ↑ 1 2 Blazquez MA; Green R; Nilsson O; Sussman MR; Weigel D. Gibberellins promote flowering of arabidopsis by activating the LEAFY promoter (англ.) // The Plant cell : journal. — 1998. — Vol. 10, no. 5. — P. 791—800. — doi:10.1105/tpc.10.5.791. — PMID 9596637. — . — PMC 144373.
- ↑ Blázquez Miguel A.; Weigel Detlef. Integration of floral inductive signals in Arabidopsis (англ.) // Nature : journal. — 2000. — Vol. 404, no. 6780. — P. 889—892. — doi:10.1038/35009125. — PMID 10786797.
- ↑ Brand U; Fletcher JC; Hobe M; Meyerowitz EM; Simon R. Dependence of Stem Cell Fate in Arabidopsis on a Feedback Loop Regulated by CLV3 Activity (англ.) // Science : journal. — 2000. — Vol. 289, no. 5479. — P. 617—619. — doi:10.1126/science.289.5479.617. — . — PMID 10915624.
- ↑ Michael Lenhard, Gerd Jürgens, Thomas Laux. The WUSCHEL and SHOOTMERISTEMLESS genes fulfil complementary roles in Arabidopsis shoot meristem regulation (англ.) // Development (Cambridge, England)[англ.] : journal. — 2002. — Vol. 129, no. 13. — P. 3195—3206. — PMID 12070094.
- ↑ 1 2 Taiz, Zeiger. Plant physiology (англ.). — Sinauer associates, 2002. — ISBN 0-87893-823-0.
- ↑ Haughn George W; Somerville Chris R. Genetic control of morphogenesis in Arabidopsis (англ.) // Developmental Genetics[англ.] : journal. — 1988. — Vol. 9, no. 2. — P. 73. — doi:10.1002/dvg.1020090202.
- ↑ 1 2 Expression of the Arabidopsis floral homeotic gene AGAMOUS is restricted to specific cell types late in flower development (англ.) : journal. — 1991. — August (vol. 3, no. 8). — P. 749—758. — doi:10.1105/tpc.3.8.749. — PMID 1726485. — . — PMC 160042.
- ↑ Somerville C; Somerville S. Plant Functional Genomics (англ.) // Science. — 1999. — Vol. 285, no. 5426. — P. 380—383. — doi:10.1126/science.285.5426.380. — PMID 10411495.
- ↑ 1 2 Colombo L; Franken J; Koetje E; Van Went J; Dons HJ; Angenent GC; Van Tunen AJ. The petunia MADS box gene FBP11 determines ovule identity (англ.) // The Plant cell : journal. — 1995. — Vol. 7, no. 11. — P. 1859—1868. — doi:10.1105/tpc.7.11.1859. — PMID 8535139. — PMC 161044.
- ↑ 1 2 3 Pelaz Soraya, Ditta Gary S., Baumann Elvira, Wisman Ellen, Yanofsky Martin F. B and C floral organ identity functions require SEPALLATA MADS-box genes (англ.) // Nature : journal. — 2000. — Vol. 405, no. 6783. — P. 200—203. — doi:10.1038/35012103. — PMID 10821278.
- ↑ 1 2 Ditta Gary, Pinyopich Anusak, Robles Pedro, Pelaz Soraya, Yanofsky Martin F. The SEP4 Gene of Arabidopsis thaliana Functions in Floral Organ and Meristem Identity (англ.) // Current Biology : journal год=2004. — Cell Press. — Vol. 14, no. 21. — P. 1935—1940. — doi:10.1016/j.cub.2004.10.028. — PMID 15530395.
- ↑ Ma Hong. Molecular Genetic Analyses of Microsporogenesis and Microgametogenesis in Flowering Plants (англ.) // Annual Review of Plant Biology : journal. — 2005. — Vol. 56. — P. 393—434. — doi:10.1146/annurev.arplant.55.031903.141717. — PMID 15862102.
- ↑ 1 2 Bowman J. L. Genes Directing Flower Development in Arabidopsis (англ.) // The Plant Cell Online : journal. — 1989. — Vol. 1, no. 1. — P. 37—52. — doi:10.1105/tpc.1.1.37. — PMID 2535466. — . — PMC 159735.
- ↑ 1 2 Jofuku K. D., Den Boer B. G., Van Montagu M., Okamuro J. K. Control of Arabidopsis flower and seed development by the homeotic gene APETALA2 (англ.) // The Plant cell : journal. — 1994. — Vol. 6, no. 9. — P. 1211—1225. — doi:10.1105/tpc.6.9.1211. — PMID 0007919989. — . — PMC 160514.
- ↑ Keck, Emma; McSteen, Paula; Carpenter, Rosemary; Coen, Enrico. Separation of genetic functions controlling organ identity in flowers (англ.) // The EMBO Journal : journal. — 2003. — Vol. 22, no. 5. — P. 1058—1066. — doi:10.1093/emboj/cdg097. — PMID 12606571. — PMC 150331.
- ↑ Maes T., Van De Steene N., Zethof J., Karimi M., d'Hauw M., Mares G., Van Montagu M., Gerats T. Petunia Ap2-like genes and their role in flower and seed development (англ.) // The Plant cell : journal. — 2001. — Vol. 13, no. 2. — P. 229—244. — doi:10.1105/tpc.13.2.229. — PMID 11226182. — . — PMC 102239.
- ↑ Bowman J.L., Smyth D.R., Meyerowitz E.M. Genes directing flower development in Arabidopsis (англ.) // The Plant cell : journal. — 1989. — Vol. 1, no. 1. — P. 37—52. — doi:10.1105/tpc.1.1.37. — PMID 2535466. — . — PMC 159735.
- ↑ Sommer H; Beltrán JP; Huijser P; Pape H; Lönnig WE; Saedler H; Schwarz-Sommer Z. Deficiens, a homeotic gene involved in the control of flower morphogenesis in Antirrhinum majus: The protein shows homology to transcription factors (англ.) // The EMBO Journal : journal. — 1990. — Vol. 9, no. 3. — P. 605—613. — PMID 1968830. — PMC 551713.
- ↑ Riechmann Jose Luis, Allyn Krizek Beth, Meyerowitz Elliot M. Dimerization Specificity of Arabidopsis MADS Domain Homeotic Proteins APETALA1, APETALA3, PISTILLATA, and AGAMOUS (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 1996. — Vol. 93, no. 10. — P. 4793—4798. — doi:10.1073/pnas.93.10.4793. — . — PMID 8643482. — . — PMC 39358.
- ↑ Vandenbussche M; Zethof J; Royaert S; Weterings K; Gerats T. The duplicated B-class heterodimer model: Whorl-specific effects and complex genetic interactions in Petunia hybrida flower development (англ.) // The Plant Cell : journal. — 2004. — Vol. 16, no. 3. — P. 741—754. — doi:10.1105/tpc.019166. — PMID 14973163. — . — PMC 385285.
- ↑ Kramer EM; Dorit RL; Irish VF. Molecular evolution of genes controlling petal and stamen development: Duplication and divergence within the APETALA3 and PISTILLATA MADS-box gene lineages (англ.) // Genetics : journal. — 1998. — Vol. 149, no. 2. — P. 765—783. — PMID 9611190. — PMC 1460198.
- ↑ Kanno Akira, Saeki Hiroshi, Kameya Toshiaki, Saedler Heinz, Theissen Günter. Heterotopic expression of class B floral homeotic genes supports a modified ABC model for tulip (Tulipa gesneriana) (англ.) // Plant Molecular Biology : journal. — 2003. — Vol. 52, no. 4. — P. 831—841. — doi:10.1023/A:1025070827979. — PMID 13677470.
- ↑ Nakamura Toru, Fukuda Tatsuya, Nakano Masaru, Hasebe Mitsuyasu, Kameya Toshiaki, Kanno Akira. The modified ABC model explains the development of the petaloid perianth of Agapanthus praecox ssp. Orientalis (Agapanthaceae) flowers (англ.) // Plant Molecular Biology : journal. — 2005. — Vol. 58, no. 3. — P. 435—445. — doi:10.1007/s11103-005-5218-z. — PMID 16021405.
- ↑ 1 2 Davies Brendan, Motte Patrick, Keck Emma, Saedler Heinz, Sommer Hans, Schwarz-Sommer Zsuzsanna. PLENA and FARINELLI: Redundancy and regulatory interactions between two Antirrhinum MADS-box factors controlling flower development (англ.) // The EMBO Journal : journal. — 1999. — Vol. 18, no. 14. — P. 4023—4034. — doi:10.1093/emboj/18.14.4023. — PMID 10406807. — PMC 1171478.
- ↑ Favaro R; Pinyopich A; Battaglia R; Kooiker M; Borghi L; Ditta G; Yanofsky MF; Kater MM; Colombo L. MADS-box protein complexes control carpel and ovule development in Arabidopsis (каталан.) // The Plant cell. — 2003. — Vol. 15, num. 11. — P. 2603—2611. — doi:10.1105/tpc.015123. — PMID 14555696. — . — PMC 280564.
- ↑ Günter Theißen. Development of floral organ identity: stories from the MADS house (англ.) // Current Opinion in Plant Biology : journal. — Elsevier, 2001. — 1 February (vol. 4, no. 1). — P. 75—85. — doi:10.1016/S1369-5266(00)00139-4.
- ↑ West A.G.; Shore P.; Sharrocks A.D. DNA binding by MADS-box transcription factors: a molecular mechanism for differential DNA bending (англ.) // Mol. Cell. Biol. : journal. — 1997. — 1 May (vol. 17, no. 5). — P. 2876—2887. — PMID 9111360. — PMC 232140. Архивировано 27 сентября 2011 года.
- ↑ Nancy A. Eckardt. MADS Monsters. Controlling Floral Organ Identity (англ.) // The Plant Cell : journal. — 2003. — April (vol. 15, no. 4). — P. 803—805. — doi:10.1105/tpc.150410. Архивировано 10 сентября 2020 года.
- ↑ Morphogenesis of the flower of Arabidopsis, genes networks and mathematical modelling. Дата обращения: 18 октября 2015. Архивировано 12 ноября 2015 года.
Литература
[править | править код]- Лутова Л. А., Ежова Т. А., Додуева И. Е., Осипова М. А. Генетика развития растений / под ред. С. Г. Инге-Вечтомова. — 2-е изд, перераб. и доп.. — СПб.: Издательство Н-Л, 2010. — С. 361—389. — 432 с. — ISBN 978-5-94869-104-6.
- Медведев С. С. Физиология растений. — СПб.: БХВ-Петербург, 2013. — 335 с.
- Advances in botanical research: Developmental genetics of the flower (англ.) / Soltis, DE; Soltis, PS; Leebens-Mack, J.. — New York, NY: Academic Press, 2006. — ISBN 978-0-12-005944-7.
- Wolpert, Lewis; Beddington, R.; Jessell, T.; Lawrence, P.; Meyerowitz, E.; Smith, W. Principles of Development (англ.). — Second ed. — Oxford: Oxford University Press, 2002. — ISBN 0-19-879291-3.
Ссылки
[править | править код]- Genes controlling flower development in plants
- Flower Development Архивная копия от 15 января 2008 на Wayback Machine