310-спираль (310-vhnjgl,)

Спираль 310 (спираль 3.10) — тип вторичной структуры, встречающийся в белках и полипептидах. Из множества присутствующих вторичных структур белка 310-спираль является четвёртым наиболее часто наблюдаемым типом после α-спиралей, β-листов и β-поворотов[англ.]. 310-спирали составляют почти 15-20 % от всех спиралей во вторичных структурах белков и обычно наблюдаются как продолжения α-спиралей, обнаруживаемые либо на их N-, либо на C-концах. 310-спирали в белках обычно имеют длину всего от трёх до пяти остатков по сравнению со средним значением 10-12 остатков для α-спиралей. Из-за тенденции α-спиралей к последовательному сворачиванию и разворачиванию было предложено, что 310-спираль служит своего рода промежуточной конформацией при сворачивании/разворачивании α-спиралей[1].

Открытие
[править | править код]Макс Перуц, глава лаборатории молекулярной биологии при Медицинском исследовательском совете Кембриджского университета, написал первую статью, в которой задокументировал спираль 310[2]. Вместе с Лоуренсом Брэггом и Джоном Кендрю Перуц опубликовал исследование конфигураций полипептидных цепей в 1950 году, основанное на данных некристаллической дифракции, а также на кристаллических структурах малых молекул, таких как кристаллы, обнаруженные в волосах[3]. Их предложения включали то, что сейчас известно как спираль 310, но не включали два более распространённых структурных мотива, которые были открыты несколько позже. В следующем году Линус Полинг предсказал оба этих мотива, альфа-спираль[4] и бета-лист[5], в работе, которая теперь сравнивается по значимости[2] с публикацией Фрэнсиса Крика и Джеймса Д. Уотсона о двойной спирали ДНК[6]. Полинг очень критически относился к спиральным структурам, предложенным Брэггом, Кендрю и Перуцем, и заявлял, что все они неправдоподобны[2][4].
Статья Полинга и Кори поразила меня словно громом. В отличие от спиралей Кендрю и моей, их спирали были свободны от деформации; все амидные группы были плоскими, и каждая карбонильная группа образовывала идеальную водородную связь с каждым четвертым аминокислотным остатком, находящимся далее по цепочке. Строение выглядело совершенно правильно. Как я мог это пропустить?
— Макс Перуц, 1998г[2].
Позже в тот же день Перуцу пришла в голову идея провести эксперимент, чтобы подтвердить модель Полинга, и он бросился в лабораторию, чтобы осуществить её. В течение нескольких часов у него были доказательства, подтверждающие альфа-спираль, которую он первым делом показал Брэггу в понедельник[2]. Подтверждение Перуцем структуры альфа-спирали было опубликовано в журнале Nature вскоре после этого[7]. Принципы, применённые в статье 1950 года к теоретическим полипептидным структурам, относящимся к спирали 310, включали:[3]
- Цепи удерживаются вместе за счёт водородной связи между атомами водорода и кислорода различных соседних амидных (пептидных) звеньев, образующихся при конденсации аминокислот с образованием полипептидной цепи. Они образуют спиральные конструкции, которые невозможно распутать без разрыва водородных связей.
- Те структуры, в которых все доступные группы NH и CO связаны водородными связями, по своей природе более вероятны, потому что их свободная энергия предположительно ниже.
Структура спирали 310 была в конечном итоге подтверждена Кендрю в его структуре миоглобина 1958 года[8], а также была повторно обнаружена в 1960 году, когда Перуц определил структуру гемоглобина[9][10][11] и уточнена в последующих трудах над его деоксигенированной[12][13] и оксигенированной формами[14][14].
В настоящее время известно, что спираль является 310 четвёртым наиболее часто наблюдаемым типом после α-спиралей, β-листов и β-поворотов[англ.][1]. Это почти всегда короткие участки, почти 96 % которых содержат четыре или меньше аминокислотных остатков[15] :44, появляющиеся в таких местах, как «углы», где α-спирали меняют своё направление, например, в структуре миоглобина[8]. Более длинные участки, в диапазоне от семи до одиннадцати остатков, наблюдались в сегменте сенсора напряжения потенциал-управляемых калиевых каналов в трансмембранном домене некоторых спиральных белков[16].
Структура
[править | править код]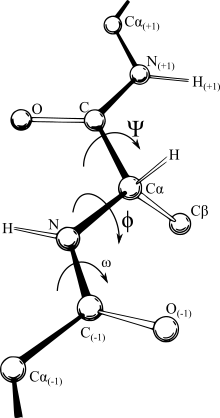
Аминокислоты в спирали 310 расположены в форме правозакрученной спиральной структуры. Каждая аминокислота соответствует повороту спирали на 120° (то есть спираль имеет три остатка на виток), сдвигу на 2,0 Å вдоль оси спирали, и имеет 10 атомов в кольце, образованном водородной связью[15]:44-45. Наиболее важно то, что группа NH аминокислоты образует водородную связь с группой C=O аминокислоты тремя остатками ранее; эта повторяющаяся i + 3 → i водородная связь определяет 310-спираль. Подобные структуры построения встречаются у α-спирали (i + 4 → i водородная связь) и Пи-спирали (i + 5 → i водородная связь)[1][15] :44–45.
Аминокислотные остатки в длинных 310-спиралях принимают (φ, ψ) двугранные углы около (−49°, −26°). Многие 310-спирали в белках короткие, поэтому отклоняются от этих значений. В более общем смысле, остатки в длинных 310-спиралях образуют двугранные углы, так что двугранный угол ψ одного остатка и двугранный угол φ следующего остатка в сумме составляют примерно −75°. Для сравнения, сумма двугранных углов для α-спирали составляет примерно −105°, а для π-спирали — примерно −125°[15]:44–45 .
Общая формула для угла поворота Ω на остаток любой полипептидной спирали с транс-изомерами даётся уравнением:[15] :40
и поскольку для идеальной 310-спирали Ω = 120°, отсюда следует, что φ и ψ должны быть связаны соотношением:
в соответствии с наблюдаемым значением φ + ψ около −75°[15] :44.
Значение двугранных углов в 310-спирали относительно углов α-спирали можно объяснить короткой длиной этой спирали — от 3 до 5 остатков в длину по сравнению 10-12 остатками у α-спирали. 310-спирали часто возникают в переходных участках молекул, что определяет их небольшой размер, и приводит к отклонениям в распределении углов кручения их основной цепи и, следовательно, к неравномерностям. Их сети водородных связей искажены по сравнению с α-спиралями, что способствует их нестабильности, хотя частое появление спирали 310 в природных белках демонстрирует их важность в переходных структурах[1][1].
Стабильность
[править | править код]Благодаря исследованиям, проведённым Мэри Карпен, Питером Де Хасетом и Кеннетом Нитом[17], были выявлены факторы стабильности в 310-спиралях. Спирали наиболее заметно стабилизируются остатком аспартата на неполярном N- конце, который взаимодействует с амидной группой на спиральном N- конце. Это электростатическое взаимодействие стабилизирует пептидные диполи в параллельной ориентации. Подобно непрерывным спиральным водородным связям, которые стабилизируют α-спирали, высокие уровни аспартата столь же важны для сохранности 310-спиралей. Высокая частота встречаемости аспартата как в 310-спирали, так и в α-спиралях указывает на его влияние в инициации и распространении спирали, но в то же время предполагает, что он способствует стабилизации 310-спирали, ингибируя распространение α-спиралей[17].
См. также
[править | править код]Примечания
[править | править код]- ↑ 1 2 3 4 5 Roger Armen, Darwin O.V. Alonso, Valerie Daggett. The role of α-, 3 10 -, and π-helix in helix→coil transitions (англ.) // Protein Science. — 2003-06. — Vol. 12, iss. 6. — P. 1145–1157. — doi:10.1110/ps.0240103.
- ↑ 1 2 3 4 5 David Eisenberg. The discovery of the α-helix and β-sheet, the principal structural features of proteins // Proceedings of the National Academy of Sciences. — 2003-09-09. — Т. 100, вып. 20. — С. 11207–11210. — ISSN 1091-6490 0027-8424, 1091-6490. — doi:10.1073/pnas.2034522100.
- ↑ 1 2 Polypeptide chain configurations in crystalline proteins (англ.) // Proceedings of the Royal Society of London. Series A. Mathematical and Physical Sciences. — 1950-10-10. — Vol. 203, iss. 1074. — P. 321–357. — ISSN 2053-9169 0080-4630, 2053-9169. — doi:10.1098/rspa.1950.0142. Архивировано 22 июля 2021 года.
- ↑ 1 2 Linus Pauling, Robert B. Corey, H. R. Branson. The structure of proteins: Two hydrogen-bonded helical configurations of the polypeptide chain (англ.) // Proceedings of the National Academy of Sciences. — 1951-04. — Vol. 37, iss. 4. — P. 205–211. — ISSN 1091-6490 0027-8424, 1091-6490. — doi:10.1073/pnas.37.4.205. Архивировано 3 сентября 2022 года.
- ↑ Linus Pauling, Robert B. Corey. The Pleated Sheet, A New Layer Configuration of Polypeptide Chains (англ.) // Proceedings of the National Academy of Sciences. — 1951-05. — Vol. 37, iss. 5. — P. 251–256. — ISSN 1091-6490 0027-8424, 1091-6490. — doi:10.1073/pnas.37.5.251.
- ↑ Watson, James D. (1953). "Molecular Structure of Nucleic Acids: A Structure for Deoxyribose Nucleic Acid". Nature. 171 (4356): 737—738. Bibcode:1953Natur.171..737W. doi:10.1038/171737a0. PMID 13054692.
- ↑ M. F. Perutz. New X-Ray Evidence on the Configuration of Polypeptide Chains: Polypeptide Chains in Poly-γ-benzyl-L-glutamate, Keratin and Hæmoglobin (англ.) // Nature. — 1951-06. — Vol. 167, iss. 4261. — P. 1053–1054. — ISSN 1476-4687 0028-0836, 1476-4687. — doi:10.1038/1671053a0. Архивировано 13 августа 2021 года.
- ↑ 1 2 J. C. Kendrew, G. Bodo, H. M. Dintzis, R. G. Parrish, H. Wyckoff. A Three-Dimensional Model of the Myoglobin Molecule Obtained by X-Ray Analysis (англ.) // Nature. — 1958-03-08. — Vol. 181, iss. 4610. — P. 662–666. — ISSN 1476-4687 0028-0836, 1476-4687. — doi:10.1038/181662a0. Архивировано 4 сентября 2022 года.
- ↑ M. F. Perutz, M. G. Rossmann, Ann F. Cullis, Hilary Muirhead, Georg Will. Structure of Hæmoglobin: A Three-Dimensional Fourier Synthesis at 5.5-Å. Resolution, Obtained by X-Ray Analysis (англ.) // Nature. — 1960-02. — Vol. 185, iss. 4711. — P. 416–422. — ISSN 1476-4687 0028-0836, 1476-4687. — doi:10.1038/185416a0. Архивировано 2 сентября 2022 года.
- ↑ M. F. Perutz. The Hemoglobin Molecule // Scientific American. — 1964-11. — Т. 211, вып. 5. — С. 64–76. — ISSN 0036-8733. — doi:10.1038/scientificamerican1164-64.
- ↑ Science is not a quiet life : unravelling the atomic mechanism of haemoglobin. — London [England]: Imperial College Press, 1997. — xxi, 636 pages с. — ISBN 981-02-2774-4, 978-981-02-2774-6, 981-02-3057-5, 978-981-02-3057-9.
- ↑ Hilary Muirhead, Joyce M. Cox, L. Mazzarella, M.F. Perutz. Structure and function of haemoglobin (англ.) // Journal of Molecular Biology. — 1967-08. — Vol. 28, iss. 1. — P. 117–150. — doi:10.1016/S0022-2836(67)80082-2. Архивировано 17 сентября 2020 года.
- ↑ W. Bolton, Joyce M. Cox, M.F. Perutz. Structure and function of haemoglobin (англ.) // Journal of Molecular Biology. — 1968-04. — Vol. 33, iss. 1. — P. 283–297. — doi:10.1016/0022-2836(68)90294-5. Архивировано 3 мая 2022 года.
- ↑ 1 2 M. F. Perutz, H. Muirhead, J. M. Cox, L. C. G. Goaman. Three-dimensional Fourier Synthesis of Horse Oxyhaemoglobin at 2.8 Å Resolution: The Atomic Model (англ.) // Nature. — 1968-07. — Vol. 219, iss. 5150. — P. 131–139. — ISSN 1476-4687 0028-0836, 1476-4687. — doi:10.1038/219131a0. Архивировано 3 сентября 2022 года.
- ↑ 1 2 3 4 5 6 Ulo Langel. Introduction to Peptides and Proteins.. — Hoboken: Taylor and Francis, 2009. — 1 online resource (440 pages) с. — ISBN 978-1-4398-8204-7, 1-4398-8204-5.
- ↑ Ricardo Simão Vieira-Pires, João Henrique Morais-Cabral. 310 helices in channels and other membrane proteins (англ.) // Journal of General Physiology. — 2010-12-01. — Vol. 136, iss. 6. — P. 585–592. — ISSN 0022-1295 1540-7748, 0022-1295. — doi:10.1085/jgp.201010508. Архивировано 3 сентября 2022 года.
- ↑ 1 2 Mary E. Karpen, Pieter L. De Haseth, Kenneth E. Neet. Differences in the amino acid distributions of 3 10 -helices and α -helices (англ.) // Protein Science. — 1992-10. — Vol. 1, iss. 10. — P. 1333–1342. — doi:10.1002/pro.5560011013. Архивировано 3 сентября 2022 года.
Эта статья входит в число добротных статей русскоязычного раздела Википедии. |