Эпимер (|hnbyj)
В стереохимии эпимер является одним из пары диастереомеров[1], имеющих несколько хиральных центров, но отличающихся конфигурацией только одного из них.[2] Все остальные хиральные центры в молекулах одинаковы. Эпимеризация — это взаимное превращение одного эпимера в другой.

|
| Сравнение доксорубицина и эпирубицина |
Примеры
[править | править код]Стереоизомеры β-D-глюкопиранозы и β-D-маннопиранозы являются эпимерами, поскольку они отличаются только стереохимической конфигурацией в положении C-2. Гидроксигруппа в β-D-глюкопиранозе является экваториальной (в «плоскости» кольца), в то время как в β-D-маннопиранозе гидроксильная группа у C-2 является аксиальной (вверху от «плоскости» кольца). Эти две молекулы являются эпимерами, но, поскольку они не являются зеркальным отражением друг друга, они не являются энантиомерами. (Энантиомеры имеют одинаковое название, но различаются по классификации D и L).
Они также не являются аномерами, поскольку это не аномерный углерод. Точно так же β-D-глюкопираноза и β-D-галактопираноза являются эпимерами, которые различаются стереохимической конфигурацией в положении C-4, где первый является экваториальным, а второй — аксиальным.

|

|
| β-D-глюкопираноза | β-D-маннопираноза |
Если отличие заключается в группах -ОН на С-1, аномерном углероде, например, в случае α-D-глюкопиранозы и β-D-глюкопиранозы, молекулы являются как эпимерами, так и аномерами (как показано обозначение α и β).[3]

|

|
| α-D-глюкопираноза | β-D-глюкопираноза |
Другими близкородственными соединениями являются эпи-инозитол и инозитол, а также липоксин и эпилипоксин.

|
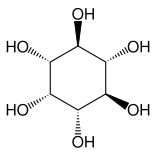
|

|
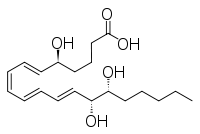
|
| эпи-инозитол | инозитол | липоксин | эпилипоксин |
Эпимеризация
[править | править код]Эпимеризация — это химический процесс, при котором эпимер превращается в его диастереомерный аналог.[4] Это может происходить в ходе реакций деполимеризации конденсированных дубильных веществ. Эпимеризация может быть спонтанной (обычно медленно) или катализируемой ферментами, например, эпимеризация между сахарами N-ацетилглюкозамином и N-ацетилманнозамином, которая катализируется ренин-связывающим белком .
Предпоследний этап классического синтеза эпибатидина от Zhang&Trudell является примером эпимеризации.[5] Фармацевтические примеры включают эпимеризацию эритроизомеров метилфенидата в фармакологически предпочтительные и низкоэнергетические треоизомеры и нежелательную эпимеризацию тезофензина in vivo в бразофензин.
Ссылки
[править | править код]- ↑ Clayden, Jonathan. Organic Chemistry / Jonathan Clayden, Nick Greeves, Stuart Warren. — 2nd. — Oxford University Press, 2012. — P. 1112.
- ↑ IUPAC. Compendium of Chemical Terminology, 2nd ed. (the «Gold Book»). Compiled by A. D. McNaught and A. Wilkinson. Blackwell Scientific Publications, Oxford (1997). Online version (2019-) created by S. J. Chalk. ISBN 0-9678550-9-8. https://doi.org/10.1351/goldbook.
- ↑ Structure of the glucose molecule. Дата обращения: 8 марта 2023. Архивировано 8 марта 2023 года.
- ↑ Clayden, Jonathan. Organic Chemistry / Jonathan Clayden, Nick Greeves, Stuart Warren. — 2nd. — Oxford University Press, 2012. — P. 1112.Clayden, Jonathan; Greeves, Nick; Warren, Stuart (2012). Organic Chemistry (2nd ed.). Oxford University Press. p. 1112.
- ↑ Zhang, Chunming (1996). "A Short and Efficient Total Synthesis of (±)-Epibatidine". The Journal of Organic Chemistry. 61 (20): 7189—7191. doi:10.1021/jo9608681. ISSN 0022-3263. PMID 11667626.