Чёрная субстанция (C~jugx vrQvmguenx)
| Чёрная субстанция | |
|---|---|
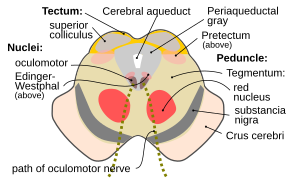 Поперечное сечение среднего мозга на уровне четверохолмия (точнее Superior colliculus). Отчётливо видны красные ядра (nuclei rubri), ядро глазодвигательного нерва (nucleus nervus oculomotorius), водопровод мозга (aqueductus cerebri) и околоводопроводная область, пунктиром отмечен путь глазодвигательного нерва (nervus oculomotorius). | |
 Расположение чёрной субстанции в головном мозге человека, показана красным цветом. | |
| Часть | Среднего мозга, базальные ганглии. |
| Система | Экстрапирамидная |
| Каталоги | |
Чёрная субстанция, также чёрное вещество (лат. Substantia nigra) — составная часть экстрапирамидной системы[1], находящаяся в области четверохолмия среднего мозга. Играет важную роль в регуляции моторной функции, тонуса мышц, осуществлении статокинетической функции участием во многих вегетативных функциях: дыхании, сердечной деятельности, тонусе кровеносных сосудов[2]. Впервые обнаружена французским анатомом и врачом Феликсом Вик-д'Азиром в 1784 году[3].
Несмотря на то, что чёрная субстанция представляет собой непрерывную полосу в срезах среднего мозга, анатомические исследования показали, что на самом деле она состоит из двух частей с очень различными связями и функциями: pars compacta (компактная часть) и pars reticulata (сетчатая часть). Данная классификация была впервые предложена Сано в 1910 году[4]. Pars compacta служит в основном в качестве приёмника сигналов — в цепи базальных ганглиев, поставляя дофамин полосатому телу. Pars reticulata служит в основном в качестве трансмиттера (передатчика), передавая сигналы от базальных ганглиев к другим многочисленным структурам головного мозга[5].
Анатомия
[править | править код]Представляет собой скопление нервных клеток. Расположена в дорсальной части ножки на границе с базальной частью среднего мозга. Substantia nigra простирается на всём протяжении ножки мозга от моста до промежуточного мозга. Люди имеют две Substantiae nigrae, по одной на каждую сторону (левую и правую), от средней линии мозга.

Клетки этой субстанции богаты одной из форм природного пигмента меланина — нейромеланином, который и придаёт ей характерный тёмный цвет. В чёрной субстанции различают дорсально расположенный компактный слой (pars compacta) и вентральный (pars reticulata) — сетчатый слой[6]. Pars compacta лежит медиальнее pars reticulata. Иногда упоминается и третий латеральный слой — pars lateralis, хотя его обычно классифицируют как часть pars reticulata. Pars reticulata и внутренняя часть бледного шара разделяются внутренней капсулой[7].
Нейроны substantia nigra получают многочисленные проекции от нервных клеток базальных ганглиев. В свою очередь они образуют синаптические связи с нейронами ретикулярных ядер ствола мозга и базальных ганглиев[8]. Нейроны, составляющие компактный отдел, имеют полихимическую природу. В ретикулярной части чёрной субстанции выявлено большое количество нейронов, содержащих ГАМК, в компактной части — дофамин. Кроме того, в чёрной субстанции имеются различные нейропептиды. Данная структура широко связана с различными отделами центральной нервной системы. Но особенно тесно чёрная субстанция функционально связана с базальными ганглиями (полосатое тело и бледный шар), а также анатомически — со зрительными буграми.
Чёрная субстанция, являясь филогенетически довольно древним образованием, имеет сложную структуру и обильное кровоснабжение, что говорит о высокой роли её компонентов в системе координации жизнедеятельности[9].
Pars reticulata
[править | править код]Pars reticulata имеет сильное сходство как структурное, так и функциональное с внутренней частью бледного шара. Нейроны бледного шара, как и в pars reticulata, в основном ГАМКергические.
Афферентные пути
[править | править код]Pars reticulata связана с полосатым телом. Связь представлена двумя путями, известными как прямой и косвенный (непрямой) пути. Прямой путь начинается от стриатума и идёт к сетчатой части чёрной субстанции и медиальному бледному шару. Он образован тормозными ГАМКергическими волокнами. Непрямой путь организован сложнее. Функция его заключается в подавлении возбуждающего влияния таламуса на другие отделы моторной коры. Первое звено этого пути — тормозные ГАМКергические проекции стриатума на латеральный бледный шар. Латеральный бледный шар посылает тормозные ГАМКергические волокна к субталамическому ядру. Выходы субталамического ядра представлены возбуждающими глутаматергическими волокнами — часть их возвращается к латеральному бледному шару, другие направляются к сетчатой части — pars reticulata чёрной субстанции и медиальному бледному шару[10]. Прямые и косвенные пути происходят из различных подмножеств клеток полосатого тела: они тесно перемешаны, в них расположены различные типы дофаминовых рецепторов, которые отличаются на нейрохимическом уровне.
Эфферентные пути
[править | править код]Существуют значительные проекции в таламусе (вентрально-латеральных и передних вентральных ядер), четверохолмии, хвостатых ядрах, происходящие из Pars reticulata (нигроталамические пути)[11], которые используют ГАМК в качестве нейротрансмиттера. Кроме того, эти нейроны образуют до пяти коллатералей, которые имеют ответвления как в pars compacta, так и в pars reticulata, вероятно, модулируя дофаминергическую активность в pars compacta[12].
Pars compacta
[править | править код]Pars compacta чёрной субстанции состоит из дофаминергических нейронов. Эти нейроны афферентные и связываются с другими структурами мозга: хвостатым ядром и скорлупой, которые входят в группу под названием полосатое тело. Такая связь позволяет высвобождать дофамин в указанных структурах.
Физиология
[править | править код]Чёрная субстанция играет важную роль, благодаря ей осуществляются функции: движения глаз, она регулирует и координирует мелкие и точные движения, в частности пальцев; координирует процессы жевания и глотания. Имеются данные о роли чёрной субстанции в регуляции многих вегетативных функций: дыхания, сердечной деятельности, тонуса кровеносных сосудов. Электростимуляция чёрной субстанции вызывает увеличение артериального давления, частоты сердечных сокращений, частоты дыхательных движений.
Чёрная субстанция является важнейшей составной частью дофаминергической системы награды. Она также играет очень большую роль в мотивации и эмоциональной регуляции материнского поведения[13]:141.
Pars reticulata
[править | править код]Pars reticulata чёрной субстанции является важным процессовым центром в базальных ганглиях. ГАМКергические нейроны в Pars reticulata передают окончательные обработанные сигналы базальных ганглиев в таламус и четверохолмие. Кроме того, Pars reticulata ингибирует дофаминергическую активность в Pars compacta через коллатерали аксонов, хотя функциональная организация этих связей остается неясной.
Pars compacta
[править | править код]Наиболее известная функции Pars compacta — управление движениями[14], однако роль чёрной субстанции в управлении движениями тела является косвенной; электрическая стимуляция этой области чёрной субстанции не приводит к возникновению движений тела. Также это ядро отвечает за обеспечение синтеза дофамина, который поставляется другим структурам головного мозга посредством дофаминергических нейронов. Функция дофаминовых нейронов в Pars compacta чёрной субстанции является сложной.
Патологическая физиология
[править | править код]Чёрная субстанция играет весьма значимую роль в развитии многих заболеваний, включая болезнь Паркинсона. В чёрной субстанции расположены тела нейронов, аксоны которых, составляющие нигростриарный путь, проходят через ножки мозга, внутреннюю капсулу и оканчиваются в неостриатуме в виде широкого сплетения терминальных микровезикул с высоким содержанием дофамина. Именно этот путь является тем местом в мозге, поражение которого приводит к формированию синдрома паркинсонизма[15].
Болезнь Паркинсона
[править | править код]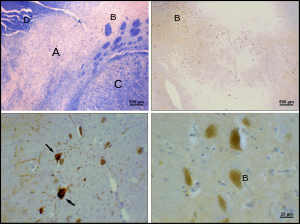
Болезнь Паркинсона является нейродегенеративным заболеванием, характеризующимся гибелью дофаминергических нейронов в pars compacta чёрной субстанции, причины, которой до сих пор неизвестны. Для болезни Паркинсона характерны двигательные нарушения: тремор, гипокинезия, мышечная ригидность, постуральная неустойчивость, а также вегетативные и психические расстройства[16] — результат снижения тормозящего влияния бледного шара (globus pallidus), расположенного в переднем отделе головного мозга, на полосатое тело (striatum). Повреждение нейронов паллидума приводит к «торможению торможения» периферических двигательных нейронов[16] (мотонейронов спинного мозга). На данный момент болезнь неизлечима, однако существующие методы консервативного и оперативного лечения позволяют значительно улучшить качество жизни больных[16]. С помощью позитронно-эмиссионной томографии доказано, что темпы дегенерации нейронов чёрной субстанции при болезни Паркинсона намного выше, чем при нормальном старении[17].
Шизофрения
[править | править код]Известно, что повышение уровня дофамина участвует в развитии шизофрении. Однако большая дискуссия продолжается и по сей день вокруг этой теории, которая широко известна как «дофаминовая теория шизофрении». Несмотря на разногласия, антагонисты дофамина остаются стандартными средствами лечения шизофрении. Эти антагонисты включают препараты первого поколения (типичные) антипсихотики, такие как производные бутирофенона, фенотиазина и тиоксантена. Эти препараты были в значительной степени заменены препаратами второго поколения (атипичными нейролептиками), такими как клозапин и рисперидон. Следует отметить, что эти препараты вообще не действуют на дофамин-продуцирующие нейроны, также и на рецепторы постсинаптических нейронов.
Другие, немедикаментозные доказательства в поддержку гипотезы дофамина, связанные с чёрной субстанцией, включают структурные изменения в pars compacta, такие как сокращение размеров синаптических окончаний. Другие изменения в чёрной субстанции включают повышенную экспрессию NMDA-рецепторов в структуре и снижение экспрессии дисбиндина. Дисбиндин, который был (спорно) связан с шизофренией, может регулировать высвобождение дофамина, и показатель низкой экспрессией дисбиндина в чёрной субстанции может иметь важное значение в этиологии шизофрении.
С угнетением дофаминергической передачи в нигростриарной системе (блокадой дофаминовых Д2-рецепторов[18]) при использовании нейролептиков связывают развитие экстрапирамидных побочных эффектов[19]: паркинсонизма, дистонии, акатизии, поздней дискинезии и др.

Различные независимые исследования показали, что многие лица, страдающие шизофренией, имеют повышенный поток дофамина и серотонина, поступающего в постсинаптические нейроны мозга.[20][21][22][23] Эти нейромедиаторы являются частью так называемой «системы вознаграждения» и вырабатываются в больших количествах во время позитивного по представлению пациента опыта типа секса, наркотиков, алкоголя, вкусной еды, а также стимуляторов ассоциированных с ними.[24] Нейробиологические эксперименты показали, что даже воспоминания о позитивном опыте могут увеличить уровень дофамина[25][26][27], поэтому данный нейромедиатор используется мозгом для оценки и мотивации, закрепляя важные для выживания и продолжения рода действия.[28] Например, мозг лабораторных мышей вырабатывал дофамин уже даже во время предвкушения ожидаемого удовольствия.[29] Однако некоторые пациенты умышленно перенапрягают эту систему вознаграждения, искусственно вызывая приятные для них воспоминания и мысли снова и снова, поскольку таким образом натурально производятся нейромедиаторы хорошего настроения, теряя при этом самоконтроль.[23] Это похоже на наркотическую зависимость,[30] ведь практически все наркотики прямо или косвенно нацелены на систему вознаграждения мозга и насыщают его структуры дофамином[31][32]. Если пациент продолжает перестимулировать свою систему вознаграждения, то постепенно мозг адаптируется к чрезмерному потоку дофамина, производя меньше гормона и уменьшая количество рецепторов в системе вознаграждения[33]. В результате химическое воздействие на мозг уменьшается, понижая способность пациента наслаждаться вещами, от которых он раньше получал удовольствие[32]. Это понижение заставляет пациента, зависимого от дофамина, усиливать свою «мыслительную деятельность» пытаясь привести уровень нейромедиаторов в нормальное для него состояние[23] — этот эффект известен в фармакологии как толерантность. Дальнейшее привыкание может постепенно привести к очень тяжелым изменениям в нейронах и других структурах мозга, и потенциально может в долговременной перспективе нанести серьёзный ущерб здоровью мозга[34]. Современные антипсихотические препараты нацелены на блокировку функций дофамина. Но, к сожалению, эта блокировка иногда также вызывает и приступы депрессии, что может усилить зависимое поведение пациента[35]. Когнитивно-поведенческая психотерапия (КПТ), проводимая профессиональным психологом, также может помочь пациентам эффективно контролировать свои настойчивые мысли, поднять самооценку, понять причины депрессии и объяснить им долговременные негативные последствия дофаминовой зависимости[36][37]. «Дофаминовая теория» шизофрении стала очень популярной в психиатрии в связи с эффективностью атипичных антипсихотиков, блокирующих нейромедиаторы, однако многие психологи не поддерживают эту теорию, считая её «упрощенной», также существует несколько различных течений внутри сторонников теории[20].
Повреждения чёрной субстанции
[править | править код]Так при перерезке билатеральных путей, идущих из чёрной субстанции в стриатум, вызывают у животных неподвижность, отказ от еды и питья, отсутствие ответов на раздражение из внешнего мира. Повреждение чёрной субстанции человека, приводит к произвольным движениям головы и рук, когда больной сидит спокойно (болезнь Паркинсона)[38]. Нередко, возникает т. н. экстрапирамидный синдром — проявление дисфункции экстрапирамидной (стриопаллидарной) системы в виде:
- мышечной гипертонии,
- гипокинезии (олигокинезии), то есть уменьшением двигательной инициативы и затруднениями при переходе из состояния покоя в состояние движения и наоборот,
- брадикинезии, замедлением движений и уменьшением их амплитуды,
- преобладанием сгибательной позы (согнутая спина, наклонённая к груди голова, согнутые в локтях и лучезапястных суставах руки и в коленях — ноги),
- гипомимией,
- монотонной, тихой и глухой речью,
- отсутствием содружественных движений,
- гиперкинезами (тремор, торсионный спазм, атетоз, хорея, миоклонии, локализованный спазм).
При этом некоторые гиперкинезы (хореические) связаны с мышечной гипотонией[39].
Химические воздействия на чёрную субстанцию
[править | править код]
Химические воздействия и изменения чёрной субстанции, происходящие на молекулярном уровне, играют важную роль в таких областях медицины, как нейрофармакология и токсикология. Различные соединения, такие как леводопа и МФТП (метилфенилтетрагидропиридин), используются для лечения и изучения болезни Паркинсона, а также многие другие препараты оказывают влияние на substantia nigra.
Леводопа
[править | править код]
Чёрная субстанция является главной целью химической терапии при лечении болезни Паркинсона. Леводопа (L-ДОФА), предшественник дофамина, является наиболее часто назначаемым противопаркинсоничесим препаратом. Особенно эффективна леводопа в лечении пациентов на ранних стадиях болезни Паркинсона, хотя препарат не теряет своей эффективности с течением времени[40]. Благодаря прохождению через ГЭБ, леводопа повышает уровень необходимого дофамина в чёрной субстанции, таким образом облегчая симптомы болезни Паркинсона. Недостатком лечения леводопы является то, что она устраняет симптомы болезни Паркинсона, при котором регистрируется низкий уровень дофамина, а не причину — смерть дофаминергических нейронов чёрной субстанции.
МФТП
[править | править код]
МФТП (метилфенилтетрагидропиридин) — является нейротоксином, действующим на дофаминергические клетки головного мозга (имеет высокое сродство к дофаминовому транспортёру (DAT)[41]), в частности, в чёрной субстанции. МФТП стал широко известен в 1982 году, когда у небольшой группы людей из округа Санты-Клары (Калифорния, США) был диагностирован паркинсонизм после использования метилфенилпропиноксипиридина (МФПП), загрязненного МФТП. Нейротоксичность МФТП объясняется нарушением обмена веществ в митохондриях дофаминергических нейронов, в результате которого образуются свободные радикалы[42].
В 1984 году Лэнгстоном (Langston) и сотрудниками были проведены опыты, доказывающие прямое влияние МФТП на блокаду образования дофамина, приводящее к болезни Паркинсона. В настоящее время это вещество используется для моделирования болезни Паркинсона с целью её изучения и возможного лечения в лаборатории. Опыты на мышах показали, что восприимчивость к МФТП увеличивается с возрастом[43].
Кокаин
[править | править код]
Механизм действия кокаина в мозгу человека включает в себя ингибирование обратного захвата дофамина и блокаду дофаминового транспортёра DAT, приводящий к состоянию эйфории и психической зависимости. У лабораторных животных после однократного введения кокаина плотность дофаминовых рецепторов на постсинаптической мембране возрастала в среднем на 37 %, при повторном введении плотность рецепторов продолжала увеличиваться. В связи с постепенным нарастанием тяжести нарушения обмена дофамина при употреблении кокаина могут развиваться специфические психозы, по клиническому течению напоминающие шизофрению. Тем не менее кокаин является более активным в дофаминергических нейронах вентральной части покрышки, нежели чем в чёрной субстанции.
Инактивация чёрной субстанции может оказаться возможной для лечения кокаиновой зависимости. В исследованиях кокаиновой зависимости у крыс инактивация чёрной субстанции проводилась с помощью имплантированных канюль, позволила значительно сократить рецидивы[44].
Амфетамины
[править | править код]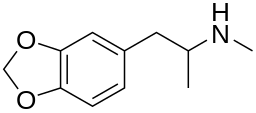
Как и кокаин, амфетамины увеличивают концентрацию дофамина в синаптической щели, тем самым усиливая реакцию постсинаптических нейронов. Кроме того, как и кокаин, вызывают нарушения функций дофамина, что способствует привыканию.
Исследования показали, что в некоторых областях мозга амфетамин и так называемые трейс или следовые амины увеличивают концентрации дофамина в синаптической щели, тем самым повышая реакцию постсинаптического нейрона. Различные механизмы, с помощью которых амфетамин и следовые амины влияют на концентрации дофамина, были широко изучены и, как известно, включают переносчик дофамина DAT и везикулярный транспортёр моноаминов 2 типа VMAT2[45][46][47]. Молекула амфетамина похожа по структуре на дофамин и следовые амины; как следствие, он может проникать в пресинаптический нейрон посредством DAT, а также напрямую проникать через нейрональную мембрану[45]. При введении в пресинаптический нейрон амфетамин и следовые амины, происходит активация TAAR1, который посредством передачи сигналов протеинкиназы индуцирует отток дофамина, интернализацию DAT, зависящую от фосфорилирования, и неконкурентное ингибирование обратного захвата[45][48]. Из-за структурного сходства между амфетамином и следовыми аминами он также является субстратом для транспортёров моноаминов; как следствие, он (конкурентно) ингибирует обратный захват дофамина и других моноаминов, конкурируя с ними за поглощение[45].
Примечания
[править | править код]- ↑ Большая советская энциклопедия. Дата обращения: 27 июля 2022. Архивировано 4 сентября 2019 года.
- ↑ Худайбердиев, Х. Х. Нейрохирургическая анатомия чёрного вещества головного мозга: автореф. дисс. … канд. мед наук / Х. Х. Худайбердиев. — Ленинград, 1970. — 15 стр
- ↑ Tubbs R. S., Loukas M., Shoja M. M., Mortazavi M. M., Cohen-Gadol A. A. Félix Vicq d'Azyr (1746-1794): early founder of neuroanatomy and royal French physician (англ.) // Childs Nerv Syst : journal. — 2011. — July (vol. 27, no. 7). — P. 1031—1034. — doi:10.1007/s00381-011-1424-y. — PMID 21445631.
- ↑ Sano, T. Beitrag zur vergleichenden Anatomie der Substantia nigra, des Corpus Luysii und der Zona incerta (нем.) // Mschr Psychiat Neurol : magazin. — 1910. — Bd. 28, Nr. 1. — S. 26—34. — doi:10.1159/000209678.
- ↑ Bolam, J. P.; Brown, M. T. C.; Moss, J.; Magill, P. J. (2009-01-01), Squire, Larry R. (ed.), "Basal Ganglia: Internal Organization", Encyclopedia of Neuroscience (англ.), Oxford: Academic Press, pp. 97—104, doi:10.1016/b978-008045046-9.01294-8, ISBN 978-0-08-045046-9, Архивировано 22 марта 2012, Дата обращения: 7 сентября 2020
- ↑ АНАТОМИЯ ГОЛОВНОГО МОЗГА ЛЕКЦИЯ 4. СРЕДНИЙ МОЗГ (mesencephalon ). Дата обращения: 15 августа 2013. Архивировано 22 октября 2013 года.
- ↑ Globus pallidus – an overview | ScienceDirect Topics (англ.). www.sciencedirect.com. Дата обращения: 12 июня 2018. (недоступная ссылка)
- ↑ Черная субстанция - Большая Энциклопедия Нефти и Газа, статья. Дата обращения: 17 марта 2013. Архивировано 4 марта 2016 года.
- ↑ ОСОБЕННОСТИ МОРФОЛОГИИ ЧЕРНОЙ СУБСТАНЦИИ СРЕДНЕГО МОЗГА КРЫС. Дата обращения: 19 марта 2013. (недоступная ссылка)
- ↑ Nauta, Haring J. W.; Cole, Monroe. Efferent projections of the subthalamic nucleus: An autoradiographic study in monkey and cat (англ.) // The Journal of Comparative Neurology[англ.] : journal. — 1978. — Vol. 180, no. 1. — P. 1—16. — doi:10.1002/cne.901800102. — PMID 418083.[нужен лучший источник]
- ↑ Carpenter, Malcolm B.; Nakano, Katsuma; Kim, Ronald. Nigrothalamic projections in the monkey demonstrated by autoradiographic technics (англ.) // The Journal of Comparative Neurology[англ.] : journal. — 1976. — Vol. 165, no. 4. — P. 401—415. — doi:10.1002/cne.901650402. — PMID 57125.
- ↑ Deniau, J.M.; Kitai, S.T.; Donoghue, J.P.; Grofova, I. Neuronal interactions in the substantia nigra pars reticulata through axon collaterals of the projection neurons (англ.) // Experimental Brain Research[англ.] : journal. — 1982. — Vol. 47. — doi:10.1007/BF00235891.
- ↑ Марков А. Эволюция человека. Книга 2. Обезьяны, нейроны и душа. — Corpus, 2011. — Т. 2. — 512 с. — (Династия). — 5000 экз. — ISBN 978-5-271-36294-1, 978-5-17-078089-1, 978-5-17-078089-1.
- ↑ Hodge, Gordon K.; Butcher, Larry L. Pars compacta of the substantia nigra modulates motor activity but is not involved importantly in regulating food and water intake (англ.) // Naunyn-Schmiedeberg's Archives of Pharmacology[англ.] : journal. — 1980. — Vol. 313, no. 1. — P. 51—67. — doi:10.1007/BF00505805. — PMID 7207636.
- ↑ Биохимия нигро-стриарной системы. Черная субстанция при паркинсонизме. Дата обращения: 19 марта 2013. Архивировано из оригинала 17 января 2013 года.
- ↑ 1 2 3 Яхно Н. Н., Штульман Д. Р. Болезни нервной системы. — М.: Медицина, 2001. — Т. 2. — С. 76-95. — 744 с. — ISBN 5-225-04540-5
- ↑ Яхно Н. Н., Штульман Д. Р. Болезни нервной системы. — М.: Медицина, 2001. — Т. 2. — С. 76-95. — 744 с.
- ↑ Малин Д. И., Козырев В. В., Равилов Р. С. Экстрапирамидные побочные эффекты нейролептиков: классификация и современные способы коррекции // Психиатрия и психофармакотерапия. — 2001. — Вып. 3 (6). Архивировано 8 декабря 2012 года.
- ↑ Справочное руководство по психофармакологическим и противоэпилептическим препаратам, разрешенным к применению в России / Под ред. С. Н. Мосолова. — 2-е, перераб. — М.: «Издательство БИНОМ», 2004. — С. 17. — 304 с. — 7000 экз. — ISBN 5-9518-0093-5.
- ↑ 1 2 The Dopamine Hypothesis of Schizophrenia: Version III—The Final Common Pathway. Дата обращения: 18 марта 2013. Архивировано из оригинала 7 апреля 2010 года.
- ↑ Increased Striatal Dopamine Transmission in Schizophrenia: Confirmation in a Second Cohort. Архивировано 23 августа 2011 года.
- ↑ Presynaptic Regulation of Dopamine Transmission in Schizophrenia. Дата обращения: 18 марта 2013. Архивировано 23 августа 2011 года.
- ↑ 1 2 3 Dysconnection in Schizophrenia: From Abnormal Synaptic Plasticity to Failures of Self-monitoring. Дата обращения: 18 марта 2013. Архивировано из оригинала 13 августа 2010 года.
- ↑ Ваш мозг во время секса. Дата обращения: 18 марта 2013. Архивировано из оригинала 29 марта 2013 года.
- ↑ Удовольствие: дофамин. Дата обращения: 18 марта 2013. Архивировано из оригинала 8 мая 2013 года.
- ↑ It's all about dopamine. Дата обращения: 18 марта 2013. Архивировано из оригинала 9 марта 2013 года.
- ↑ Placebo and Nocebo Effects Are Defined by Opposite Opioid and Dopaminergic Responses. Дата обращения: 18 марта 2013. Архивировано из оригинала 4 апреля 2012 года.
- ↑ Dopamine and desire. Дата обращения: 18 марта 2013. Архивировано из оригинала 12 февраля 2013 года.
- ↑ Кокаиновые наркоманы могут получать удовольствие только от одного ожидания этого удовольствия. Дата обращения: 18 марта 2013. Архивировано из оригинала 26 марта 2013 года.
- ↑ Dopamine supersensitivity correlates with D2High states, implying many paths to psychosis. Дата обращения: 18 марта 2013. Архивировано из оригинала 24 сентября 2015 года.
- ↑ Мозг и наркотики. Дата обращения: 18 марта 2013. Архивировано из оригинала 9 февраля 2015 года.
- ↑ 1 2 Understanding Drug Abuse and Addiction. Дата обращения: 18 марта 2013. Архивировано из оригинала 22 декабря 2011 года.
- ↑ Addiction and Dopamine (D2) Receptor Levels (2006). Дата обращения: 18 марта 2013. Архивировано из оригинала 30 мая 2013 года.
- ↑ The Science Behind Drug Use and Addiction. Дата обращения: 18 марта 2013. Архивировано из оригинала 2 декабря 2010 года.
- ↑ Dopamine. Дата обращения: 18 марта 2013. Архивировано из оригинала 31 июля 2013 года.
- ↑ Cognitive Behavior Therapy for Schizophrenia. Дата обращения: 18 марта 2013. Архивировано из оригинала 12 июня 2011 года.
- ↑ Cognitive Behavioural Therapy for OCD. Дата обращения: 18 марта 2013. Архивировано из оригинала 10 июня 2011 года.
- ↑ Средний мозг - Строение и органы центральной нервной системы - Биология - BiologyGuide.ru. Дата обращения: 27 марта 2013. Архивировано из оригинала 10 июня 2015 года.
- ↑ Экстрапирамидный синдром. Дата обращения: 27 марта 2013. Архивировано из оригинала 4 марта 2016 года.
- ↑ Rascol, Olivier; Payoux, Pierre; Ory, Fabienne; Ferreira, Joaquim J.; Brefel-Courbon, Christine; Montastruc, Jean-Louis. Limitations of current Parkinson's disease therapy (англ.) // Annals of Neurology[англ.] : journal. — 2003. — Vol. 53. — P. S3—12; discussion S12—5. — doi:10.1002/ana.10513. — PMID 12666094.
- ↑ А.П.Ашмарин. Нейрохимия:учебник для биологических и медицинских вузов / Под ред. акад. РАМН А.П.Ашмарина и проф.П.В.Стукалова. — М.: Издательство Института биомедицинской химии РАМН, 1996. — 470 с. — ISBN 5-900760-02-2.
- ↑ Schmidt, N; Ferger, B (2001). «Neurochemical findings in the MPTP model of Parkinson’s disease». J Neural Transm 108 (11): 1263-82. doi:10.1007/s007020100004. PMID 11768626.
- ↑ Jackson-Lewis, V.; Przedborski, S. Protocol for the MPTP Mouse Model of Parkinson’s Disease (англ.) // Nature Protocols[англ.] : journal. — 2007. — Vol. 2, no. 1. — P. 141—151. — doi:10.1038/nprot.2006.342. — PMID 17401348. Архивировано 14 июня 2017 года.
- ↑ See, R. E.; Elliott, J. C.; Feltenstein, M. W. The role of dorsal vs ventral striatal pathways in cocaine-seeking behavior after prolonged abstinence in rats (англ.) // Psychopharmacology[англ.] : journal. — Springer, 2007. — Vol. 194, no. 3. — P. 321—331. — doi:10.1007/s00213-007-0850-8. — PMID 17589830.
- ↑ 1 2 3 4 Miller, Gregory M. The emerging role of trace amine-associated receptor 1 in the functional regulation of monoamine transporters and dopaminergic activity (англ.) // Journal of Neurochemistry[англ.] : journal. — 2011. — Vol. 116, no. 2. — P. 164—176. — doi:10.1111/j.1471-4159.2010.07109.x. — PMID 21073468. — PMC 3005101.
- ↑ Amphetamine. DrugBank. University of Alberta (8 февраля 2013). Дата обращения: 13 октября 2013. Архивировано 12 октября 2013 года.
- ↑ Eiden, Lee E.; Weihe, Eberhard. VMAT2: A dynamic regulator of brain monoaminergic neuronal function interacting with drugs of abuse (англ.) // Annals of the New York Academy of Sciences[англ.] : journal. — 2011. — Vol. 1216. — P. 86—98. — doi:10.1111/j.1749-6632.2010.05906.x. — PMID 21272013. — PMC 4183197.
- ↑ Maguire, J. J.; Parker, W. A. E.; Foord, S. M.; Bonner, T. I.; Neubig, R. R.; Davenport, A. P. International Union of Pharmacology. LXXII. Recommendations for Trace Amine Receptor Nomenclature (англ.) // Pharmacological Reviews[англ.] : journal. — 2009. — Vol. 61, no. 1. — P. 1—8. — doi:10.1124/pr.109.001107. — PMID 19325074. — PMC 2830119.