Химические индикаторы (}nbncyvtny nu;ntgmkjd)
Индика́тор (лат. indicator — указатель) — соединение, позволяющее визуализировать изменение концентрации какого-либо вещества или компонента, например, в растворе при титровании, или быстро определить pH, еН и другие параметры.
История открытия
[править | править код]Кислотно-основные индикаторы применяются для установления между кислотами и основаниями, или других реакций, если в них участвуют ионы Н+, а также для химического определения рН водных растворов. Причина изменения цвета индикатора в том, что присоединение или отдача протонов его молекулами связаны с заменой одних хромофорных групп другими или с появлением новых хромофорных соединений.
Вероятно, самым древним кислотно-основным индикатором является лакмус. Лакмус был известен уже в Древнем Египте и Древнем Риме. Лакмус (от гол. lakmoes) — красящее вещество, добываемое из некоторых видов лишайников. Фактически природный лакмус представляет собой сложную смесь. Его основными компонентами являются: азолитмин (C9H10NO5) и эритролитмин (С13H22O6). Лакмус в древности использовали в качестве фиолетовой краски, но со временем рецепт его приготовления был утерян. В 1640 ботаники описали гелиотроп (Heliotropium Turnesole) — душистое растение с тёмно-лиловыми цветками, из которого было выделено красящее вещество. Этот краситель, наряду с соком фиалок, стал широко применяться химиками в качестве индикатора, который в кислой среде был красным, а в щелочной — синим.
В 1667 году знаменитый химик и физик Роберт Бойль предложил пропитывать фильтровальную бумагу отваром тропического лишайника — лакмуса, а также отварами фиалок и васильков, и таким образом положил начало применению индикаторной (лакмусовой) бумаги.
Применение индикаторов
[править | править код]Индикаторы позволяют быстро и достаточно точно контролировать состав жидких или газообразных сред, следить за изменением их состава, или за протеканием химической реакции. Индикаторы, удовлетворяющие ряду требований (высокое светопоглощение индикатора; контрастный переход окраски; узкая область перехода окраски), применяются для фиксирования конца титрования[1].
Широко используются кислотно-основные индикаторы, разбавленные растворы которых обладают способностью заметно изменять цвет, в зависимости от кислотности раствора[2]. Причина изменения цвета — изменения в строении молекул индикатора в кислой и щелочной среде, что приводит к изменению спектра поглощения раствора.
Для определения состава газовых сред используют индикаторные бумажки и индикаторные трубки.
Структура молекул и цвет индикаторов
[править | править код]Трифенилметановые красители-индикаторы
[править | править код]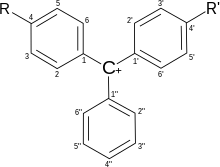
Трифенилметановые красители широко используются в качестве индикаторов. В зависимости от типа заместителей изменения структуры молекулы приводят к широкой гамме цветных соединений, большинство из которых могут служить химическими индикаторами.
| Название \ Положение | 2" | 2 | 3 | 4 | 5 | 2' | 3' | 4' | 5' |
|---|---|---|---|---|---|---|---|---|---|
| Бромтимоловый синий | SO3− | Br | Br | Oh | MeEt | Me | Br | OH | MeEt |
| Бромфеноловый синий | SO3− | H | Br | OH | Br | H | Br | OH | Br |
| Бромкрезоловый зелёный | SO3− | Me | Br | OH | Br | Me | Br | OH | Br |
| Крезоловый красный | SO3− | H | Me | OH | H | H | Me | OH | H |
| Фенолфталеин | CO2− | H | H | OH | H | H | H | OH | H |
| Тимолфталеин | CO2− | Me | H | OH | MeEt | Me | H | OH | MeEt |
| Малахитовый зелёный | H | H | H | NMe2 | H | H | H | NMe2 | H |
Производные азобензола
[править | править код]
.
Виды индикаторов
[править | править код]- Кислотно-основные индикаторы
- Редокс-индикаторы, Ох- и Red-формы которых имеют различный цвет
- Металлоиндикаторы
- Адсорбционные индикаторы
Распространённые кислотно-основные индикаторы
[править | править код]| Индикатор | Окраска/кислая форма | Окраска/щелочная форма | Интервалы pH |
|---|---|---|---|
| Ализариновый жёлтый | жёлтый | фиолетовый | 10,1—12,1 |
| Тимолфталеин | бесцветный | синий | 9,4—10,6 |
| Фенолфталеин | бесцветный | малиновый | 8,2—10,0 |
| Крезоловый красный | жёлтый | тёмно-красный | 7,0—8,8 |
| Нейтральный красный | красный | коричневый | 6,8—8,0 |
| Феноловый красный | жёлтый | красный | 6,8—8,0 |
| Бромтимоловый синий | жёлтый | синий | 6,0—7,6 |
| Лакмус (азолитмин) | красный | синий | 5,0—8,0 |
| Метиловый красный | красный | жёлтый | 4,4—6,2 |
| Метиловый оранжевый | красный | жёлтый | 3,0—4,4 |
| Бромфеноловый синий | красный | синий | 3,0—4,6 |
| Тропеолин 00… | - | жёлтый | 1,4—3,2 |
Металлоиндикаторы
[править | править код]Окислительно-восстановительные индикаторы
[править | править код]Окислительно-восстановительные индикаторы изменяют цвет в зависимости от присутствия в растворе окислителей или восстановителей. Дифениламин бесцветен в восстановленной форме, но имеет фиолетовый цвет в окисленном состоянии. Метиленовый синий (синька) также бесцветен в восстановленной форме и имеет синий цвет в окисленном состоянии.
Некоторые ярко окрашенные вещества сами могут служить индикатором. Например, при перманганатометрическом определении железа(II)
10FeSO4 + 2KMnO4+ 8H2SO4 = 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O
добавляемый в ходе титрования раствор перманганата обесцвечивается, пока не будут окислены все ионы Fe2+, имевшиеся в исследуемом растворе. Точка эквивалентности определяется по розовой окраске раствора, из-за возникшего избытка перманганат-анионов.
Хингидрон также является окислительно-восстановительным индикатором. Это смесь хинона и гидрохинона.
Адсорбционные индикаторы
[править | править код]Термоиндикаторы
[править | править код]В качестве термоиндикатора можно использовать бумагу, смоченную хлоридом кобальта(II). При нагревании кристаллогидрат теряет связанную воду и меняет последовательно цвет с розового через красный, фиолетовый и синий на бесцветный.
Химические индикаторы влажности
[править | править код]Растительные пигменты
[править | править код]Пигменты — органические соединения, присутствующие в клетках и тканях растений и окрашивающие их. Расположены пигменты в хлоропластах и хромопластах.
В растительном мире известно около 2 тысяч пигментов. Наиболее стойкими являются 150. Некоторые из них представлены в таблице. Накапливаются пигменты главным образом в корнях, цветках, кожуре плодов и в листьях растений.
Общее название растительных пигментов — биофлавоноиды. Это фенольные соединения, продукты жизнедеятельности растений. Большинство хорошо растворимы в воде, не растворимы в этиловом эфире, хлороформе и бензоле. Особенно богаты ими листья чая, цветы и листья гречихи, софоры японской, плоды цитрусовых, шиповника и черноплодной рябины (эти растения служат сырьём для производства медицинских препаратов). Значительные количества содержатся также в красном перце, чёрной смородине, землянике, малине, вишне, облепихе, некоторых сортах яблок, слив и винограда. Многие биофлавоноиды придают окраску цветам и плодам растений.
Все пигменты можно разделить на три группы — хлорофиллы, каротиноиды, антоцианы.
Хлорофилл определяет зелёную окраску листьев. Без этого изумрудного пигмента невозможна жизнь на планете, так как он осуществляет фотосинтез. Спутниками хлорофилла являются каротиноиды, которые определяют жёлтое, оранжевое и красное окрашивание. Так, жёлтые зерна кукурузы, оранжевая кожура мандарина, красные плоды шиповника своей окраской обязаны каротиноидам. Третья группа пигментов — антоцианы, которые определяют практически все краски растений — от оранжевой и красной до синей. Особый интерес представляют пигменты третьей группы — антоцианы, которые обладают хорошими индикаторными свойствами.
Этот раздел статьи ещё не написан. |
См. также
[править | править код]Примечания
[править | править код]- ↑ Основы аналитической химии, 2004.
- ↑ Индикатор // Казахстан. Национальная энциклопедия. — Алматы: Қазақ энциклопедиясы, 2005. — Т. II. — ISBN 9965-9746-3-2. (CC BY-SA 3.0)
Литература
[править | править код]- Основы аналитической химии / под ред. Ю. А. Золотова. — 3-е , перераб. и доп. — М.: Высш. шк., 2004. — Т. 2. — 503 с. — (Классический университетский учебник).