Тиоцианат свинца(II) (Mnkengugm vfnueg(II))
Перейти к навигации
Перейти к поиску
| Тиоцианат свинца(II) | |
|---|---|
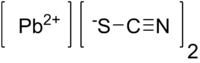 | |
| Общие | |
| Систематическое наименование |
Тиоцианат свинца(II) |
| Традиционные названия | Тиоциановокислый свинец; роданистый свинец; роданид свинца |
| Хим. формула | Pb(SCN)2 |
| Физические свойства | |
| Состояние | белые кристаллы |
| Молярная масса | 323,36 г/моль |
| Плотность | 3,82; 4,082; 4,1 г/см³ |
| Термические свойства | |
| Температура | |
| • разложения | 190 °C |
| Химические свойства | |
| Растворимость | |
| • в воде | 0,0520 г/100 мл |
| Классификация | |
| Рег. номер CAS | 592-87-0 |
| PubChem | 11616 и 516874 |
| Рег. номер EINECS | 209-774-6 |
| SMILES | |
| InChI | |
| ChemSpider | 21501026 и 11127 |
| Безопасность | |
| Предельная концентрация | 0,01 мг/м³ |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Тиоциана́т свинца́(II) — неорганическое соединение, соль свинца и роданистоводородной кислоты с формулой Pb(SCN)2, белые кристаллы, не растворяется в воде.
Получение
[править | править код]- Обменная реакция холодных растворов тиоцианата калия (или тиоцианата натрия, тиоцианата аммония) и нитрата свинца(II) (или ацетата свинца(II)):
- Осадок отфильтровывают, отмывают от нитрат- или ацетат-иона и высушивают в вакуум-эксикаторе над пятиокисью фосфора в темноте.
Физические свойства
[править | править код]Тиоцианат свинца(II) образует белые кристаллы моноклинной сингонии, пространственная группа С 2/с, параметры ячейки a = 0,9661 нм, b = 0,6544 нм, c = 0,8253 нм, β = 92,37°, Z = 4 [1].
Не растворяется в холодной воде, р ПР = 4,7. В горячей воде растворимость несколько выше. Хорошо растворяется в воде, подкисленной соляной кислотой.
Чувствителен к воздействию света.
Химические свойства
[править | править код]- Растворяется в ацетоновом растворе тиоцианата калия:
- На воздухе медленно окисляется с образованием родана и диоксида свинца[2]:
Применение
[править | править код]- Стабилизатор горения капсюльных составов и спичек. Входит в состав инициирующих взрывчатых веществ как горючий компонент, образующий большое количество твёрдых продуктов горения[3].
- Используют для лабораторного синтеза родана (дитиоциана).
Примечания
[править | править код]- ↑ Mokuolu J. A. A., Speakman J. C. The crystal structure of lead(II) thiocyanate // Acta Cryst.. — 1975. — Т. B31. — С. 172—176. — doi:10.1107/S0567740875002300.
- ↑ Advanced Inorganic Chemistry. — Krishna Prakashan Media. — Т. 1. — С. 741. — ISBN 9788187224037. Архивировано 17 июня 2020 года.
- ↑ Щукин Ю. Г., Лютиков Г. Г., Поздняков З. Г. Средства инициирования промышленных взрывчатых веществ. — М.: Недра, 1996. — С. 23. — 155 с.
Литература
[править | править код]- Справочник химика / Редкол.: Б. П. Никольский и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- CRC Handbook of Chemistry and Physics[англ.]. — 89th Edition. — Taylor and Francis Group, LLC, 2008—2009.
- Руководство по неорганическому синтезу: В 6-ти т. / Ред. Г. Брауэр. — М.: Мир, 1985. — Т. 3. — 392 с.
- Химический энциклопедический словарь / Редкол.: И. Л. Кнунянц и др.. — М.: Советская энциклопедия, 1983. — 792 с.
Это заготовка статьи о неорганическом веществе. Помогите Википедии, дополнив её. |



![{\displaystyle {\mathsf {Pb(SCN)_{2}+4KSCN\ {\xrightarrow {}}\ K_{4}[Pb(SCN)_{6}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/31fc2f2c7a8afcc045461d5f1bdb3fbcbd621a93)
