Ривароксабан (JnfgjktvgQgu)
Стиль этой статьи неэнциклопедичен или нарушает нормы литературного русского языка. |
| Ривароксабан | |
|---|---|
| лат. Rivaroxabanum | |
 | |
| Химическое соединение | |
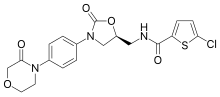
| ИЮПАК | (S)-5-хлоро-N-{[2-оксо-3-[4-(3-оксоморфолин-4-yl)фенил]оксазолидин-5-yl]метил} тиофен-2-карбоксамид |
| Брутто-формула | C19H18N3O5SCl |
| Молярная масса | 435.882 г/моль |
| CAS | 366789-02-8 |
| PubChem | 6433119 |
| DrugBank | DB06228 |
| Состав | |
| Классификация | |
| Фармакол. группа | Антикоагулянты[1] |
| АТХ | B01AF01 |
| МКБ-10 | I48, I80 |
| Фармакокинетика | |
| Биодоступн. | от 80% до 100% |
| Метаболизм | CYP3A4, CYP2J2 и CYP-независимые механизмы[2][3] |
| Период полувывед. |
от 5 до 9 часов у молодых пациентов; от 11 до 13 часов у пожилых пациентов[2][3] |
| Экскреция |
2/3 метаболизируется и выводится почками; 1/3 выводится кишечником в неизменном виде[2][3] |
| Лекарственные формы | |
| таблетки 2,5, 10, 15 и 20 мг | |
| Способы введения | |
| перорально | |
| Другие названия | |
| Ксарелто® | |
Рива́роксабан (кодовое название BAY 59-7939) — пероральный антикоагулянт из группы прямых ингибиторов фактора Xa. В частности, он используется для лечения тромбоза глубоких вен и легочной эмболии, а также для предотвращения образования тромбов при фибрилляции предсердий и после операций на бедре или колене.[4]
Общие побочные эффекты включают кровотечение[4]. К другим побочным эффектам относят гематому позвоночника и анафилаксию[4]. Неясно, безопасно ли использование ривароксабана во время беременности и кормления грудью.[5] По сравнению с варфарином, он меньше взаимодействует с другими лекарствами.и не требует постоянного контроля МНО[6] Он работает, блокируя активность фактора свертывания крови Ха.[4]
Разработан и выпускается немецкой фармацевтической компанией Bayer под торговым названием «Ксарелто».
Применение в медицине
[править | править код]У пациентов с неклапанной фибрилляцией предсердий препарат столь же эффективен, как варфарин в предотвращении негеморрагических инсультов и тромбоэмболии.[7] Применение Ривароксабана связано с более низким риском сильных и смертельных кровотечений, чем варфарин. Хотя ривароксабан и связан с более высокой частотой кровотечений в желудочно-кишечном тракте.[8]
В июле 2012 года британский Национальный институт здравоохранения и медицины рекомендовал ривароксабан для профилактики и лечения венозной тромбоэмболии.[9]
Мерцательная аритмия
[править | править код]Разница в эффектах ПАНАВК (Пероральные антикоагулянты, не являющиеся антагонистами витамина К) и варфарина у людей с мерцательной аритмией, которым выполнили стентирование сосудов сердца, может быть незначительной или вообще отсутствовать. Тем не менее, ПАНАВК, вероятно, уменьшают потребность в госпитализации по сравнению с варфарином.
ПАНАВК могут быть безопаснее варфарина. Один из препаратов ПАНАВК (дабигатран) может снизить частоту как больших, так и малых кровотечений. Другие препараты ПАНАВК (апиксабан и ривароксабан), вероятно, снижают частоту небольших кровотечений. Существенной разницы между препаратами ПАНАВК в каких‐либо первичных или вторичных исходах не было.
Определённость доказательств варьировала от очень низкой до средней, что указывает на необходимость дополнительных исследований по этому вопросу.[10][11]
Артроскопия коленного сустава
[править | править код]Существует небольшой риск того, что у здоровых взрослых пациентов, перенесших артроскопию коленного сустава, разовьется венозная тромбоэмболия (ТЭЛА или ТГВ). Имеются доказательства от умеренной до низкой достоверности об отсутствии пользы от использования низкомолекулярного гепарина (НМГ), аспирина или ривароксабана для снижения этого небольшого риска ТЭЛА или симптоматического ТГВ. Имеются очень низкие доказательства того, что использование НМГ может снизить риск бессимптомного ТГВ по сравнению с отсутствием лечения, но неясно, как это напрямую связано с частотой ТГВ или ТЭЛА у здоровых пациентов. Не было обнаружено никаких доказательств различий в побочных эффектах (включая большое и незначительное кровотечение), но данные, относящиеся к этому, были ограничены из-за небольшого количества событий в исследованиях, сообщающих в рамках сравнений.[12][13]
Противопоказания
[править | править код]В рекомендациях по дозировке не рекомендуется назначать ривароксабан с лекарствами, которые, как известно, являются сильными комбинированными ингибиторами CYP3A4 / P-гликопротеина, поскольку это приводит к значительно более высоким концентрациям ривароксабана в плазме.[14][15]
Из-за трудностей, связанных с контролем кровотечения, прием ривароксабана следует прекратить, по крайней мере за 24 часа до операции, а затем снова начать, как только будет установлен адекватный гемостаз.[16]
Побочные эффекты
[править | править код]Наиболее серьёзный побочный эффект — это кровотечения, включая тяжёлые внутренние кровотечения.[17][18][19] Применение Ривароксабана связано с более низким риском сильных и смертельных кровотечений, чем варфарин, но связан с более высокой частотой кровотечений в ЖКТ.
В октябре 2014 года, компания Портола Фармасьютикалз завершила фазы I и II клинических испытаний для andexanet Альфа в качестве антидота для ингибиторов фактора Ха с несколькими побочными эффектами, и начала исследования III фазы.[20][21] Andexanet Альфа, как ожидалось, будет утверждён в 2016 году.[22] Однако, в 2017 году соединение ещё не было одобрено FDA.
В 2015 году пост-маркетинговые исследования выявили токсичность для печени, и показали необходимость дальнейших исследований для количественной оценки риска.[23][24] Препарат противопоказан людям с серьёзными заболеваниями печени и терминальной стадии почечной болезни, при которых исследований не проводилось.
Ривароксабан в индивидуальной упаковке имеет предупреждение о том, что людям, использующим препарат, не следует прекращать его применения до консультации с врачом, так как это может увеличить риск инсульта.[25]
В 2015 году на ривароксабан приходится наибольшее количество зарегистрированных случаев серьёзных осложнений среди регулярно контролируемых FDA лекарств.[26]
Антидот
[править | править код]Специфическим антидотом ривороксабана является препарат Андекса (рекомбинантный инактивированный фактор Xa).
Механизм действия
[править | править код]Ривароксабан подавляет свободный фактор Ха и фактор Ха связанный в комплекс протромбиназы.[27] Это высокоселективный прямой ингибитор фактора Ха с пероральной биодоступностью и быстрым началом действия. Ингибирование фактора Ха прерывает внутренние и внешние пути свёртывания крови, препятствует образованию тромбина и развитию тромбов. Ривароксабан не подавляет тромбин (активированный фактор II) и не оказывает никакого влияния на тромбоциты.[28] Это позволяет легко корректировать дозы в антикоагулянтной терапии и отслеживать коагуляцию[28] , а также избегать ограничений в питании.[22]
Нефракционированный гепарин, низкомолекулярный гепарин и фондапаринукс также ингибируют активность фактора Ха, но косвенно, путём связывания циркулирующего антитромбина (АТ III). Принимая во внимание, что орально активный варфарин и аценокумарол являются антагонистами витамина К, уменьшая количество факторов свёртывания крови, включая фактор X.[29]
Ривароксабан имеет предсказуемую фармакокинетику у широкого спектра пациентов (возраст, пол, вес, раса) и имеет линейную кривую доза-эффект в восьмикратном диапазоне доз (5-40 мг).[30]
Фармакодинамика
[править | править код]Фактор свёртывания крови X (фактор Стюарта—Прауэра) играет центральную роль в каскаде коагуляции, так как активируется и внешней, и внутренней теназой. Переходя в активную форму фактор X вместе с неферментным кофактором Va и Ca2+ образует на поверхности тромбоцитов или эндотелия протромбиназный комплекс, который в свою очередь катализирует процесс превращения протромбина в тромбин. Тромбин активирует полимеризацию растворимого фибриногена, приводя к формированию фибринового сгустка (тромба).
Механизм действия ривароксабан заключается в высокоселективном прямом ингибировании фактора свёртывания крови Ха, что позволяет одновременно заблокировать как внешний, так и внутренний пути коагуляции, и приостановить процесс тромбообразования.
Химия
[править | править код]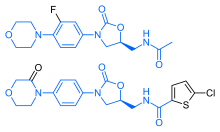
Ривароксабан имеет поразительное структурное сходство с антибиотиками группы линезолида: оба препарата имеют те же оксазолидинон-производные основные структуры. Соответственно, ривароксабан изучался на возможную противомикробную активность и митохондриальную токсичность, которая является известным осложнением долгосрочного применения линезолида. Исследования показали, что ни ривароксабан, ни его метаболиты не обладают антибактериальным действием против грам-положительных бактерий. Что касается митохондриальной токсичности, то в исследованиях In vitro, опубликованных до 2008 года выявленный риск был низким.[31]
Общество и культура
[править | править код]Экономика
[править | править код]Использование ривароксабана в 70 раз чаще варфарина, по данным Express Scripts Holding Co, крупнейшей в США компанией по работе с аптеками.[22] В 2016 году, Байер утверждал, что препарат был лицензирован в 130 странах и более 23 миллионов пациентов прошли лечение.[32]
Одобрение
[править | править код]В сентябре 2008 года, Министерство здравоохранения Канады выдало регистрационное удостоверение на ривароксабан для профилактики венозной тромбоэмболии у людей, которые прошли замену тазобедренного сустава или полное эндопротезирование коленного сустава.[33] В том же месяце Европейская комиссия также выдала регистрационное удостоверение ривароксабана для профилактики венозной тромбоэмболии у взрослых пациентов, перенёсших плановые операции бедра и коленного сустава.[34]
На 1 июля 2011 года Управление по санитарному надзору за качеством пищевых продуктов и медикаментов в США (FDA) одобрило ривароксабан для профилактики тромбоза глубоких вен (ТГВ), который может привести к тромбоэмболии лёгочной артерии (ТЭЛА), у взрослых, перенёсших эндопротезирование тазобедренного и коленного сустава.[35]
4 ноября 2011 года FDA США одобрило ривароксабан для профилактики инсульта у пациентов с неклапанной фибрилляцией предсердий.[36]
Исследования
[править | править код]Исследователи из Школы медицины Университета Дьюка были обвинены в сокрытии клинических данных, используемых для оценки ривароксабана.[37] Они проводили клинические испытания ривароксабана ROCKET AF.[38] В клиническом исследовании, опубликованном в 2011 году в медицинском журнале в Новой Англии[39], которое возглавил Роберт Калиффи, (представитель FDA[40])[39], нашли, что ривароксабан более эффективен, чем варфарин в снижении вероятности ишемических инсультов у пациентов с фибрилляцией предсердий.[39] Валидность исследования была поставлена под вопрос в 2014 году, когда фармацевтическими компаниями Байер и Джонсон и Джонсон было установлено, что использованные приборы мониторинга крови INRatio не функционируют должным образом.[37][38] Последующий анализ исследований Школы медицины Университета Дьюка, опубликованных в феврале 2016 года, обнаружил, что это не оказало существенного влияния на эффективность и безопасность испытаний.[41]
Примечания
[править | править код]- ↑ Ривароксабан (Rivaroxaban): инструкция, применение и формула. Энциклопедия лекарств и товаров аптечного ассортимента rlsnet.ru. Дата обращения: 31 марта 2015. Архивировано 7 января 2015 года.
- ↑ 1 2 3 Xarelto: Summary of Product Characteristics – EU (англ.). Официальный сайт Xarelto®. Дата обращения: 31 марта 2015.
- ↑ 1 2 3 Ксарелто: Инструкция по применению, противопоказания, состав и цена, 3D-упаковка. Энциклопедия лекарств и товаров аптечного ассортимента rlsnet.ru. Дата обращения: 31 марта 2015. Архивировано 28 марта 2015 года.
- ↑ 1 2 3 4 Rivaroxaban Monograph for Professionals. Drugs.com. American Society of Health-System Pharmacists. Дата обращения: 3 марта 2019. Архивировано 27 марта 2019 года.
- ↑ Rivaroxaban Use During Pregnancy. Drugs.com. Дата обращения: 3 марта 2019. Архивировано 27 марта 2019 года.
- ↑ Kiser, Kathryn. Oral Anticoagulation Therapy: Cases and Clinical Correlation. — Springer, 2017. — P. 11. — ISBN 9783319546438. Архивная копия от 13 сентября 2020 на Wayback Machine
- ↑ Gómez-Outes, A; Terleira-Fernández, AI; Calvo-Rojas, G; Suárez-Gea, ML; Vargas-Castrillón, E. Dabigatran, Rivaroxaban, or Apixaban versus Warfarin in Patients with Nonvalvular Atrial Fibrillation: A Systematic Review and Meta-Analysis of Subgroups. (англ.) // Thrombosis : journal. — 2013. — Vol. 2013. — P. 640723. — doi:10.1155/2013/640723. — PMID 24455237. — PMC 3885278.
- ↑ Brown D.G., Wilkerson E.C., Love W.E. A review of traditional and novel oral anticoagulant and antiplatelet therapy for dermatologists and dermatologic surgeons (англ.) // Journal of the American Academy of Dermatology[англ.] : journal. — 2015. — March (vol. 72, no. 3). — P. 524—534. — doi:10.1016/j.jaad.2014.10.027. — PMID 25486915.
- ↑ NICE guidance TA261 NICE guidance TA261 Архивная копия от 13 мая 2020 на Wayback Machine. National Institute for Health and Clinical Excellence, July 2012
- ↑ Non‐vitamin K antagonist oral anticoagulants (NOACs) post‐percutaneous coronary intervention: a network meta‐analysis. Cochrane Library.
- ↑ Пероральные антикоагулянты, не являющиеся антагонистами витамина К (ПАНАВК), при чрескожном коронарном вмешательстве: сетевой мета‐анализ. Cochrane Library.
- ↑ Interventions for preventing venous thromboembolism in adults undergoing knee arthroscopy. Cochrane Library.
- ↑ Вмешательства для профилактики венозных тромбоэмболических осложнений у взрослых, перенесших артроскопическую операцию на коленном суставе. Cochrane Library.
- ↑ Xarelto- rivaroxaban tablet, film coated Xarelto- rivaroxaban tablet, film coated Xarelto- rivaroxaban kit. DailyMed. Дата обращения: 13 ноября 2020. Архивировано 19 апреля 2021 года.
- ↑ Mueck W, Kubitza D, Becka M (September 2013). "Co-administration of rivaroxaban with drugs that share its elimination pathways: pharmacokinetic effects in healthy subjects". British Journal of Clinical Pharmacology. 76 (3): 455—66. doi:10.1111/bcp.12075. PMC 3769672. PMID 23305158.
- ↑ Sunkara T, Ofori E, Zarubin V, Caughey ME, Gaduputi V, Reddy M (2016). "Perioperative Management of Direct Oral Anticoagulants (DOACs): A Systemic Review". Health Services Insights. 9 (Suppl 1): 25—36. doi:10.4137/HSI.S40701. PMC 5156547. PMID 28008269.
- ↑ Medication Guide--Xarelto. U.S. Food and Drug Administration. Дата обращения: 1 сентября 2014. Архивировано 2 мая 2014 года.
- ↑ Xarelto Side Effects. WebMD. Дата обращения: 1 сентября 2014. Архивировано 3 сентября 2014 года.
- ↑ Xarelto Side Effects Center. RxList. Дата обращения: 1 сентября 2014. Архивировано 3 сентября 2014 года.
- ↑ Schroeder C. Possible Antidote Could Help Blood Thinner Patients In Bleeding Emergencies. DrugNews. Дата обращения: 20 августа 2015. Архивировано 10 мая 2015 года.
- ↑ Mo Y., Yam F.K. Recent advances in the development of specific antidotes for target-specific oral anticoagulants (англ.) // Pharmacotherapy : journal. — 2015. — February (vol. 35, no. 2). — P. 198—207. — doi:10.1002/phar.1532. — PMID 25644580.
- ↑ 1 2 3 Bill Berkrot New blood thinner 'antidote' to help doctors move past warfarin. Reuters (23 декабря 2015). Дата обращения: 16 марта 2019. Архивировано 3 апреля 2019 года.
- ↑ Raschi, Emanuel; Poluzzi, Elisabetta; Koci, Ariola; Salvo, Francesco; Pariente, Antoine; Biselli, Maurizio; Moretti, Ugo; Moore, Nicholas; De Ponti, Fabrizio. Liver injury with novel oral anticoagulants: assessing post-marketing reports in the US Food and Drug Administration adverse event reporting system (англ.) // British Journal of Clinical Pharmacology[англ.] : journal. — 2015. — 1 August (vol. 80, no. 2). — P. 285—293. — ISSN 1365-2125. — doi:10.1111/bcp.12611. — PMID 25689417. — PMC 4541976.
- ↑ Russmann, Stefan; Niedrig, David F.; Budmiger, Mathias; Schmidt, Caroline; Stieger, Bruno; Hürlimann, Sandra; Kullak-Ublick, Gerd A. Rivaroxaban postmarketing risk of liver injury (неопр.) // Journal of Hepatology. — 2014. — 1 August (т. 61, № 2). — С. 293—300. — ISSN 1600-0641. — doi:10.1016/j.jhep.2014.03.026. — PMID 24681117.
- ↑ XARELTO (rivaroxaban) label. U.S. Food and Drug Association. Дата обращения: 16 марта 2019. Архивировано 20 сентября 2018 года.
- ↑ Schroeder C. ISMP Ranks Xarelto Most Dangerous Drug in the United States. DrugNews. DrugNews. Дата обращения: 10 августа 2016. Архивировано 11 августа 2016 года.
- ↑ Roehrig S., Straub A., Pohlmann J., etal. Discovery of the novel antithrombotic agent 5-chloro-N-({(5S)-2-oxo-3- [4-(3-oxomorpholin-4-yl)phenyl]-1,3-oxazolidin-5-yl}methyl)thiophene- 2-carboxamide (BAY 59-7939): an oral, direct factor Xa inhibitor (англ.) // Journal of Medicinal Chemistry[англ.] : journal. — 2005. — September (vol. 48, no. 19). — P. 5900—5908. — doi:10.1021/jm050101d. — PMID 16161994.
- ↑ 1 2 Xarelto: Summary of Product Characteristics. Bayer Schering Pharma AG (2008). Дата обращения: 11 февраля 2009. Архивировано 27 июля 2010 года.
- ↑ Turpie A.G. New oral anticoagulants in atrial fibrillation (англ.) // European Heart Journal[англ.] : journal. — 2008. — January (vol. 29, no. 2). — P. 155—165. — doi:10.1093/eurheartj/ehm575. — PMID 18096568.
- ↑ Eriksson B.I., Borris L.C., Dahl O.E., etal. A once-daily, oral, direct Factor Xa inhibitor, rivaroxaban (BAY 59-7939), for thromboprophylaxis after total hip replacement (англ.) // Circulation[англ.] : journal. — Lippincott Williams & Wilkins[англ.], 2006. — November (vol. 114, no. 22). — P. 2374—2381. — doi:10.1161/CIRCULATIONAHA.106.642074. — PMID 17116766.
- ↑ European Medicines Agency. CHP Assessment Report for Xarelto (EMEA/543519/2008) (2008). Дата обращения: 11 июня 2009. (недоступная ссылка)
- ↑ Bayer comments on article in The British Medical Journal (BMJ) regarding Xarelto. Bayer AG Communications, Government Relations & Corporate Brand (29 сентября 2016). Дата обращения: 16 марта 2019. Архивировано 31 января 2017 года.
- ↑ "Bayer's Xarelto Approved in Canada" (Press release). Bayer. 2008-09-16. Архивировано 11 июля 2011. Дата обращения: 31 января 2010.
- ↑ "Bayer's Novel Anticoagulant Xarelto now also approved in the EU" (Press release). Bayer. 2008-02-10. Архивировано 22 октября 2008. Дата обращения: 31 января 2010.
- ↑ "FDA Approves XARELTO® (rivaroxaban tablets) to Help Prevent Deep Vein Thrombosis in Patients Undergoing Knee or Hip Replacement Surgery" (Press release). Janssen Pharmaceutica. 2011-07-01. Дата обращения: 1 июля 2011.
{{cite press release}}:|archive-url=требует|archive-date=(справка) - ↑ "FDA approves Xarelto to prevent stroke in people with common type of abnormal heart rhythm". U.S. Food and Drug Association. 2011-11-04. Архивировано 5 ноября 2011. Дата обращения: 27 апреля 2016.
- ↑ 1 2 Katie Thomas. Document Claims Drug Makers Deceived a Top Medical Journal. The New York Times. The New York Times. Дата обращения: 3 мая 2016. Архивировано 5 марта 2016 года.
- ↑ 1 2 Vir Patel. Duke clinical trial under scrutiny in drug case. The Chronicle. Duke Student Publishing Company. Дата обращения: 16 марта 2019. Архивировано 8 мая 2016 года.
- ↑ 1 2 3 Rivaroxaban versus Warfarin in Nonvalvular Atrial Fibrillation. The New England Journal of Medicine. Massachusetts Medical Society. Дата обращения: 16 марта 2019. Архивировано 13 июля 2019 года.
- ↑ Meet Robert M. Califf, M.D., Commissioner of Food and Drugs. U.S. Food and Drug Administration. U.S. Food and Drug Administration. Дата обращения: 3 мая 2016. Архивировано 15 мая 2016 года.
- ↑ Point-of-Care Warfarin Monitoring in the ROCKET AF Trial. Massachusetts Medical Society (3 февраля 2016). Дата обращения: 16 марта 2019. Архивировано 3 февраля 2019 года.
Ссылки
[править | править код]- Пероральные антикоагулянты, не являющиеся антагонистами витамина К (ПАНАВК), при чрескожном коронарном вмешательстве: сетевой мета‐анализ / Cochrane
- Вмешательства для профилактики венозных тромбоэмболических осложнений у взрослых, перенесших артроскопическую операцию на коленном суставе / Cochrane
- Ривароксабан связывается с белками в ПДБ (англ.)
- Xarelto — Информация о назначении (Европейский Союз) (англ.)
- Xarelto — Информация о назначении (США) (англ.)
- Ривароксабан (Rivaroxaban) — Энциклопедия лекарств и товаров аптечного ассортимента. РЛС Патент. — Действующее вещество