Производные бис-β-хлорэтиламина (Hjkn[fk;udy Qnv-β-]lkjzmnlgbnug)
Производные бис-β-хлорэтиламина, или, иначе, азотистые аналоги иприта, азотистые иприты, азотистые аналоги горчичного газа, хлорэтиламины, нитроген мустарды — исторически первые цитостатические противоопухолевые химиотерапевтические лекарственные препараты. По механизму действия они являются алкилирующими препаратами, то есть алкилируют ДНК злокачественных клеток в области 7-го атома азота у гуаниновых нуклеотидных оснований. Это, в свою очередь, приводит к образованию ДНК-аддуктов и «сшивок» (межцепочечных и внутрицепочечных гуанин-гуаниновых кросс-линков) в двухцепочечной молекуле ДНК и к невозможности «расплетания» спирали ДНК, невозможности разделения двухнитевой ДНК на нити и, как следствие, к ингибированию биосинтеза новой ДНК, угнетению размножения клеток, то есть процессов деления, митоза. В свою очередь, клетка, не способная ни поделиться, ни отреставрировать повреждённую ДНК, запускает механизм апоптоза (программируемой клеточной смерти). На макроуровне это приводит к некрозу злокачественной опухоли и ремиссии онкологического заболевания.
Предыстория
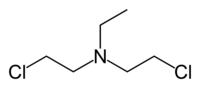
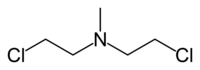
[править | править код]Изначально азотистые иприты, или азотистые аналоги иприта, азотистые аналоги горчичного газа были известны как группа органических веществ общей формулы R-N-(СН2-СН2-Сl)2, где R = либо СН3-, либо С2Н5-, либо Cl-СН2-СН2-. Интерес к этим веществам изначально был обусловлен возможностью их военного применения в качестве потенциального химического оружия. По общеядовитому и сильному кожно-нарывному действию эти соединения аналогичны иприту (сульфур мустарду). Однако впоследствии некоторые из азотистых аналогов иприта (нитроген мустардов) нашли совершенно иное применение — в качестве противоопухолевых цитостатических препаратов.
 |
 |
 |
История
[править | править код]До начала использования алкилирующих агентов в химиотерапии злокачественных опухолей многие из них были уже известны в качестве «горчичного газа» (иприта и его аналогов), использовавшихся в качестве химического оружия кожно-нарывного типа во время Первой Мировой войны. Азотистые аналоги иприта были исторически первыми алкилирующими агентами, использовавшимися в медицине, и первыми примерами современной химиотерапии злокачественных опухолей. Гудман, Гилман и их коллеги в Йельском университете начали изучать азотистые аналоги иприта в 1942 году. И вскоре после обнаружения того факта, что введение этих агентов иногда приводит к значительному уменьшению и даже полному исчезновению экспериментальных злокачественных опухолей у лабораторных мышей, эти химиотерапевтические агенты были впервые протестированы на людях в конце этого же года. Использование «газа HN2» — метил-бис-(β-хлорэтил)-амина гидрохлорида (позже ставшего известным как хлорметин, он же мехлоретамин, или мустин, мустарген, эмбихин) и «газа HN3» — трис-(β-хлорэтил)-амина гидрохлорида для химиотерапевтического лечения запущенных случаев лимфогранулематоза, лимфомы и лимфосаркомы, лейкозов и других злокачественных опухолей, особенно гематологических у пациентов-добровольцев часто приводило к быстрому уменьшению или даже временному полному исчезновению опухолевых масс. Однако потом с неизбежностью возникали рецидивы, причём уже с устойчивостью к мехлоретамину («газу HN2») и к «газу HN3». Ввиду высокой степени секретности, окружавшей эти разработки, как и всё, связанное с исследованиями в области боевых отравляющих веществ, результаты исследований Гудмана и Гилмана о противоопухолевой активности мехлоретамина и «газа HN3» не были опубликованы вплоть до 1946 года[1][2]. Эти публикации вызвали взрыв энтузиазма в среде онкологов и резкий рост интереса к прежде не существовавшей области химиотерапевтического лечения злокачественных опухолей человека.
В последующие 25 лет после публикации Гудмана и Гилмана о противоопухолевой активности мехлоретамина («газа HN2») и «газа HN3» были синтезированы десятки новых алкилирующих химиопрепаратов, обладавших заметно меньшей токсичностью (в частности, меньшей гематологической токсичностью, меньшей способностью вызывать выраженную миелосупрессию) и более широким спектром противоопухолевого действия. В частности, многие из вновь синтезированных алкилирующих агентов оказались применимы не только при гемобластозах, но и при различных солидных злокачественных опухолях. К таким удачным разработкам относятся, например, мелфалан и циклофосфамид, сохранившие своё значение и широко применяемые в химиотерапии злокачественных новообразований и по сей день[3].
Распространённый миф утверждает, что якобы Гудману и Гилману пришло в голову (или было предложено их начальством из Йельского университета) изучить потенциальную пригодность азотистых аналогов иприта в качестве возможных средств для химиотерапии злокачественных новообразований после того, как в 1943 году случился инцидент в Италии, в городе Бари, где выжившие после воздействия «горчичного газа» солдаты и мирные жители длительное время страдали от выраженной лейкопении. Однако на самом деле эксперименты по химиотерапевтическому лечению злокачественных опухолей с помощью азотистых аналогов иприта, сначала на животных, а затем и на добровольцах-людях, начались за год до события в Бари, в 1942 году. Гилман не упоминает об эпизоде в Бари как об имевшем какое-либо значение или оказавшем какое-либо влияние на их с Гудманом научные изыскания по противоопухолевой активности азотистых аналогов иприта, хотя он, несомненно, знал об этом эпизоде[4]. А способность иприта вызывать выраженную лейкопению, миелосупрессию и иммуносупрессию была известна задолго до опытов Гудмана и Гилмана, ещё с 1919 года, со времён окончания Первой Мировой войны[3].
Примеры
[править | править код]- Газ HN1;
- Газ HN3;
- Хлорметин;
- Мелфалан;
- Хлорамбуцил;
- Бендамустин;
- Проспидин;
- Спиробромин;
- Лофенал;
- Новэмбихин;
- Манномустин;
- Преднимустин;
- Урамустин;
- Пафенцил;
- Циклофосфамид;
- Ифосфамид;
- Трофосфамид;
- Перфосфамид;
- Мафосфамид;
- 4-гидроксициклофосфамид;
- Алдофосфамид;
- Глюфосфамид;
- Эстрамустин.
Примечания
[править | править код]- ↑ Паевский А. От убийцы к миротворцу: как иприт губил жизни, а потом начал их спасать Архивная копия от 4 ноября 2021 на Wayback Machine
- ↑ Goodman L. S., Wintrobe M. M., Dameshek W., Goodman M. J., Gilman A. Z., McLennan M. T. Nitrogen mustard therapy (неопр.) // JAMA. — 1946. — Т. 132, № 3. — С. 126—132. — doi:10.1001/jama.1946.02870380008004.
- ↑ 1 2 Scott R. B. Cancer chemotherapy--the first twenty-five years (англ.) // Br Med J. : journal. — 1970. — Vol. 4, no. 5730. — P. 259—265. — doi:10.1136/bmj.4.5730.259. — PMID 4319950. — PMC 1819834.
- ↑ Gilman A. The initial clinical trial of nitrogen mustard (неопр.) // Am J Surg.. — 1963. — Т. 105, № 5. — С. 574—578. — doi:10.1016/0002-9610(63)90232-0. — PMID 13947966.