Правила Болдуина (Hjgfnlg >kl;rnug)


Правила Болдуина для замыкания цикла (англ. Baldwin's rules for ring closure) — в органической химии набор эмпирических правил, описывающих предпочтительное направление реакций циклизации в алициклических соединениях. Предложены английским химиком Джеком Болдуином в 1976 году.[1][2]
Терминология
[править | править код]При описании своих правил Болдуин использовал следующие аббревиатуры:
- размер формируемого цикла обозначается арабской цифрой с последующим дефисом: 3-, 4-, 5-, 6-, 7-;
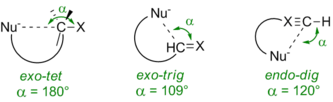
- если в ходе циклизации разрывается химическая связь вне будущего цикла, то такая реакция получает префикс экзо-. Если же разрывается «внутренняя» связь, процесс называется эндо-. Особым случаем являются реакции циклизации, сопровождающиеся одновременным раскрытием другого цикла. В таком случае используется соглашение, показанное на рисунке.
- гибридизация электрофильного атома углерода обозначается следующим образом: sp³ — тет (тетрагональный, англ. tetragonal), sp² — триг (тригональный, англ. trigonal), sp — диг (дигональный, англ. digonal).
В зависимости от лёгкости протекания реакции циклизации делятся на выгодные и невыгодные. Данные определения являются относительными. «Невыгодный» процесс вполне возможен, но обычно требует более жёстких условий, чем «выгодный».[3]
Правила
[править | править код]| Выгодные/невыгодные направления циклизации | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 3 | 4 | 5 | 6 | 7 | ||||||
| экзо | эндо | экзо | эндо | экзо | эндо | экзо | эндо | экзо | эндо | |
| тет | ✓ | ✓ | ✓ | ✗ | ✓ | ✗ | ✓ | |||
| триг | ✓ | ✗ | ✓ | ✗ | ✓ | ✗ | ✓ | ✓ | ✓ | ✓ |
| диг | ✗ | ✓ | ✗ | ✓ | ✓ | ✓ | ✓ | ✓ | ✓ | ✓ |
Правила Болдуина по своей природе эмпирические и основаны на результатах обобщения множества опубликованных реакций. В настоящее время известны многочисленные отклонения.
Принято считать, что фактором, определяющим ход циклизации, являются стереохимические требования в переходном состоянии процесса. В зависимости от конфигурации электрофильного атома углерода (тет-, триг- или диг-) нуклеофил должен атаковать по строго определённой траектории:
Примеры
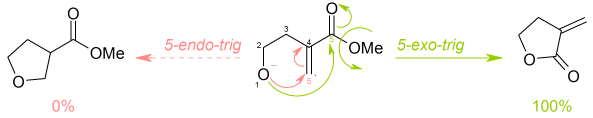
[править | править код]В приведённой ниже реакции выгодный 5-экзо-триг процесс полностью преобладает над невыгодным 5-эндо-триг.
Ключевой стадией полного синтеза алкалоида (+)-преуссина была 5-эндо-диг циклизация под действием ацетата ртути.[4]
Правила Болдуина для енолятов
[править | править код]Для реакций циклизации, в которых в роли нуклеофила выступает енолят-анион, потребовалось разработать отдельные набор правил и номенклатуру.[5][6]
Если продукт реакции содержит карбонильную группу вне нового цикла, то такой процесс называется енолэкзо (англ. enolexo). Если же после циклизации карбонильная группа оказывается в цикле, то реакция обозначается как енолэндо (англ. enolendo).
Правила Болдуина для енолятов выглядят следующим образом:[7]
| Выгодные/невыгодные направления циклизации енолятов | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| енолэндо | енолэкзо | |||||||||
| 3 | 4 | 5 | 6 | 7 | 3 | 4 | 5 | 6 | 7 | |
| экзо-тет | ✗ | ✗ | ✗ | ✓ | ✓ | ✓ | ✓ | ✓ | ✓ | ✓ |
| экзо-триг | ✗ | ✗ | ✗ | ✓ | ✓ | ✓ | ✓ | ✓ | ✓ | ✓ |
Примечания
[править | править код]- ↑ J. E. Baldwin, Rules for Ring Closure, J. Chem. Soc., Chem. Commun. 1976, 734. doi:10.1039/C39760000734(Открытый доступ)
- ↑ J. E. Baldwin, et al., Rules for Ring Closure: Ring Formation by Conjugate Addition of Oxygen Nucleophiles, J. Org. Chem., 1977, 42 (24), 3846. doi:10.1021/jo00444a011
- ↑ P. Auvray, P. Knochel, J. F. Normant, 5-Endo-Trigonal ring closures of unsaturated sulfones, Tetrahedron Lett. 1985, 26 (37), 4455-4458. doi:10.1016/S0040-4039(00)88929-7
- ↑ M. Overhand, S. M. Hecht, A Concise Synthesis of the Antifungal Agent (+)-Preussin, J. Org. Chem. 1994, 59 (17), 4721-4722. doi:10.1021/jo00096a007
- ↑ J. E. Baldwin, L. I. Kruse, Rules for ring closure. Stereoelectronic control in the endocyclic alkylation of ketone enolates, J. Chem. Soc., Chem. Commun., 1977, 233—235. doi:10.1039/C39770000233
- ↑ J. E. Baldwin, M. J. Lusch, Rules for ring closure: application to intramolecular aldol condensations in polyketonic substrates, Tetrahedron, 1982, 38 (19), 2939—2947. doi:10.1016/0040-4020(82)85023-0
- ↑ M. B. Smith, J. March, March’s Advanced Organic Chemistry: Reactions, Mechanisms, and Structure, 6th ed., Wiley-Interscience, 2007, ISBN 978-0-471-72091-1