Метод Грама (Bymk; Ijgbg)
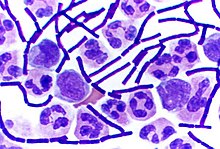
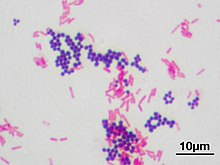
Метод Грама — метод окраски микроорганизмов для исследования, позволяющий дифференцировать бактерии по биохимическим свойствам их клеточной стенки. Предложен в 1884 году датским врачом Гансом Кристианом Грамом.
По Граму бактерии окрашивают анилиновыми красителями — генциановым или метиловым фиолетовым и др., затем краситель фиксируют раствором иода. При последующем промывании окрашенного препарата спиртом те виды бактерий, которые оказываются прочно окрашенными в синий цвет и имеющие толстую клеточную стенку, называют грамположительными бактериями, обозначаются Грам (+), — в отличие от грамотрицательных (тонкая клеточная стенка), Грам (−), которые при промывке обесцвечиваются.
После промывания растворителем при окрашивании по Граму добавляется контрастный красный краситель, который окрашивает все грамотрицательные бактерии в красный или розовый цвет. Тест классифицирует бактерии, разделяя их на две группы относительно строения их клеточной стенки.
Использование в диагностике
[править | править код]Окраска по Граму имеет большое значение в систематике бактерий, а также для микробиологической диагностики инфекционных заболеваний.
Грамположительны кокковые (кроме представителей рода Neisseria) и спороносные (за исключением Coxiella burnetii) формы бактерий, они окрашиваются в сине-чёрный (тёмно-синий) цвет.
Грамотрицательны многие неспороносные бактерии, они окрашиваются в красный или розовый цвет.
Техника проведения окраски
[править | править код]Окраска по Граму относится к сложному способу окраски, когда на мазок воздействуют двумя красителями, из которых один является основны́м, а другой — дополнительным. Кроме красящих веществ при сложных способах окраски применяют обесцвечивающие вещества: спирт, кислоты и др.
Для окраски по Граму чаще используют анилиновые красители трифенилметановой группы: генциановый, метиловый фиолетовый или кристаллвиолет. Грамположительные микроорганизмы дают прочное соединение с указанными красителями и йодом. При этом они не обесцвечиваются при воздействии на них спиртом, вследствие чего при дополнительной окраске фуксином грамположительные микроорганизмы не изменяют первоначально принятый фиолетовый цвет.
Грамотрицательные микроорганизмы образуют с основными красителями и иодом легко разрушающееся под действием спирта соединение. В результате микробы обесцвечиваются, а затем окрашиваются фуксином, приобретая красный цвет.
Подготовка материала для окраски
[править | править код]- Исследуемый материал распределяют тонким слоем по поверхности хорошо обезжиренного предметного стекла.
- Приготовленный мазок высушивают на воздухе и после полного высыхания фиксируют.
- Гистологические срезы готовят по стандартной методике, фиксируя кусочки тканей в формалине и заливая в парафин.
Фиксация
[править | править код]При фиксировании мазок закрепляется на поверхности предметного стекла, и поэтому при последующей окраске препарата микробные клетки не смываются. Кроме того, убитые микробные клетки окрашиваются лучше, чем живые.
Различают физический способ фиксации, в основу которого положено воздействие высокой температуры на микробную клетку, и химические способы, предусматривающие применение химических средств, вызывающих коагуляцию белков цитоплазмы.
Физический способ фиксации
[править | править код]Предметное стекло с препаратом берут пинцетом или I и II пальцами правой руки за рёбра мазком кверху и плавным движением проводят 2—3 раза над верхней частью пламени горелки. Весь процесс фиксации должен занимать не более 2 с.
Надёжность фиксации проверяют следующим приёмом: свободную от мазка поверхность предметного стекла прикладывают к тыльной поверхности левой кисти. При правильном фиксировании мазка стекло должно быть горячим, но не вызывать ощущения ожога (70—80°C).
Химический способ фиксации
[править | править код]Для фиксации мазков применяют метиловый спирт, ацетон, смесь Никифорова (смесь этилового спирта 96 % и наркозного эфира в соотношении 1:1), жидкость Карнуа (96-процентного этилового спирта — 60 %, хлороформа — 30 %, ледяной уксусной кислоты — 10 %), спирт-формол (40-процентного формалина — 5 мл, 96-процентного этилового спирта — 95 мл). Предметное стекло с высушенным мазком погружают в склянку с фиксирующим веществом на 10—15 минут и затем высушивают на воздухе. Применяется также фиксация в парах 40-процентного формалина в течение нескольких секунд.
Процесс окрашивания мазков
[править | править код]- На фиксированный мазок наливают один из осно́вных красителей на 2—3 минуты. Во избежание осадков окрашивают через фильтровальную бумагу.
- Сливают краску, аккуратно удаляют фильтровальную бумагу. Мазок заливают раствором Люголя или йодистым раствором по Граму (водный раствор йодида калия и кристаллического йода в соотношении 2:1) на 1—2 минуты до почернения препарата.
- Раствор сливают, мазок прополаскивают 96° этиловым спиртом или ацетоном, наливая и сливая его, пока мазок не обесцветится и стекающая жидкость не станет чистой (приблизительно 20—40—60 секунд).
- Тщательно промывают стекла в проточной или дистиллированной воде 1—2 мин.
- Для выявления грамотрицательной группы бактерий препараты дополнительно окрашивают фуксином или сафранином (2—5 мин).
- Промывают в проточной воде и высушивают фильтровальной бумагой.
Техника окраски бактерий в гистологических срезах по Граму-Вейгерту
[править | править код]- Депарафинированные срезы доводят до воды.
- Окрашивают 20 мин в 1 % растворе парарозанилина или основного фуксина в 1 % уксусной кислоте (раствор красителя нагревают до кипения, охлаждают и фильтруют).
- Промывают в 3 сменах дистиллированной воды.
- Окрашивают 5 мин в 1 % кристаллического фиолетового в дистиллированной воде.
- Быстро ополаскивают в 1 % растворе хлорида натрия.
- Обрабатывают 30 с в смеси: 1 часть иода + 2 части йодида калия + 100 частей дистиллированной воды.
- Промокают фильтровальной бумагой.
- Дифференцируют, нанося на срез смесь равных объёмов анилина и ксилола (1 — 2 мл); растворы сливают до тех пор, пока облачка красителя не перестанут отходить от среза.
- Проводят через 3 смены ксилола.
- Заключают в бальзам или любую смолу, растворённую в ксилоле.
Результат: грамположительные бактерии — сине-чёрные, фибрин — фиолетовый, ядра — красные.
См. также
[править | править код]Литература
[править | править код]- Грама метод // Гоголь — Дебит. — М. : Советская энциклопедия, 1972. — (Большая советская энциклопедия : [в 30 т.] / гл. ред. А. М. Прохоров ; 1969—1978, т. 7).
На немецком языке
- Gram, HC[англ.]. Über die isolierte Färbung der Schizomyceten in Schnitt- und Trockenpräparaten (нем.) // Fortschritte der Medizin : magazin. — 1884. — Bd. 2. — S. 185—189.
На английском языке
- Bergey, David H.; John G. Holt; Noel R. Krieg; Peter H.A. Sneath. Bergey's Manual of Determinative Bacteriology (англ.). — 9th ed.. — Lippincott Williams & Wilkins[англ.], 1994.
- Madigan, MT; Martinko J; Parker J. Brock Biology of Microorganisms (неопр.). — 10th Edition. — Lippincott Williams & Wilkins[англ.], 2004.
- Ryan, KJ; Ray, C. G. Sherris Medical Microbiology (неопр.). — 4th ed.. — McGraw Hill., 2004.
- Application of stains in clinical microbiology // Biotechnic & Histochemistry, Volume 76, Number 3, May 01, 2001, pp. 119—125(7)