Киназа дегидрогеназы α-кетокислот с разветвлённой цепью (Tnug[g ;yin;jkiyug[d α-tymktnvlkm v jg[fymfl~uukw eyh,Z)
Киназа дегидрогеназы α-кетокислот с разветвлённой цепью (англ. Branched chain α-ketoacid dehydrogenase kinase, сокр. BCKDK) — фермент (КФ 2.7.11.4 ) из семейства протеинкиназ (класс трансферазы), катализирующий реакцию фосфорилирования или переноса фосфатной группы (неорганического фосфата Pi) от молекулы ATP, на остаток серина дегидрогеназы α-кетокислот с разветвлённой цепью (BCKDC). Этот фермент является частью семейства митохондриальных протеинкиназ и регулятором катаболических путей разветвлённых аминокислот (BCAA) — валина, лейцина и изолейцина[5]. BCKDK обнаруживается в митохондриальном матриксе, и его распространённость зависит от типа клетки. Гепатоциты (клетки печени), как правило, имеют самую низкую концентрацию BCKDK, тогда как клетки скелетных мышц имеют самую высокую концентрацию[6][7]. Аномальная активность этого фермента часто приводит к таким заболеваниям, как лейциноз (болезнь „кленового сиропа“) и кахексия.
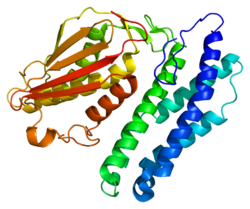
Структура
[править | править код]Структура BCKDK включает в себя характерный нуклеотидсвязывающий домен и четырёхспирального домен, аналогичные некоторым аспектам протеингистидинкиназ, которые участвуют в двухкомпонентных системах передачи сигналов. BCKDK также представляет собой димер с остатком Leu389, расположенным между димерами, и считается, что эта димеризация важна для его киназной активности и стабильности белка[8]. Более того, он состоит из 382 аминокислотных остатков и имеет молекулярную массу 43 кДа[6]. Ген BCKDK расположен на 16 хромосоме (p-плечо, короткое плечо) в локусе 16p11.2, имеет 11 экзонов, лишён ТАТА-бокса и инициаторного элемента (INR)[5][7].
Функция
[править | править код]BCKDK регулирует активность дегидрогеназного комплекса α-кетокислот разветвлённой цепью (BCKDC) посредством фосфорилирования и инактивации. Данная инактивация приводит к увеличению содержания аминокислот с разветвлённой цепью (BCAA), что, как считается, снижает окислительный стресс; однако доказано, что слишком большое количество BCAA токсично для человека. Таким образом, BCKDK является жизненно важным инструментом для поддержания гомеостаза BCAA[9][10]. Как указывалось ранее, концентрации BCKDK варьируются в зависимости от типа наблюдаемой ткани, тогда как концентрация BCKDC одинакова в любой ткани. Хотя концентрация BCKDC постоянна, количество BCKDK определяет активность дегидрогеназного комплекса. Поскольку в ткани печени наблюдается самая низкая концентрация BCKDK, активность BCKDC считается самой высокой, что указывает на тот факт, что киназа BCKD обратно пропорционально влияет на активность BCKDC[7].
Клиническое значение
[править | править код]Нарушения в активности BCKDС часто приводят к патологическим состояниям, поэтому для её регуляции необходима киназа BCKD. В гене BCKDK часто происходят мутации, приводящие к отклонениям в работе фермента BCKDС. Чрезвычайно высокая активность комплекса BCKDС увеличивает катаболизм аминокислот с разветвлённой цепью и деградацию белка в скелетных мышцах, что является отличительной чертой кахексии. Дефицит активности BCKDC был основной причиной редкого метаболического заболевания — лейциноза, которая может привести к умственной отсталости, отёку мозга, судорогам, коме и смерти, если не проводить правильное лечение путём пожизненного ограничения потребления аминокислот с разветвлённой цепью[7]. Поскольку BCKDK регулирует BCKDС, который, в свою очередь, катализирует распад BCAA, BCKDK является одним из факторов, определяющих концентрацию уровней BCAA. Высокий уровень BCAA может привести к инсулинорезистентности и может быть потенциальным маркером сахарного диабета 2 типа[10]. Накопление BCAA также может привести к врождённым порокам сердца и сердечной недостаточности. Кроме того, низкие уровни BCAA были описаны как причина сопутствующей умственной отсталости, аутизма и эпилепсии[8].
Дефицит BCKDK, впервые описанный в 2012 году[11], является расстройством, которое можно рассматривать как "противоположность" болезни кленового сиропа, поскольку у пациентов снижен уровень аминокислот с разветвлённой цепью, а не повышен. Это заболевание характеризуется наличием признаков аутизма с эпилептиформными аномалиями на ЭЭГ и судорогами.
Примечания
[править | править код]- ↑ 1 2 3 GRCh38: Ensembl release 89: ENSG00000103507 - Ensembl, May 2017
- ↑ 1 2 3 GRCm38: Ensembl release 89: ENSMUSG00000030802 - Ensembl, May 2017
- ↑ Ссылка на публикацию человека на PubMed: Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ↑ Ссылка на публикацию мыши на PubMed: Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ↑ 1 2 Entrez Gene: BCKDK branched chain ketoacid dehydrogenase kinase.
- ↑ 1 2 Popov KM, Zhao Y, Shimomura Y, Kuntz MJ, Harris RA (Jul 1992). "Branched-chain alpha-ketoacid dehydrogenase kinase. Molecular cloning, expression, and sequence similarity with histidine protein kinases". The Journal of Biological Chemistry. 267 (19): 13127—30. doi:10.1016/S0021-9258(18)42179-5. PMID 1377677.
- ↑ 1 2 3 4 Muller EA, Danner DJ (Oct 2004). "Tissue-specific translation of murine branched-chain alpha-ketoacid dehydrogenase kinase mRNA is dependent upon an upstream open reading frame in the 5'-untranslated region". The Journal of Biological Chemistry. 279 (43): 44645—55. doi:10.1074/jbc.M406550200. PMID 15302860.
- ↑ 1 2 García-Cazorla A, Oyarzabal A, Fort J, Robles C, Castejón E, Ruiz-Sala P, Bodoy S, Merinero B, Lopez-Sala A, Dopazo J, Nunes V, Ugarte M, Artuch R, Palacín M, Rodríguez-Pombo P, Alcaide P, Navarrete R, Sanz P, Font-Llitjós M, Vilaseca MA, Ormaizabal A, Pristoupilova A, Agulló SB (Apr 2014). "Two novel mutations in the BCKDK (branched-chain keto-acid dehydrogenase kinase) gene are responsible for a neurobehavioral deficit in two pediatric unrelated patients". Human Mutation. 35 (4): 470—7. doi:10.1002/humu.22513. PMID 24449431. S2CID 205922143.
- ↑ Tso SC, Gui WJ, Wu CY, Chuang JL, Qi X, Skvora KJ, Dork K, Wallace AL, Morlock LK, Lee BH, Hutson SM, Strom SC, Williams NS, Tambar UK, Wynn RM, Chuang DT (Jul 2014). "Benzothiophene carboxylate derivatives as novel allosteric inhibitors of branched-chain α-ketoacid dehydrogenase kinase". The Journal of Biological Chemistry. 289 (30): 20583—93. doi:10.1074/jbc.M114.569251. PMC 4110271. PMID 24895126.
- ↑ 1 2 Tso SC, Qi X, Gui WJ, Chuang JL, Morlock LK, Wallace AL, Ahmed K, Laxman S, Campeau PM, Lee BH, Hutson SM, Tu BP, Williams NS, Tambar UK, Wynn RM, Chuang DT (Jun 2013). "Structure-based design and mechanisms of allosteric inhibitors for mitochondrial branched-chain α-ketoacid dehydrogenase kinase". Proceedings of the National Academy of Sciences of the United States of America. 110 (24): 9728—33. Bibcode:2013PNAS..110.9728T. doi:10.1073/pnas.1303220110. PMC 3683707. PMID 23716694.
- ↑ Novarino G, El-Fishawy P, Kayserili H, Meguid NA, Scott EM, Schroth J, Silhavy JL, Kara M, Khalil RO, Ben-Omran T, Ercan-Sencicek AG, Hashish AF, Sanders SJ, Gupta AR, Hashem HS, Matern D, Gabriel S, Sweetman L, Rahimi Y, Harris RA, State MW, Gleeson JG (October 2012). "Mutations in BCKD-kinase lead to a potentially treatable form of autism with epilepsy". Science. 338 (6105): 394—7. doi:10.1126/science.1224631. PMC 3704165. PMID 22956686.