Искусственная кость (Nvtrvvmfyuugx tkvm,)
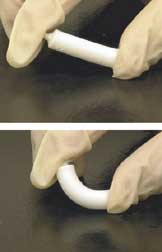
Искусственная кость относится к костеподобному материалу, созданному в лаборатории, который можно использовать в костных трансплантатах для замены человеческой кости, утраченной из-за тяжелых переломов, болезней и т. д[1].
Перелом кости, который представляет собой полный или частичный перелом кости, является очень распространенным заболеванием, которое регистрируется более чем в трех миллионах случаев в США в год[2]. Человеческие кости обладают способностью регенерировать за счет цикла резорбции кости и формирования кости. Клеткой, ответственной за резорбцию кости, является остеокласт, а клеткой, ответственной за формирование кости, является остеобласт. При этом человеческое тело может регенерировать сломанную кость. Однако, если повреждение кости вызвано болезнью или тяжелой травмой, организму становится трудно восстановиться. Когда человеческий организм не в состоянии регенерировать утраченную костную ткань, приходят хирурги и заменяют недостающую кость с помощью аутотрансплантатов, аллотрансплантатов и синтетических трансплантатов (искусственная кость). При сравнении искусственной кости с аутотрансплантатом и аллотрансплантатом она менее инвазивна и более биосовместима, поскольку позволяет избежать риска неизвестных вирусных инфекций[3].
При разработке имплантируемых биоматериалов ключевыми критериями являются биосовместимость, остеокондуктивность, высокая пористость и биомеханическая совместимость. Искусственная кость изначально изготавливалась из таких материалов, как металлы и твердая керамика, которые достаточно прочны, чтобы выдерживать нагрузку на кость. Однако жесткость этих материалов создавала огромную нагрузку на пациентов и не соответствовала критериям имплантации биоматериалов. Искусственные кости, изготовленные из металла и керамики, как правило, имеют плохую биосовместимость, поскольку их трудно смешать с костной тканью[4]. Таким образом, чтобы лучше помочь тем, кто нуждается в более комфортной жизни, инженеры разрабатывают новые методы производства и проектирования более совершенной искусственной костной структуры и материала.
Двумя основными компонентами кости являются гидроксиапатит [Ca10(PO4)6(OH)2] и коллагеновые волокна. Гидроксиапатит, одна из наиболее стабильных форм фосфата кальция, составляет от 60 до 65 процентов кости[5]. Остальная часть кости состоит из материалов, включая хондроитинсульфат, кератансульфат и липиды[5]. Расширение исследований и знаний об организации, структуре свойств коллагена и гидроксиапатита привело ко многим разработкам каркасов на основе коллагена в инженерии костной ткани. Структура гидроксиапатита очень похожа на структуру исходной кости, а коллаген может действовать как молекулярные кабели и дополнительно улучшать биосовместимость имплантата[6].
Обзор
[править | править код]Демография травм костей
[править | править код]В Соединенных Штатах ежегодно регистрируется более 6,5 миллионов дефектов костей и более 3 миллионов случаев травм лица. Ежегодно в мире проводится более 2,2 миллиона операций по пересадке кости. Распространенными причинами костного трансплантата являются резекция опухоли, врожденные пороки развития, травмы, переломы, хирургическое вмешательство, остеопороз и артрит[2]. Согласно Национальному обзору амбулаторной медицинской помощи (NAMCS), в 2010 г. было зарегистрировано около 63 миллионов посещений отделений ортопедической хирургии и около 3,5 миллионов посещений по поводу переломов в отделениях неотложной помощи в США. Среди 6,5 миллионов случаев переломов костей или дефектов, примерно 887 679 человек были госпитализированы[7].
Актуальные направления костной пластики (виды костей, композиты)
[править | править код]Исследования типов материалов для костной пластики традиционно были сосредоточены на производстве композитов органических полисахаридов ( хитин, хитозан, альгинат ) и минералов ( гидроксиапатит ). Альгинатные каркасы, состоящие из сшитых ионов кальция, активно изучаются в регенерации кожи, печени и костей[8]. Способность альгината образовывать каркас и делает его новым полисахаридом. Несмотря на то, что многие минералы могут быть адаптированы к составу кости, гидроксиапатит остается доминирующим материалом, поскольку его прочность и известная модель человеческой кости Ягера-Фратцля обеспечивают уже существующую основу для размещения и изготовления.
Типы материалов
[править | править код]
Материалы, подходящие для использования в искусственных костях, должны быть биосовместимыми, остеокондуктивными и механически прочными[9].Гидроксиапатит часто используется в исследованиях искусственной кости, потому что он обладает биосовместимостью и остеокондуктивностью, необходимыми для эффективного и долговечного костного имплантата, но является довольно хрупким[5] и, кроме того, демонстрирует скорость растворения около 10 мас.% в год, что составляет значительно медленнее, чем скорость роста новообразованной кости, что требует принятия мер по увеличению скорости ее растворения[10]. Для применений, требующих материала с большей прочностью, можно использовать наноструктурированный искусственный перламутр из-за его высокой прочности на растяжение и модуля Юнга[11]. Во многих случаях использование одного типа материала ограничивает возможности искусственного костного имплантата, поэтому применяют композиты. Имплантаты, состоящие из хитозана и гидроксиапатита, используют биосовместимость хитозана и его способность формировать сложные пористые формы, а также остеокондуктивность гидроксиапатита для создания композита, обладающего всеми тремя характеристиками[5]. Другие композиты, подходящие для использования в искусственных костях, включают в себя альгинат, биополимер, известный своими свойствами формирования каркаса. Использование альгината в композитах включает хитозановые композиты для восстановления костной ткани, композиты из биостекла для восстановления или замены дефектной или больной кости или керамически-коллагеновые композиты для регенерации кости[12]. Материал, используемый в искусственном костном имплантате, в конечном итоге зависит от типа создаваемого имплантата и его использования.
3D-печать искусственных костей
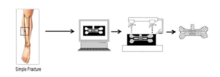
[править | править код]3D-печать становится эффективным способом производства искусственных костей. Сначала создается модель кости путем реконструкции изображений компьютерной томографии, полученных от пациента. Затем искусственные костные материалы используются в качестве «филамента» для 3D-печати. В соответствии с разрешением трансплантатов трехмерная модель кости будет разделена на несколько слоев. Принтер печатал слой, затем следующий за последним и, наконец, производил искусственную кость. Большинство недавних исследований показывают, что нанокристаллы гидроксиапатита (ГА) являются идеальным материалом для 3D-печатных искусственных костей. Нанокристаллы ГК синтезируют мокрым синтезом с использованием диаммонийфосфата и хлорида кальция в качестве предшественников фосфора и кальция соответственно[13]. Кроме того, поликапролактон (PCL) также может использоваться для 3D-печати при производстве искусственной кости в некоторых исследовательских отчетах. По сравнению с восстановлением поврежденных костей технология 3D-печати может производить имплантаты, отвечающие индивидуальным потребностям в ремонте. С другой стороны, методы 3D-печати производят имплантаты с минимальными побочными эффектами для пациентов. Клетки-хозяева различных классификаций, такие как лимфоциты и эритроциты, проявляют минимальную иммунологическую реакцию на искусственные трансплантаты[14].
Преимущества
[править | править код]Свойства материала
[править | править код]Эффективные материалы для замещения кости должны обладать хорошей механической прочностью наряду с адекватной биологической активностью. Биоактивность, которую часто оценивают по скорости растворения и образованию минерального слоя на поверхности имплантата in vivo, можно повысить в биоматериалах, в частности в гидроксиапатите, путем модификации состава и структуры путем легирования[15]. В качестве альтернативы системам гидроксиаптатита, композиты хитозана были тщательно изучены как один из материалов, который можно использовать для искусственной кости[9]. Хитозан сам по себе может быть легко преобразован в сложные формы, которые включают пористые структуры, что делает его пригодным для роста клеток и остеокондукции[5]. Кроме того, хитозановые каркасы биосовместимы и биоразлагаемы, но имеют низкую прочность, а сам материал не является остеокондуктивным[5].Гидроксиапатит, с другой стороны, обладает отличной биосовместимостью, но ему мешает его хрупкость[16]. При использовании гидроксиапатита в качестве композита значительно улучшаются как прочность, так и остеокондуктивность, что делает композит пригодным для использования в качестве материала для искусственной кости[5]. Хитозан также можно использовать с углеродными нанотрубками, которые имеют высокий модуль Юнга (1,0–1,8 ТПа), прочность на растяжение (30–200 ГПа), удлинение при разрыве (10–30%) и соотношение сторон (> 1000)[5]. Углеродные нанотрубки очень малы по размеру, химически и структурно стабильны и биоактивны[5]. Композит, образованный углеродными нанотрубками и хитозаном, значительно повышает прочность хитозана[5]. Наноструктурированный искусственный перламутр — еще один вариант создания искусственной кости[17]. Натуральный перламутр состоит из органических и неорганических слоев, подобных кирпичу и раствору[12]. Это, наряду с ионным сшиванием плотно свернутых молекул, позволяет перламутру иметь высокую прочность и ударную вязкость.[8]. Искусственный перламутр, который имитировал как структуру, так и эффект ионных связей, имел прочность на растяжение, аналогичную натуральному перламутру, а также предельный модуль Юнга, аналогичный пластинчатой кости[11]. С механической точки зрения этот материал был бы жизнеспособным вариантом для искусственной кости.
Рассмотрение дизайна
[править | править код]Клинические результаты
[править | править код]Несколько аспектов любой конструкции искусственной кости должны быть рассмотрены перед внедрением конструкции у пациента. Искусственные костные имплантаты, которые плохо помещаются внутри пациента из-за таких событий, как отсутствие фиксации реципиентной кости, могут вызвать покраснение и отек в реципиентной области[18] .Плохая посадка имплантатов также может быть вызвана спеканием, которое может привести к уменьшению размеров имплантата до 27%. [19] Остеокондуктивность является еще одним важным фактором при проектировании искусственной кости. Спеченные материалы увеличивают кристалличность фосфата кальция в некоторых искусственных костях, что приводит к плохой резорбции остеокластами и нарушению биоразлагаемости [19]. В одном исследовании этого удалось избежать, создав изготовленные на заказ искусственные кости с помощью струйной печати, в которых использовался α-трикальцийфосфат (TCP), материал, который превращается в гидроксиапатит и затвердевает имплантат без использования спекания.[19]. Кроме того, α-TCP является биосовместимым и помогает формировать новую кость, что лучше для пациентов в долгосрочной перспективе[3]. Искусственные костные конструкции должны быть биосовместимыми, обладать остеокондуктивностью и сохраняться внутри пациента в течение длительного периода времени, чтобы быть жизнеспособным решением по сравнению с аутологичными и аллогенными костными имплантатами.
Проблемы
[править | править код]Свойства поверхности
[править | править код]Искусственные трансплантаты сохраняют сравнимую прочность на сжатие, но иногда им не хватает сходства с человеческой костью в ответ на боковые силы или силы трения[20]. В частности, топография искусственной кости неточна по сравнению с ее естественным аналогом. По данным Grant et al., искусственные костные трансплантаты, полученные методом наплавки, имели в среднем на 20% более низкий коэффициент трения по сравнению с настоящей костью[20]. В то время как компьютерная томография и последующие модели костей очень точно указывают на настоящую кость для внутреннего состава, конечный продукт зависит от разрешения принтера. В тех случаях, когда возникают дефекты принтера, наиболее вероятной проблемой является снижение прочности на сжатие из-за непреднамеренных пустот[21]. После имплантации наблюдается снижение клеточной пролиферации и дифференцировки по мере увеличения количества пациентов с возрастом. Это продлевает интеграцию трансплантатов и препятствует формированию костной ткани. В моделях на животных включение аллотрансплантатов вызывает образование тератомы . Будет ли значительно увеличена вероятность этого события, еще неизвестно[22]. Таким образом, строительные леса с другими биологическими агентами необходимы для имитации каркаса тела. Коллаген типа I, который составляет значительную часть органической массы кости, является часто используемым каркасным агентом. Альтернативно, полимерный хитозан обладает аналогичной биологической реакцией, а именно стимулированием остеогенеза in vivo[2].
Ограничения изготовления
[править | править код]Более современные технологии изготовления включают струйную печать[23] . В одном исследовании струйный 3D-принтер изготовил аутотрансплантаты для нижней челюсти 10 пациентов. Имплантат из гидроксиапатита был изготовлен из порошка трикальцийфосфата, который затвердел после гидратации[23]. Хирургическая процедура проводилась как по эстетическим, так и по функциональным причинам. Все пациенты отметили удовлетворенность костным продуктом. В другом исследовании, в котором изучались копии бедренных костей козы, нанокристаллы гидроксиапатита были изготовлены и смешаны на месте перед загрузкой в 3D-принтер. В исследовании отмечено небольшое снижение прочности на сжатие бедренных костей, что может быть связано с несовершенной печатью и повышенным коэффициентом губчатой кости . В целом, методы 3D-печати производят имплантаты с небольшими побочными эффектами для пациентов. Клетки-хозяева различных классификаций, такие как лимфоциты и эритроциты, демонстрировали минимальную иммунологическую реакцию на искусственные трансплантаты[22]. Только в случае неправильной стерилизации или предшествующей предрасположенности к инфекции возникали какие-либо существенные осложнения. Скорость печати является основным фактором, ограничивающим скорость производства искусственных костей. В зависимости от типа костного имплантата время печати может варьироваться от часа до нескольких.[21]. Поскольку принтеры производят трансплантаты с более высоким разрешением, продолжительность печати увеличивается пропорционально.
Биологическая реакция
[править | править код]Исследования искусственных костных материалов показали, что биоактивные и резорбируемые силикатные стекла ( биостекло ), стеклокерамика и фосфаты кальция обладают механическими свойствами, сходными с человеческой костью[24]. Подобные механические свойства не гарантируют биосовместимости. Биологическая реакция организма на эти материалы зависит от многих параметров, включая химический состав, топографию, пористость и размер зерна[24]. Если материал металлический, существует риск коррозии и заражения. Если материал керамический, ему трудно придать нужную форму, а кость не может реабсорбировать или заменить его из-за его высокой кристалличности[18]. Гидроксиапатит, с другой стороны, показал превосходные свойства в поддержке адгезии, дифференцировки и пролиферации клеток остеогенеза, поскольку он термодинамически стабилен и биоактивен[24]. Искусственные кости с использованием гидроксиапатита в сочетании с коллагеновой тканью помогают формировать новые кости в порах и имеют сильное сродство к биологическим тканям, сохраняя при этом однородность с соседней костной тканью[3]. Несмотря на отличные характеристики взаимодействия с костной тканью, гидроксиапатит имеет те же проблемы с реабсорбцией, что и керамика, из-за своей высокой кристалличности. Поскольку гидроксиапатит обрабатывается при высокой температуре, маловероятно, что он останется в стабильном состоянии[3].
Использованная литература
[править | править код]- ↑ ARTIFICIAL BONE GRAFTS: PRO OSTEON. Arthroscopy.com. Дата обращения: 16 ноября 2013. Архивировано из оригинала 4 апреля 2013 года.
- ↑ 1 2 3 Kashte, Shivaji (2017). "Shivaji Kashte, Amit Kumar Jaiswal, Sachin Kadam. (2017). Artificial Bone via Bone Tissue Engineering: Current Scenario and Challenges". Tissue Engineering and Regenerative Medicine. 14 (1): 1—14. doi:10.1007/s13770-016-0001-6. PMID 30603457.
- ↑ 1 2 3 4 Saijo, Hideto (2016). "Saijo, H., Fujihara Y., Kanno Y., Hoshi K., Hikita A., Chung U., Takato T. (2016). Clinical Experience of full custom-made artificial bones for the maxillofacial region". Regenerative Therapy. 5: 72—78. doi:10.1016/j.reth.2016.08.004. PMID 31245504.
- ↑ Creating Artificial Bones for Faster Bone Regeneration. Tokyo Institute of Technology. Дата обращения: 20 апреля 2018. Архивировано 28 апреля 2018 года.
- ↑ 1 2 3 4 5 6 7 8 9 10 Venkatesan, Jayachandran (2010). "Venkatesan, J., & Kim, S.-K. (2010). Chitosan Composites for Bone Tissue Engineering—An Overview". Marine Drugs. 8 (8): 2252—2266. doi:10.3390/md8082252. PMID 20948907.
{{cite journal}}: Википедия:Обслуживание CS1 (не помеченный открытым DOI) (ссылка) - ↑ Ferreira, Ana Marina (2012). "Ferreira, A. M., Gentile, P., Chiono, V., & Ciardelli, G. (2012). Collagen for bone tissue regeneration". Acta Biomaterialia. 8 (9): 3191—3200. doi:10.1016/j.actbio.2012.06.014. PMID 22705634.
- ↑ NAMCS: Factsheet-ORTHOPEDIC SURGERY. Centers for disease control and prevention. Дата обращения: 20 апреля 2018. Архивировано 21 июля 2019 года.
- ↑ 1 2 Venkatesan, Jayachandran (2015). "Venkatesan, J., Bhatnagar, I., Manivasagan, P., Kang, K., & Kim, S. (2015). Alginate composites for bone tissue engineering: A review". International Journal of Biological Macromolecules. 72: 269—281. doi:10.1016/j.ijbiomac.2014.07.008. PMID 25020082.
- ↑ 1 2 Venkatesan, Jayachandran (2010). "Venkatesan, J., & Kim, S.-K. (2010). Chitosan Composites for Bone Tissue Engineering—An Overview". Marine Drugs. 8 (8): 2252—2266. doi:10.3390/md8082252. PMID 20948907.
{{cite journal}}: Википедия:Обслуживание CS1 (не помеченный открытым DOI) (ссылка)Venkatesan, Jayachandran; Kim, Se-Kwon (2010). "Venkatesan, J., & Kim, S.-K. (2010). Chitosan Composites for Bone Tissue Engineering—An Overview". Marine Drugs. 8 (8): 2252–2266. doi:10.3390/md8082252. PMC 2953403. PMID 20948907. - ↑ Zhu, H. (2018). "Nanostructural insights into the dissolution behavior of Sr-doped hydroxyapatite". Journal of the European Ceramic Society. 38 (16): 5554—5562. arXiv:1910.10610. doi:10.1016/j.jeurceramsoc.2018.07.056.
- ↑ 1 2 Tang, Zhiyong (2003). "Tang, Z., Kotov, N. A., Magonov, S., & Ozturk, B. (2003). Nanostructured artificial nacre". Nature Materials. 2 (6): 413—418. doi:10.1038/nmat906. PMID 12764359.
- ↑ 1 2 Venkatesan, Jayachandran (2015). "Venkatesan, J., Bhatnagar, I., Manivasagan, P., Kang, K., & Kim, S. (2015). Alginate composites for bone tissue engineering: A review". International Journal of Biological Macromolecules. 72: 269—281. doi:10.1016/j.ijbiomac.2014.07.008. PMID 25020082.Venkatesan, Jayachandran; Bhatnagar, Ira; Manivasagan, Panchanathan; Kang, Kyong-Hwa; Kim, Se-Kwon (2015). "Venkatesan, J., Bhatnagar, I., Manivasagan, P., Kang, K., & Kim, S. (2015). Alginate composites for bone tissue engineering: A review". International Journal of Biological Macromolecules. 72: 269–281. doi:10.1016/j.ijbiomac.2014.07.008. PMID 25020082.
- ↑ Fan, Chunquan (2010). "Fan, C., Li, J., Xu, G., He, H., Ye, X., Chen, Y., Sheng, X., Fu, J., He, D. (2010). Facile fabrication of nano-hydroxyapatite/silk fibroin composite via a simplified coprecipitation route". Journal of Materials Science. 45 (21): 5814—5819. doi:10.1007/s10853-010-4656-4.
- ↑ Kashte, Shivaji (2017). "Shivaji Kashte, Amit Kumar Jaiswal, Sachin Kadam. (2017). Artificial Bone via Bone Tissue Engineering: Current Scenario and Challenges". Tissue Engineering and Regenerative Medicine. 14 (1): 1—14. doi:10.1007/s13770-016-0001-6. PMID 30603457.
- ↑ Zhu, H. (2018). "Nanostructural insights into the dissolution behavior of Sr-doped hydroxyapatite". Journal of the European Ceramic Society. 38 (16): 5554—5562. arXiv:1910.10610. doi:10.1016/j.jeurceramsoc.2018.07.056.Zhu, H.; et al. (2018). "Nanostructural insights into the dissolution behavior of Sr-doped hydroxyapatite". Journal of the European Ceramic Society. 38 (16): 5554–5562. arXiv:1910.10610. doi:10.1016/j.jeurceramsoc.2018.07.056. S2CID 105932012.
- ↑ Zhou, Hongjian (2011). "Zhou, H., & Lee, J. (2011). Nanoscale hydroxyapatite particles for bone tissue engineering". Acta Biomaterialia. 7 (7): 2769—2781. doi:10.1016/j.actbio.2011.03.019. PMID 21440094.
- ↑ Tang, Zhiyong (2003). "Tang, Z., Kotov, N. A., Magonov, S., & Ozturk, B. (2003). Nanostructured artificial nacre". Nature Materials. 2 (6): 413—418. doi:10.1038/nmat906. PMID 12764359.Tang, Zhiyong; Kotov, Nicholas A.; Magonov, Sergei; Ozturk, Birol (2003). "Tang, Z., Kotov, N. A., Magonov, S., & Ozturk, B. (2003). Nanostructured artificial nacre". Nature Materials. 2 (6): 413–418. doi:10.1038/nmat906. PMID 12764359. S2CID 6192932.
- ↑ 1 2 Saijo, Hideto (2016). "Saijo, H., Fujihara Y., Kanno Y., Hoshi K., Hikita A., Chung U., Takato T. (2016). Clinical Experience of full custom-made artificial bones for the maxillofacial region". Regenerative Therapy. 5: 72—78. doi:10.1016/j.reth.2016.08.004. PMID 31245504.Saijo, Hideto; Fujihara, Yuko; Kanno, Yuki; Hoshi, Kazuto; Hikita, Atsuhiko; Chung, Ung-il; Takato, Tsuyoshi (2016). "Saijo, H., Fujihara Y., Kanno Y., Hoshi K., Hikita A., Chung U., Takato T. (2016). Clinical Experience of full custom-made artificial bones for the maxillofacial region". Regenerative Therapy. 5: 72–78. doi:10.1016/j.reth.2016.08.004. PMC 6581837. PMID 31245504.
- ↑ 1 2 3 Saijo, Hideto (2009). "Saijo H, Igawa K, Kanno Y, Mori Y, Kondo K, Shimizu K, Suzuki S, Chikazu D, Iino M, Anzai M, Sasaki N, Chung UI, Takato T. (2009). Maxillofacial reconstruction using custom-made artificial bones fabricated by inkjet printing technology". Journal of Artificial Organs. 12 (3): 200—205. doi:10.1007/s10047-009-0462-7. PMID 19894095.
- ↑ 1 2 Grant, J.A. (2007). "Grant, J., Bishop, N., Götzen, N., Sprecher, C., Honl, M., & Morlock, M. (2007). Artificial composite bone as a model of human trabecular bone: The implant-bone interface". Journal of Biomechanics. 40 (5): 1158—1164. doi:10.1016/j.jbiomech.2006.04.007. PMID 16806236.
- ↑ 1 2 Saijo, Hideto (2009). "Saijo H, Igawa K, Kanno Y, Mori Y, Kondo K, Shimizu K, Suzuki S, Chikazu D, Iino M, Anzai M, Sasaki N, Chung UI, Takato T. (2009). Maxillofacial reconstruction using custom-made artificial bones fabricated by inkjet printing technology". Journal of Artificial Organs. 12 (3): 200—205. doi:10.1007/s10047-009-0462-7. PMID 19894095.Saijo, Hideto; Igawa, Kazuyo; Kanno, Yuki; Mori, Yoshiyuki; Kondo, Kayoko; Shimizu, Koutaro; Suzuki, Shigeki; Chikazu, Daichi; Iino, Mitsuki; Anzai, Masahiro; Sasaki, Nobuo; Chung, Ung-il; Takato, Tsuyoshi (2009). "Saijo H, Igawa K, Kanno Y, Mori Y, Kondo K, Shimizu K, Suzuki S, Chikazu D, Iino M, Anzai M, Sasaki N, Chung UI, Takato T. (2009). Maxillofacial reconstruction using custom-made artificial bones fabricated by inkjet printing technology". Journal of Artificial Organs. 12 (3): 200–205. doi:10.1007/s10047-009-0462-7. PMID 19894095. S2CID 35626675.
- ↑ 1 2 Kashte, Shivaji (2017). "Shivaji Kashte, Amit Kumar Jaiswal, Sachin Kadam. (2017). Artificial Bone via Bone Tissue Engineering: Current Scenario and Challenges". Tissue Engineering and Regenerative Medicine. 14 (1): 1—14. doi:10.1007/s13770-016-0001-6. PMID 30603457.Kashte, Shivaji; Jaiswal, Amit Kumar; Kadam, Sachin (2017). "Shivaji Kashte, Amit Kumar Jaiswal, Sachin Kadam. (2017). Artificial Bone via Bone Tissue Engineering: Current Scenario and Challenges". Tissue Engineering and Regenerative Medicine. 14 (1): 1–14. doi:10.1007/s13770-016-0001-6. PMC 6171575. PMID 30603457.
- ↑ 1 2 Xu, Ning (2014). "Xu, N., Ye, X., Wei, D., Zhong, J., Chen, Y., Xu, G., & He, D. (2014). 3D Artificial Bones for Bone Repair Prepared by Computed Tomography-Guided Fused Deposition Modeling for Bone Repair". ACS Applied Materials & Interfaces. 6 (17): 14952—14963. doi:10.1021/am502716t. PMID 25133309.
- ↑ 1 2 3 Hoppe, Alexander (2011). "Hoppe, A., Güldal, N. S., & Boccaccini, A. R. (2011).A review of the biological response to ionic dissolution products from bioactive glasses and glass-ceramics". Biomaterials. 32 (11): 2757—2774. doi:10.1016/j.biomaterials.2011.01.004. PMID 21292319.