Дитиодихлорид (:nmnk;n]lkjn;)
| Дитиодихлорид | |
|---|---|
  Хлорид серы(I) в круглодонной колбе Хлорид серы(I) в круглодонной колбе | |
 | |
| Общие | |
| Традиционные названия | дихлорид дисеры, дихлордисульфан |
| Хим. формула | S2Cl2 |
| Рац. формула | S2Cl2 |
| Физические свойства | |
| Молярная масса | 135,04 г/моль |
| Плотность | 1,688 г/см³ |
| Энергия ионизации | 9,4 ± 0,1 эВ[1] |
| Термические свойства | |
| Температура | |
| • плавления | −80 °C |
| • кипения | 137,1 °C |
| • вспышки | 245 ± 1 ℉[1] |
| Давление пара | 7 мм рт. ст. |
| Оптические свойства | |
| Показатель преломления | 1,658 |
| Структура | |
| Дипольный момент | 1,06 Д |
| Классификация | |
| Рег. номер CAS | 10025-67-9 |
| PubChem | 24807 |
| Рег. номер EINECS | 233-036-2 |
| SMILES | |
| InChI | |
| RTECS | WS4300000 |
| Номер ООН | 3390 |
| ChemSpider | 23192 |
| Безопасность | |
| Токсичность | Ирритант, оказывает сильное раздражающее действие на глаза и верхние дыхательные пути. |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Дитиодихлори́д (дихлорид дисеры, дихлордисульфан) — бинарное неорганическое соединение хлора и серы с формулой S2Cl2, может рассматриваться как хлорпроизводное дисульфана (HS)2. При нормальных условиях — прозрачная маслянистая жидкость желтовато-оранжевого цвета, несильно дымящая на воздухе с резким удушливым запахом, напоминающим запах жженной резины и хвойного эфирного масла. Хорошо растворим в диэтиловом эфире, бензоле, этаноле. Гидролизуется водой.
Синтез и реакционная способность
[править | править код]Дитиодихлорид получают хлорированием расплавленной серы:
в качестве побочного продукта при хлорировании при избытке хлора также образуется дихлорид серы:
Сырой дитиодихлорид может быть окрашен в жёлтый цвет растворённой серой либо в красный — примесью дихлорида серы.
Дитиодихлорид также является побочным продуктом в первой стадии синтеза тиофосгена хлорированием сероуглерода[2]:
Атомы серы дитиодихлорида являются электрофильными центрами и для него характерны реакции нуклеофильного замещения хлора.
Дитиодихлорид медленно гидролизуется водой с образованием хлороводорода, диоксида серы и сероводорода, которые реагируют in situ с образованием сначала тиосернистой кислоты и затем при взаимодействии тиосернистой кислоты с диоксидом серы — нестабильных политионовых кислот:
При взаимодействии с аммиаком[3] или хлоридом аммония[4] дитиодихлорид образует тетранитрид тетрасеры каркасной структуры:
Взаимодействие дитиодихлорида со вторичными аминами при низких температурах ведет к образованию N,N-дитио-бис-аминов[5]:
Реакции с аминами зачастую осложняются внутримолекулярной циклизацией с участием второго атома серы.
Дитиодихлорид присоединяется к алкенам и алкинам, образуя с хорошим выходом симметричные α-хлоралкилдисульфиды[6]:
С активированными ароматическими и гетероароматическими соединениями идёт реакция замещения, в результате которой также образуются дисульфиды[7]:
Менее реакционноспособные ароматические углеводороды реагируют с дитиодихлоридом в присутствии хлорида алюминия. Так, реакция с бензолом сопровождается отщеплением серы и ведет к образованию дифенилсульфида[8]:
Применение
[править | править код]В промышленности дитиодихлорид используется для производства дихлорида серы (и хлористого тионила, получаемого из дихлорида серы), тетрафторида серы.
Растворы серы в дитиодихлориде применяются для вулканизации каучуков в резины при низких температурах. Продукты конденсации дитиодихлорида с полиолами применяются в качестве добавок к смазочным маслам.
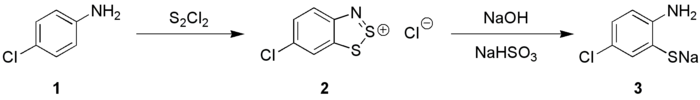
Взаимодействие дитиодихлорида с ароматическими аминами (1), ведущее к образованию циклических 1,2,3-бензодитиазолиевых солей (2) и их последующим гидролизом является препаративным методом синтеза 2-меркаптоанилинов являющихся сырьем в производстве тиоиндигоидных красителей (3, реакция Херца):
Примечания
[править | править код]- ↑ 1 2 http://www.cdc.gov/niosh/npg/npgd0578.html
- ↑ Grayson, J. Ian. Industrial Scale Synthesis of Thiophosgene and Its Derivatives (англ.) // Org. Process Res. Dev.[англ.] : journal. — 1997. — Vol. 1, no. 3. — P. 240—246. — ISSN 1083-6160. — doi:10.1021/op970002c.
- ↑ Villena-Blanco, M.;Jolly, W.L.; Tyree. Tetrasulfur Tetranitride, S4N4 (эст.) // Inorg. Synth.[англ.]. — 1967. — K. 9. — L. 98—102. — doi:10.1002/9780470132401.ch26.
- ↑ Jolly, William L.; Margot Becke-Goehring. The Synthesis of Tetrasulfur Tetranitride and Trisulfur Dinitrogen Dioxide (англ.) // Inorg. Chem.[англ.] : journal. — 1962. — Vol. 1, no. 1. — P. 76—78. — ISSN 0020-1669. — doi:10.1021/ic50001a014.
- ↑ Katritzky, Alan R.; Steven V. Ley, Otto Meth-Cohn, Charles Wayne Rees. Comprehensive Organic Functional Group Transformations: Synthesis: carbon with one heteroatom attached by a single bond (англ.). — Elsevier, 1995. — P. 361. — ISBN 9780080423234.
- ↑ Katritzky, Alan R.; Steven V. Ley, Otto Meth-Cohn, Charles Wayne Rees. Comprehensive Organic Functional Group Transformations: Synthesis: carbon with one heteroatom attached by a single bond (англ.). — Elsevier, 1995. — P. 226. — ISBN 9780080423234.
- ↑ Katritzky, Alan R.; Steven V. Ley, Otto Meth-Cohn, Charles Wayne Rees. Comprehensive Organic Functional Group Transformations: Synthesis: carbon with one heteroatom attached by a single bond (англ.). — Elsevier, 1995. — P. 226. — ISBN 9780080423234.
- ↑ Hartman, W. W.; Smith, L. A.; Dickey, J. B. Diphenyl sulfide. Organic Syntheses, Coll. Vol. 2, p.242 (1943); Vol. 14, p.36 (1934). Дата обращения: 4 января 2012. Архивировано из оригинала 6 октября 2012 года.
Литература
[править | править код]- Г. Реми. Курс неорганической химии, т.1, -М, 1963, 921 стр