АЛК-синтаза (GLT-vnumg[g)
| АЛК-синтаза | |
|---|---|
 Димер АЛК-синтазы, Rhodobacter capsulatus | |
| Идентификаторы | |
| Шифр КФ | 2.3.1.37 |
| Номер CAS | 9037-14-3 |
| Базы ферментов | |
| IntEnz | IntEnz view |
| BRENDA | BRENDA entry |
| ExPASy | NiceZyme view |
| MetaCyc | metabolic pathway |
| KEGG | KEGG entry |
| PRIAM | profile |
| PDB structures | RCSB PDB PDBe PDBj PDBsum |
| Поиск | |
| PMC | статьи |
| PubMed | статьи |
| NCBI | NCBI proteins |
| CAS | 9037-14-3 |
АЛК-синтаза, также синтаза аминолевулиновой кислоты (англ. ALA synthase, ALAS) — фермент (КФ 2.3.1.37), из семейства ацилтрансферазы (класс трансфераз), встречается у нерастительных организмов (животных и α-протеобактерий) и катализирует реакцию синтеза δ-аминолевулиновой кислоты (дАЛК или АЛК) из глицина и сукцинил-КоА, путём их конденсации:
- сукцинил-КоА + глицин δ-аминолевулиновая кислота + КоА + CO2.
В качестве кофермента используется молекула пиридоксаль-5'-фосфат (PLP).
Реакцию, которую он катализирует, иногда называют шеминовым путём образования АЛК[1]. Другие организмы — растения, археи и бактерии (кроме α-протеобактерий) продуцируют АЛК с помощью трёх ферментативных путей, известных как С5-пути (так называемый путь Биля)[2]. Аминолевулиновая кислота служит одним из важнейших промежуточных метаболитов в синтезе тетрапирролов — порфиринов (у животных) и корринов (у бактерий) и хлорофиллов (у растений)[3].
У человека транскрипция AЛК-синтазы строго контролируются присутствием Fe2+-связывающих элементов (IRE), чтобы предотвратить накопление промежуточных соединений порфирина в отсутствие железа. В организме существуют две формы АЛК-синтазы. Одна форма экспрессируется в клетках-предшественниках эритроцитов (ALAS2, эритроцитарная), тогда как другая (ALAS1, убиквитарная), экспрессируется во всех тканях и органах тела. Эритроцитарная форма фермента кодируется одноимённым геном ALAS2, который локализован на X-хромосоме[4][5][6], тогда как убиквитарная форма (ALAS1) кодируется геном, расположенным на 3-й хромосоме[4][6]. Матричные РНК обеих форм имеют сходство на 60 %. Длина полипептидной цепи эритроцитарной формы АЛК-синтазы (ALAS2) составляет 587 аминокислотных остатков, а молекулярная масса — 64633 Да. Длина полипептидной цепи убиквитарной формы АЛК-синтазы (ALAS1) составляет 640 аминокислотных остатков, а молекулярная масса соответственно — 70581 Да.
Структура
[править | править код]PLP-зависимые ферменты широко распространены, поскольку они необходимы для превращения аминокислот в другие метаболиты[3]. ALAS представляет собой гомодимер с субъединицами аналогичного размера, а активные центры состоят из боковых цепей аминокислот, таких как аргинин, треонин и лизин, существуют на границе раздела субъединиц[3]. Белок, извлечённый из R. spheroids, содержит 1600 фолдов и весит около 80 000 дальтон[7]. Ферментативная активность различается в зависимости от источников фермента[7].
Механизм катализа
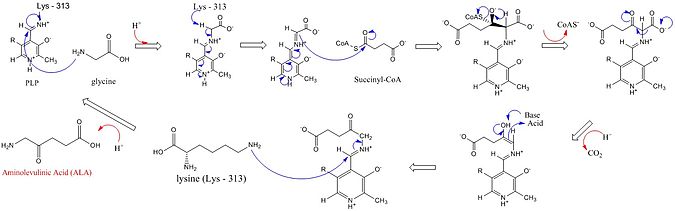
[править | править код]В активных центрах АЛК-синтаз используются три ключевые боковые цепи аминокислот: Arg-85, Thr-430 и Lys-313. Хотя было установлено, что эти три аминокислоты позволяют протекать этой реакции (синтез аминолевулината), но аминокислотная триада была бы неактивна без добавления кофермента пиридоксаль-5'-фосфата (PLP), роль которого в данном синтезе подробно показана на изображении ниже. Прежде чем произойдёт реакция, кофермент PLP связывается с боковой цепью лизина, образуя основание Шиффа, которое способствует атаке глициновым субстратом[8][9][10][11]. Лизин действует как общее основание во время этого механизма[3][12]. В подробном механизме реакции добавленные ионы гидроксония происходят из различных остатков, которые образуют водородные связи для облегчения синтеза АЛК[3]. АЛК-синтаза удаляет карбоксильную группу из глицина и КоА из сукцинил-КоА с помощью своего кофермента пиридоксальфосфата (производного витамина В6), образуя δ-аминолевулиновую кислоту (дАЛК), названную так потому, что аминогруппа находится на четвёртом атоме углерода в молекуле. Этот механизм реакции особенно уникален по сравнению с другими ферментами, которые используют кофактор PLP, потому что глицин изначально депротонируется высококонсервативным лизином в активном центре, что приводит к конденсации с сукцинил-КоА и потере КоА. Протонирование карбонильной группы интермедиата (промежуточного соединения) гистидином в активном центре приводит к потере карбоксильной группы. Последнее промежуточное соединение (интермедиат), наконец, репротонируется с образованием АЛК. Диссоциация АЛК от фермента является лимитирующей стадией ферментативной реакции и, как было показано, зависит от медленного конформационного изменения фермента. Функция пиридоксальфосфата заключается в облегчении удаления водорода за счёт использования электрофильного пиридиниевого кольца в качестве «поглотителя» электронов.
Локализация этого фермента в биологических системах указывает на обратную связь, которую он может получать. АЛК-синтаза обнаружена в бактериях, дрожжах, печени птиц и млекопитающих, клетках крови и костном мозге. В животных клетках АЛК-синтаза локализуется в матриксе митохондрий. Поскольку фермент, по-видимому, расположен рядом с источником сукцинил-КоА, а конец синтеза молекул гема указывает на то, что начальная и конечная точки биосинтеза гема служат обратной связью для АЛК-синтазы[7]. АЛК-синтаза также ингибируется гемином и глюкозой[13].

Функции
[править | править код]ALAS1 и ALAS2 катализируют первую стадию в процессе синтеза гема. Эта стадия является необратимой, которая также и скорость лимитирующая (самая медленная и определяющая скорость протекания всего процесса). Например, два субстрата, оксалоацетат и глицин, в высокой степени синтезируются и используются в других важных биологических процессах, таких как гликолиз и цикл Кребса. Изображение ниже иллюстрирует путь синтеза гема и роль, которую играет ALAS.

Заболевания
[править | править код]Дефицит АЛК-синтазы приводит к полному прекращению синтеза гема, поскольку главная функция данного фермента заключается в том, чтобы катализировать первый шаг в процессе синтеза молекул гема. Эти недостатки часто являются результатом генетической мутации, которая может привести к различным заболеваниям. Одним из таких заболеваний является сцепленная с Х-хромосомой сидеробластная анемия, которая приводит к появлению микроцитарных эритроцитов в костном мозге[14]. Это заболевание связано именно с мутациями в гене, кодирующий ALAS2[14].
Гиповитаминоз В6, редко встречается (например, при неправильном приёме противотуберкулёзных препаратов), однако, его наличие приводит к приобретённой форме сидеробластной анемии, так как необходимый для синтеза АЛК, пиридоксальфосфат находится в недостаточных концентрациях.
Примечания
[править | править код]- ↑ Shemin, David; Rittenberg, D (June 18, 1945). "The utilization of glycine for the synthesis of a porphyrin". Journal of Biological Chemistry. 159: 567–568.
- ↑ Beale S.I. Biosynthesis of the Tetrapyrrole Pigment Precursor, delta-Aminolevulinic Acid, from Glutamate (англ.) // Plant Physiology : journal. — American Society of Plant Biologists, 1990. — August (vol. 93, no. 4). — P. 1273—1279. — PMID 16667613. — PMC 1062668.
- ↑ 1 2 3 4 5 Hunter, Gregory A.; Ferreira, Gloria C. (November 2011). "Molecular enzymology of 5-Aminolevulinate synthase, the gatekeeper of heme biosynthesis". Biochimica et Biophysica Acta (BBA) - Proteins and Proteomics. 1814 (11): 1467—1473. doi:10.1016/j.bbapap.2010.12.015. PMC 3090494. PMID 21215825.
- ↑ 1 2 Bishop DF, Henderson AS, Astrin KH (Jun 1990). "Human delta-aminolevulinate synthase: assignment of the housekeeping gene to 3p21 and the erythroid-specific gene to the X chromosome". Genomics. 7 (2): 207—14. doi:10.1016/0888-7543(90)90542-3. PMID 2347585.
- ↑ Cotter PD, Willard HF, Gorski JL, Bishop DF (May 1992). "Assignment of human erythroid delta-aminolevulinate synthase (ALAS2) to a distal subregion of band Xp11.21 by PCR analysis of somatic cell hybrids containing X; autosome translocations" (PDF). Genomics. 13 (1): 211—2. doi:10.1016/0888-7543(92)90223-F. hdl:2027.42/30074. PMID 1577484.
- ↑ 1 2 Entrez Gene: Delta-aminolevulinate synthase 2. Архивировано 12 апреля 2010 года.
- ↑ 1 2 3 Beale, S I (June 1978). "δ-Aminolevulinic Acid in Plants: Its Biosynthesis, Regulation, and Role in Plastid Development". Annual Review of Plant Physiology. 29 (1): 95—120. doi:10.1146/annurev.pp.29.060178.000523.
- ↑ ALA synthase. flipper e nuvola. Turin University. Дата обращения: 10 марта 2016. Архивировано 28 января 2023 года.
- ↑ Shoolingin-Jordan, Peter M.; Al-Daihan, Sooad; Alexeev, Dmitriy; Baxter, Robert L.; Bottomley, Sylvia S.; Kahari, I.Donald; Roy, Ipsita; Sarwar, Muhammad; Sawyer, Lindsay; Wang, Shu-Fen (Apr 2003). "5-Aminolevulinic acid synthase: mechanism, mutations and medicine". Biochim Biophys Acta. 1647 (1—2): 361—6. doi:10.1016/s1570-9639(03)00095-5. PMID 12686158.
- ↑ CHOI, H (July 2004). "Cloning, expression, and characterization of 5-aminolevulinic acid synthase from Rhodopseudomonas palustris KUGB306". FEMS Microbiology Letters. 236 (2): 175—181. doi:10.1016/j.femsle.2004.05.048. PMID 15251194.
- ↑ Ferreira, Gloria C.; Neame, Peter J.; Dailey, Harry A. (November 1993). "Heme biosynthesis in mammalian systems: Evidence of a schiff base linkage between the pyridoxal 5′-phosphate cofactor and a lysine residue in 5-aminolevulinate synthase". Protein Science. 2 (11): 1959—1965. doi:10.1002/pro.5560021117. PMC 2142290. PMID 8268805.
- ↑ Hunter, Gregory A.; Ferreira, Gloria C. (March 1999). "Lysine-313 of 5-Aminolevulinate Synthase Acts as a General Base during Formation of the Quinonoid Reaction Intermediates". Biochemistry. 38 (12): 3711—3718. doi:10.1021/bi982390w. PMID 10090759.
- ↑ Doss M, Sixel-Dietrich F, Verspohl F (1985). ""Glucose effect" and rate limiting function of uroporphyrinogen synthase on porphyrin metabolism in hepatocyte culture: relationship with human acute hepatic porphyrias" (PDF). J Clin Chem Clin Biochem. 23 (9): 505—13. doi:10.1515/cclm.1985.23.9.505. PMID 4067519.
- ↑ 1 2 Ajioka, Richard S.; Phillips, John D.; Kushner, James P. (July 2006). "Biosynthesis of heme in mammals". Biochimica et Biophysica Acta (BBA) - Molecular Cell Research. 1763 (7): 723—736. doi:10.1016/j.bbamcr.2006.05.005. PMID 16839620.
Внешние ссылки
[править | править код]- NIH
- Abu-Farha M, Niles J, Willmore W (2005). "Erythroid-specific 5-aminolevulinate synthase protein is stabilized by low oxygen and proteasomal inhibition". Biochem Cell Biol. 83 (5): 620—30. doi:10.1139/o05-045. PMID 16234850.
- Shemin, D; Rittenberg, D (1945). "The Utilization of Glycine for the Synthesis of a Porphyrin". J. Biol. Chem. 159: 567—8.
- SIDEROBLASTIC ANEMIAS -ALAS-2 defect disease