T-трубочки (T-mjrQkctn)
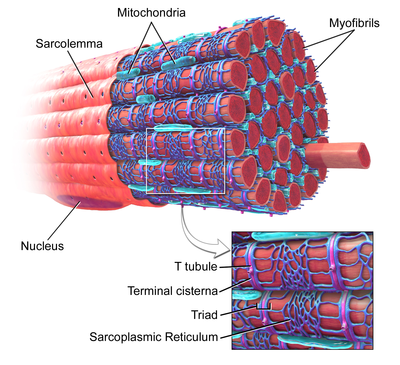
T-тру́бочки (англ. T-tubules от англ. transverse tubules — поперечные трубочки) — впячивания клеточной мембраны, доходящие до центральной части клеток скелетных и сердечной мышц. Мембрана T-трубочек содержит большое количество ионных каналов, транспортеров[англ.] и насосов, благодаря чему они обеспечивают быструю передачу потенциала действия и играют важную роль в регуляции внутриклеточной концентрации ионов кальция. Обеспечивая синхронное высвобождение кальция из внутриклеточных депо, T-трубочки обеспечивают более сильное сокращение миоцитов. При некоторых заболеваниях функция T-трубочек нарушается, что в случае сердечной мускулатуры может приводить к аритмии и сердечному приступу. T-трубочки были впервые описаны в 1897 году.
Структура
[править | править код]
T-трубочки представляют собой впячивания плазматической мембраны мышечной клетки (сарколеммы). В каждой мышечной клетке они образуют сеть трубочек, расположенных перпендикулярно или параллельно сарколемме. Внутренняя часть T-трубочек открывается отверстием на поверхности клетки, из-за чего T-трубочки наполнены той же жидкостью, которая окружает клетку. Мембрана T-трубочек содержит множество кальциевых каналов L-типа[англ.], натрий-кальциевых обменников, кальциевых АТФаз[англ.] и β-адренорецепторов[1].
В кардиомиоцитах предсердий и желудочков T-трубочки появляются в течение первых нескольких недель жизни[2]. У большинства видов они имеются в мышечных клетках желудочков, а у крупных млекопитающих — в мышечных клетках предсердий[3]. Диаметр T-трубочек в кардиомиоцитах составляет от 20 до 450 нм; как правило, T-трубочки располагаются в области Z-дисков, где заякориваются клеточные актиновые филаменты[1]. В кардиомиоцитах T-трубочки тесно связаны с внутриклеточным депо кальция — саркоплазматическим ретикулумом, а именно с его терминальными цистернами. Комплекс T-трубочки и терминальной цистерны называется диадой[англ.][4].
В скелетных мышцах T-трубочки имеют диаметр от 20 до 40 нм и обычно располагаются по обе стороны от полосы миозина, в месте соединения А- и I-полос. В мышцах T-трубочки связаны с двумя терминальными цистернами саркоплазматического ретикулума, этот комплекс получил название триады[англ.][1][5].
Форма T-трубочек поддерживается множеством белков. Белок амфифизин-2, кодируемый геном BIN1[англ.], отвечает за формирование T-трубочек и локализацию в них нужных белков, таких как кальциевые каналы L-типа[6]. Джунктофилин-2, кодируемый геном JPH2[англ.], участвует в формировании связи T-трубочки с саркоплазматическим ретикулумом, необходимого для синхронного сокращения саркомеров клетки. Телетонин[англ.], кодируемый геном TCAP, участвует в формировании T-трубочек и, возможно, отвечает за увеличение количества T-трубочек в растущей мышце[4].
Функции
[править | править код]Электромеханическое сопряжение
[править | править код]T-трубочки — важное звено на пути от электрического возбуждения мышечной клетки до её мышечного сокращения (электромеханическое сопряжение). Когда мышца должна сократиться, стимулирующий электрический сигнал, приходящий от нерва или соседней мышечной клетки, вызывает деполяризацию мембраны клетки — так запускается потенциал действия. В состоянии покоя внутренняя сторона мембраны клетки заряжена отрицательно, и внутри неё содержится больше ионов калия, чем во внешней среде, и меньше — натрия. В ходе потенциала действия положительно заряженные ионы натрия входят в клетку, уменьшая её отрицательный заряд (этот процесс называется деполяризацией). При достижении определённого положительного значения заряда внутренней стороны мембраны ионы калия начинают выходить из клетки, постепенно возвращая её мембранный потенциал к значению, характерному для состояния покоя (этот процесс называется реполяризацией[англ.])[7].
Запуск мышечного сокращения начинается с выделения ацетилхолина вблизи двигательной концевой пластинки. Из-за этого возникает потенциал действия, который проводится со скоростью 2 м/с вдоль сарколеммы всего мышечного волокна. Далее потенциал действия проникает внутрь волокна через T-трубочки[8].
В сердечной мышце потенциал действия проходит вдоль T-трубочки, вызывая активацию кальциевых каналов L-типа, благодаря чему кальций начинает заходить внутрь клетки. Концентрация кальциевых каналов L-типа в T-трубочках выше, чем в остальной сарколемме, поэтому большая часть ионов кальция входит в клетку через T-трубочки[9]. Внутри клетки ионы кальция связываются с рианодиновыми рецепторами, которые находятся на мембране внутриклеточного кальциевого депо — саркоплазматического ретикулума. Активация рианодиновых рецепторов вызывает выход кальция из саркоплазматического ретикулума, что приводит к сокращению мышечной клетки[10]. В скелетных мышцах кальциевый канал L-типа непосредственно связан с рианодиновым рецептором на саркоплазматическом ретикулуме, благодаря чему рианодиновые рецепторы активируются без входящего тока кальция[11].
Важность T-трубочек не исчерпывается высокой концентрацией кальциевых каналов L-типа: они способны синхронизировать высвобождение кальция в клетке. Быстрое распространение потенциала действия по сети T-трубочек приводит к тому, что кальциевые каналы L-типа активируются в них почти одновременно. Поскольку в области T-трубочек сарколемма очень близко подходит к саркоплазматическому ретикулуму, почти сразу же запускается выход кальция из последнего. Благодаря синхронизации выхода кальция достигается более сильное сокращение мышцы. В клетках, у которых нет T-трубочек, таких как клетки гладких мышц, утратившие функциональность кардиомиоциты или мышечные клетки, у которых T-трубочки были удалены искусственно, кальций, попадающий в клетку, медленно диффундирует в цитоплазме и достигает рианодиновых рецепторов гораздо медленнее, из-за чего мышца сокращается слабее, чем при наличии T-трубочек[12].
Поскольку именно в T-трубочках происходит электромеханическое сопряжение, ионные каналы и другие белки, необходимые для этого процесса, находятся в T-трубочках в гораздо большей концентрации, чем в остальной сарколемме. Это касается не только кальциевых каналов L-типа, но также β-адренорецепторов[13], и их стимуляция усиливает выход кальция из саркоплазматического ретикулума[14].
Контроль концентрации кальция
[править | править код]Поскольку внутреннее пространство T-трубочек, по сути, является продолжением окружающей среды, концентрации ионов в нём примерно такие же, как во внеклеточной жидкости. Однако, так как концентрация ионов внутри T-трубочек имеет очень важное значение (особенно концентрация кальция в T-трубочках кардиомиоцитов), необходимо, чтобы эти концентрации оставались более-менее постоянными. Из-за того, что диаметр T-трубочек очень маленький, в них происходит захват ионов. Благодаря этому при снижении концентрации кальция во внешней среде (гипокальциемия), концентрация кальция в T-трубочках не меняется и остаётся достаточной для запуска сокращения[4].
Через T-трубочки происходит не только вход кальция в клетку, но также его выход наружу из клетки. Благодаря этому внутриклеточную концентрацию кальция можно жёстко контролировать лишь на небольшом участке, а именно, в пространстве между T-трубочкой и саркоплазматическим ретикулумом[15]. Натрий-кальциевый обменник, а также кальциевая АТФаза локализуются преимущественно в мембране T-трубочек[4]. Натриево-кальциевый обменник пассивно выводит один ион кальция из клетки в обмен на вход трёх ионов натрия. Благодаря тому, что процесс пассивный, то есть для него не нужна энергия в виде АТФ, через обменник кальций может как входить в клетку, так и выходить из неё в зависимости от комбинации относительной концентрации ионов Ca2+ и Na+, а также от напряжения на клеточной мембране (электрохимический градиент). Кальциевая АТФаза удаляет кальций из клетки активно, используя АТФ в качестве источника энергии[7].
Детубуляция
[править | править код]Чтобы изучить функции T-трубочек, можно искусственно разобщить T-трубочки и клеточную мембрану с помощью метода, известного как детубуляция. Во внеклеточную жидкость добавляют глицерин[16] или формамид[12] (для скелетных и сердечной мышц соответственно). Эти осмотически активные агенты не могут пройти через мембрану клетки, и при их добавлении во внеклеточную жидкость клетки начинают терять воду и сжиматься. При удалении этих веществ клетка быстро восстанавливает свой объём и возвращается к нормальным размерам, однако из-за быстрого расширения клетки T-трубочки отрываются от клеточной мембраны[17].
Клиническое значение
[править | править код]При некоторых болезнях структура T-трубочек изменяется, что может приводить к слабости сердечной мышцы или нарушению ритма её сокращения. Нарушения в структуре T-трубочек могут выражаться в полной утрате этих структур или только лишь изменении их ориентации и способе ветвления. Утрата или нарушение в строении T-трубочек нередко происходит при инфаркте миокарда[18]. Сердечный приступ может приводить к нарушениям в T-трубочках в желудочках, из-за чего сила сокращения уменьшается, как и шансы на восстановление[19]. Иногда при сердечном приступе происходит почти полная утрата T-трубочек в предсердиях, что снижает сократимость предсердий и может вызывать фибрилляцию предсердий[20].
При структурных изменениях в T-трубочках кальциевые каналы L-типа могут терять связь с рианодиновыми рецепторами. В результате время, необходимое для повышения концентрации кальция, увеличивается, что приводит к более слабому сокращению и аритмиям. Однако нарушения в T-трубочках могут быть обратимыми, и высказываются предположения, что структуру T-трубочек можно вернуть к нормальному состоянию при помощи интервальных тренировок[4][20].
История изучения
[править | править код]Идея существования клеточных структур, похожих на T-трубочки, была впервые высказана в 1881 году. Время, проходящее между стимуляцией клетки поперечнополосатой мышцы, и её сокращением слишком мало для того чтобы быть обусловленным перемещением химического сигнала от сарколеммы к саркоплазматическому ретикулуму. Было высказано предположение, что столь малое время может быть связано с наличием глубоких впячиваний мембраны мышечной клетки[21][22]. В 1897 году T-трубочки впервые удалось увидеть в световой микроскоп в сердечной мышце, в которую предварительно ввели чернила. После изобретения просвечивающего электронного микроскопа структуру T-трубочек удалось изучить детальнее[23], и в 1971 году были описаны продольные компоненты сети T-трубочек[24]. В 1990-х и 2000-х с помощью конфокальной микроскопии удалось получить пространственную модель сети T-трубочек, а также определить их размер и распределение[25]. С открытием кальциевых вспышек[англ.] стала прослеживаться связь между T-трубочками и выходом кальция[26]. Долгое время T-трубочки изучались только на примере скелетных мышц и желудочковой сердечной мышцы, но в 2009 году удалось увидеть хорошо развитую систему T-трубочек в мышечных клетках предсердий[20]. Текущие исследования сфокусированы на регуляции структуры T-трубочках и их изменениях при различных сердечно-сосудистых заболеваниях[27].
Примечания
[править | править код]- ↑ 1 2 3 Hong T., Shaw R. M. Cardiac T-Tubule Microanatomy and Function. (англ.) // Physiological Reviews. — 2017. — January (vol. 97, no. 1). — P. 227—252. — doi:10.1152/physrev.00037.2015. — PMID 27881552.
- ↑ Haddock P. S., Coetzee W. A., Cho E., Porter L., Katoh H., Bers D. M., Jafri M. S., Artman M. Subcellular Ca2+i gradients during excitation-contraction coupling in newborn rabbit ventricular myocytes. (англ.) // Circulation Research. — 1999. — 3 September (vol. 85, no. 5). — P. 415—427. — PMID 10473671.
- ↑ Richards M. A., Clarke J. D., Saravanan P., Voigt N., Dobrev D., Eisner D. A., Trafford A. W., Dibb K. M. Transverse tubules are a common feature in large mammalian atrial myocytes including human. (англ.) // American Journal Of Physiology. Heart And Circulatory Physiology. — 2011. — November (vol. 301, no. 5). — P. 1996—2005. — doi:10.1152/ajpheart.00284.2011. — PMID 21841013.
- ↑ 1 2 3 4 5 Ibrahim M., Gorelik J., Yacoub M. H., Terracciano C. M. The structure and function of cardiac t-tubules in health and disease. (англ.) // Proceedings. Biological Sciences. — 2011. — 22 September (vol. 278, no. 1719). — P. 2714—2723. — doi:10.1098/rspb.2011.0624. — PMID 21697171.
- ↑ 4. Calcium reuptake and relaxation. www.bristol.ac.uk. Дата обращения: 21 февраля 2017. Архивировано 25 апреля 2018 года.
- ↑ Caldwell J. L., Smith C. E., Taylor R. F., Kitmitto A., Eisner D. A., Dibb K. M., Trafford A. W. Dependence of cardiac transverse tubules on the BAR domain protein amphiphysin II (BIN-1). (англ.) // Circulation Research. — 2014. — 5 December (vol. 115, no. 12). — P. 986—996. — doi:10.1161/CIRCRESAHA.116.303448. — PMID 25332206.
- ↑ 1 2 M., Bers, D. Excitation-contraction coupling and cardiac contractile force (англ.). — 2nd. — Dordrecht: Kluwer Academic Publishers, 2001. — ISBN 9780792371588.
- ↑ Зильбернагль С., Деспопулос А. . Наглядная физиология. — М.: БИНОМ. Лаборатория знаний, 2013. — С. 68. — 408 с. — ISBN 978-5-94774-385-2.
- ↑ Scriven D. R., Dan P., Moore E. D. Distribution of proteins implicated in excitation-contraction coupling in rat ventricular myocytes. (англ.) // Biophysical Journal. — 2000. — November (vol. 79, no. 5). — P. 2682—2691. — doi:10.1016/S0006-3495(00)76506-4. — PMID 11053140.
- ↑ Bers D. M. Cardiac excitation-contraction coupling. (англ.) // Nature. — 2002. — 10 January (vol. 415, no. 6868). — P. 198—205. — doi:10.1038/415198a. — PMID 11805843.
- ↑ Rebbeck R. T., Karunasekara Y., Board P. G., Beard N. A., Casarotto M. G., Dulhunty A. F. Skeletal muscle excitation-contraction coupling: who are the dancing partners? (англ.) // The International Journal Of Biochemistry & Cell Biology. — 2014. — March (vol. 48). — P. 28—38. — doi:10.1016/j.biocel.2013.12.001. — PMID 24374102.
- ↑ 1 2 Ferrantini C., Coppini R., Sacconi L., Tosi B., Zhang M. L., Wang G. L., de Vries E., Hoppenbrouwers E., Pavone F., Cerbai E., Tesi C., Poggesi C., ter Keurs H. E. Impact of detubulation on force and kinetics of cardiac muscle contraction. (англ.) // The Journal Of General Physiology. — 2014. — June (vol. 143, no. 6). — P. 783—797. — doi:10.1085/jgp.201311125. — PMID 24863933.
- ↑ Laflamme M. A., Becker P. L. G(s) and adenylyl cyclase in transverse tubules of heart: implications for cAMP-dependent signaling. (англ.) // The American Journal Of Physiology. — 1999. — November (vol. 277, no. 5 Pt 2). — P. 1841—1848. — PMID 10564138.
- ↑ Bers D. M. Cardiac ryanodine receptor phosphorylation: target sites and functional consequences. (англ.) // The Biochemical journal. — 2006. — Vol. 396, no. 1. — P. e1—3. — doi:10.1042/BJ20060377. — PMID 16626281.
- ↑ Hinch R., Greenstein J. L., Tanskanen A. J., Xu L., Winslow R. L. A simplified local control model of calcium-induced calcium release in cardiac ventricular myocytes. (англ.) // Biophysical Journal. — 2004. — December (vol. 87, no. 6). — P. 3723—3736. — doi:10.1529/biophysj.104.049973. — PMID 15465866.
- ↑ Fraser James a., Hockaday Austin R., Huang1 Christopher L.-H., Skepper Jeremy N. [1] (англ.) // Journal of Muscle Research and Cell Motility. — 1998. — Vol. 19, no. 6. — P. 613—629. — ISSN 0142-4319. — doi:10.1023/A:1005325013355.
- ↑ Moench I., Meekhof K. E., Cheng L. F., Lopatin A. N. Resolution of hyposmotic stress in isolated mouse ventricular myocytes causes sealing of t-tubules. (англ.) // Experimental Physiology. — 2013. — July (vol. 98, no. 7). — P. 1164—1177. — doi:10.1113/expphysiol.2013.072470. — PMID 23585327.
- ↑ Pinali C., Malik N., Davenport J. B., Allan L. J., Murfitt L., Iqbal M. M., Boyett M. R., Wright E. J., Walker R., Zhang Y., Dobryznski H., Holt C. M., Kitmitto A. Post-Myocardial Infarction T-tubules Form Enlarged Branched Structures With Dysregulation of Junctophilin-2 and Bridging Integrator 1 (BIN-1). (англ.) // Journal Of The American Heart Association. — 2017. — 4 May (vol. 6, no. 5). — doi:10.1161/JAHA.116.004834. — PMID 28473402.
- ↑ Seidel T., Navankasattusas S., Ahmad A., Diakos N. A., Xu W. D., Tristani-Firouzi M., Bonios M. J., Taleb I., Li D. Y., Selzman C. H., Drakos S. G., Sachse F. B. Sheet-Like Remodeling of the Transverse Tubular System in Human Heart Failure Impairs Excitation-Contraction Coupling and Functional Recovery by Mechanical Unloading. (англ.) // Circulation. — 2017. — 25 April (vol. 135, no. 17). — P. 1632—1645. — doi:10.1161/CIRCULATIONAHA.116.024470. — PMID 28073805.
- ↑ 1 2 3 Dibb K. M., Clarke J. D., Horn M. A., Richards M. A., Graham H. K., Eisner D. A., Trafford A. W. Characterization of an extensive transverse tubular network in sheep atrial myocytes and its depletion in heart failure. (англ.) // Circulation. Heart Failure. — 2009. — September (vol. 2, no. 5). — P. 482—489. — doi:10.1161/CIRCHEARTFAILURE.109.852228. — PMID 19808379.
- ↑ Huxley A. F. The activation of striated muscle and its mechanical response. (англ.) // Proceedings Of The Royal Society Of London. Series B, Biological Sciences. — 1971. — 15 June (vol. 178, no. 1050). — P. 1—27. — PMID 4397265.
- ↑ HILL AV. The abrupt transition from rest to activity in muscle. (англ.) // Proceedings Of The Royal Society Of London. Series B, Biological Sciences. — 1949. — October (vol. 136, no. 884). — P. 399—420. — PMID 18143369.
- ↑ LINDNER E. Submicroscopic morphology of the cardiac muscle. (нем.) // Zeitschrift Fur Zellforschung Und Mikroskopische Anatomie (Vienna, Austria : 1948). — 1957. — Т. 45, № 6. — С. 702—746. — PMID 13456982.
- ↑ Sperelakis N., Rubio R. An orderly lattice of axial tubules which interconnect adjacent transverse tubules in guinea-pig ventricular myocardium. (англ.) // Journal Of Molecular And Cellular Cardiology. — 1971. — August (vol. 2, no. 3). — P. 211—220. — PMID 5117216.
- ↑ Savio-Galimberti E., Frank J., Inoue M., Goldhaber J. I., Cannell M. B., Bridge J. H., Sachse F. B. Novel features of the rabbit transverse tubular system revealed by quantitative analysis of three-dimensional reconstructions from confocal images. (англ.) // Biophysical Journal. — 2008. — August (vol. 95, no. 4). — P. 2053—2062. — doi:10.1529/biophysj.108.130617. — PMID 18487298.
- ↑ Cheng H., Lederer W. J., Cannell M. B. Calcium sparks: elementary events underlying excitation-contraction coupling in heart muscle. (англ.) // Science (New York, N.Y.). — 1993. — Vol. 262, no. 5134. — P. 740—744. — PMID 8235594.
- ↑ Eisner D. A., Caldwell J. L., Kistamás K., Trafford A. W. Calcium and Excitation-Contraction Coupling in the Heart. (англ.) // Circulation Research. — 2017. — 7 July (vol. 121, no. 2). — P. 181—195. — doi:10.1161/CIRCRESAHA.117.310230. — PMID 28684623.
Эта статья входит в число добротных статей русскоязычного раздела Википедии. |